译者按
- 本文汇总了文献上 GnRH 类似物作为青春期阻断剂用于跨性别青年的情况,讨论其益处、不良影响、与患者性别焦虑的关系,以及在世界各地的可用性与合法性。本文篇幅较长,共计约 1.2 万个汉字。
- 因译者能力所限,个别术语或段落的翻译或有纰漏、不妥之处,烦请指正。
摘要
青春期阻断剂是一种用于中止顺性别、跨性别青年青春期的药物。对于后者,已有明显证据提示在青春期用药及成年后,其幸福感、情绪、自杀倾向风险皆得到改善。停药后疗效可逆。现有证据未表明该药物对认知发展、智力或生育力有任何不利影响。该药物可能对骨密度有些微影响(主要见于跨性别女孩),但这缺乏高质量资料支持。
基于有限资料,处方医师可考虑为使用青春期阻断剂的跨性别青年开出钙补剂;而对刚开始激素治疗的跨性别女孩,可考虑使用透皮途径、而非口服的雌激素,以改善骨密度。
目前普遍认为,大多数儿童长大后会摆脱性别焦虑(即对此“断念”),但其缺乏证据支持;在广为流传的资料中所描述的“断念”发生率显然很不可靠。
青春期阻断剂难以获取;近来多个西方国家业已对此作出严格的使用限制,此趋势被多家医学会予以谴责。针对青春期阻断剂的随机对照试验很可能从未开展过,但不管怎样,现有证据明确表明其会带来极大的益处,风险也相对较小。
前言
青春期阻断剂——即促性腺激素释放激素(GnRH)类似物,最早于 1980 年代被引入医学用途(Swerdloff & Heber, 1983);最初其被研发用于替代前列腺癌的其它疗法,但不久便拓展到儿科,对性早熟的治疗产生了革命性影响。(性早熟即提前发生青春期,见于 8 岁以下女孩、9 岁以下男孩,是一种罕见现象;其还与多种不良后果相关,包括矮小、易嘲弄或欺侮他人、心理状况恶化等。)如将性早熟儿童的青春期中断数年再恢复,其表现会大幅好转。此后数十年间,青春期阻断剂一直作为性早熟的主要治疗手段。
1990 年代,青春期阻断剂开始用于跨性别青年:其可中断非预期的青春期,并给予他们更多的思考未来人生的时间(Cohen-Kettenis & van Goozen, 1998)。此类疗法起源于荷兰的阿姆斯特丹自由大学医学中心(VUMC),故有时被称作“荷兰疗法”。Cohen-Kettenis 等人 (2011) 在其研究中跟踪了一名在 VUMC 接受此疗法的荷兰患者,并在 22 年后发表论文。后来,随着寻求跨性别医疗服务的患者增多,青春期阻断剂的使用得到极大增长。
最近,青春期阻断剂陷入到了舆论漩涡中;多个国家寻求通过司法程序禁止其使用。其中,英国在 2020 年十二月的 Bell 诉 Tavistock 案件裁决后临时禁止了青春期阻断剂的使用(该裁决于 2021 年被提起上诉)。同样在 2021 年,阿肯色州成为美国首个宣布青春期阻断剂处方非法的州,此后多个州纷纷跟进。有批评者对青春期阻断剂的安全性、可逆性及有效性表示担忧。
本文旨在对有关青春期阻断剂用于跨性别青年及其安全性的文献进行评述,并对用药安全性、支持和反对其使用的观点进行全面评析。此外,尽管偶尔也会用诸如醋酸甲羟孕酮(一种孕激素制剂)等替代药物进行青春期阻断,但至今为止,GnRH 类似物仍为该用途最常用的药物,且最常被口头称作“青春期阻断剂”;故此,本文将主要着眼于 GnRH 类似物。
作用机理
GnRH 是人体内自然产生的一种激素,其可刺激脑垂体释放促卵泡激素(FSH)与促黄体激素(LH)。借此,人体性腺便可产生雌激素与睾酮。
GnRH 激动剂与 GnRH 受体结合并激活之,使其持续处于激发态;服药初期,其会引起 LH 与 FSH 升高,此后脑垂体的敏感度在数周内逐渐降低,从而使性激素的自然分泌中止。停药后,其效果自然逆转,性激素分泌在其被从人体清除后的一周左右恢复正常(Cedrin-Durnerin et al., 2000)。
GnRH 激动剂可作为注射剂开出,每 1–6 个月注射一次;作为小球每年植入一次;或者作为鼻腔喷雾剂,每日 2–3 次。其也有每日一次的短效注射剂,但临床实践中不用于青春期阻断。其常见种类有:亮丙瑞林 (Lupron; Eligard)、曲普瑞林 (Decapeptyl)、戈舍瑞林 (Zoladex)、组胺瑞林 (Supprelin LA)、那法瑞林 (Synarel) 和布舍瑞林 (Suprefact) 等。
而 GnRH 拮抗剂会像激动剂一样结合于 GnRH 受体,但不同的是,其不会激发之;实际上,其会与体内 GnRH 发生竞争,使后者失效。于是,其可在不引起激素水平升高的情况下产生同等效果。还有一点不同:GnRH 拮抗剂有口服剂型,其中部分可每日一服。其常见种类有:恶拉戈利 (Orilissa)、地加瑞克 (Firmagon)、西曲瑞克 (Cetrotide)、加尼瑞克 (Orgalutran; Antagon) 和瑞卢戈利 (Orgovyx; Relumina) 等。
可惜的是,GnRH 拮抗剂推出很晚,故目前尚未被作为青春期阻断剂普及开来。
用于有性别焦虑的青年人时,GnRH 激动剂会在其青春期开始后引入。GnRH 激动剂不用于未开始青春期的儿童;但是,其可在青春期当中任意时刻引入,以中断身体进一步的改变(Hembree et al., 2017)。
现有证据的完备性
医学上用于证明的最佳方式是随机对照试验(RCT)。简而言之,受试者会被随机分配到两个以上的治疗组(分支),各分支之间的唯一区别是其要接受的疗法。通常会有一组以安慰剂治疗,而另一组会以试验疗法治疗。双盲试验是最理想的:其中,无论受试者还是研究者都不知道哪一组在接受何种治疗。
迄今尚未有任何关于青春期阻断剂的此类试验进行,因此有人担忧,现有证据可能不足以支持其使用。
遗憾的是,RCT 对于青春期阻断剂可能不具备可行性,今后也很可能不会开展。关于其原因,Giordano & Holm (2020) 做了很好的总结:
有两个实际因素会妨碍 RCT 进行。
第一,因对青春期征兆感到厌恶而前往诊所寻求帮助的患者,不大可能会参与 RCT。其需要在一段较短时间内服用效力较弱、以至无效力的药物,而这种治疗会带来痛苦。受试者的招募即使并非不可能,也会相当困难。
第二,理想状态下,RCT 要么是双盲的(即无论研究者还是受试者都不知道谁获得了活性药物),要么在治疗方案无法对受试者隐瞒的情况下,让事先不知情的研究者去评定其疗效。隐瞒分配情况有助于减少在疗效评定中的偏差。但是,对青春期延迟的 RCT 无法确保信息的持续隐瞒。因为,GnRHa 对青春期延迟的疗效很快就会体现在试验组和对照组的受试者身上,也会被相关研究者及疗效评定人员所察觉。当窗纸被捅破,对生理及心理疗效的评定就可能会产生偏差。这也意味着,被分配到对照组的受试者可能会心生退意(可能性远高于治疗组),从而有产生偏差的可能;也可能会留在对照组的同时,在试验之外寻求青春期延迟治疗,从而对结果造成干扰。
Mul et al. (2001) 在其针对有性早熟的青少年的类似研究中遇到了这类问题:
研究最初安排了第三个分支,即对照组,其中的儿童未接受治疗。但后来,未治疗的对照组所有受试者的家长均拒绝继续参与本项目,转而在他处寻求 GnRHa 治疗,随后对照组被取消。
除了实施困难之外,此类 RCT 还面临着伦理问题。已有证据指出,不予青春期阻断剂治疗这件事便可导致持续伤害。在 RCT 中明知有此风险的情况下,仍对对照组造成伤害,这恐怕是不道德的;伦理审查委员会也不大可能允许此类 RCT 推进。
这并不是说这类研究一个也没有:例如,Costa et al. (2015) 就将 101 名同时接受心理指导和青春期阻断剂的患者和 100 名仅接受心理指导的患者进行比较(其并未随机分配或隐瞒分配情况)。其研究结果在下文有更多详情。
出于以上局限,本文将更多地引用群体研究的结果,使本文论据具备等同于其它高质量研究的说服力,使结论更完备——在其它医学领域,此手法也会被引入。鉴于 RCT 很可能无法开展,我们能够评价青春期阻断剂的方式仅此一种;如果说青春期阻断剂缺乏 RCT 就等于缺乏支持其使用的证据,可能会有点不厚道,因为一般的证据标准很可能无法满足,该论点也忽视了规模不小的现有文献。
对自杀倾向与幸福感的影响
现有证据有很多明确表明,青春期阻断剂用于有需求的人,与心理状况的改善有关——这是该用途的首要理由。
尽管不同研究所采用的方法不同,但其中对幸福感的评定大多采用以下三种标准化心理问卷:儿童总体评定量表(CGAS)、儿童行为量表(CBCL)以及青少年自评量表(YSR)。这三种皆旨在评定儿童的心理功能和异常行为;其中,CGAS 通常由医师评定,CBCL 由儿童父母或监护人填写,YSR 则由儿童自行填写。应当注意,以上量表已知在青年人中的评分更低,因为在青春期容易出现心理障碍及自残行为(Verhuist et al., 2003; Nock et al., 2013; Morey et al., 2017; Jung et al., 2018)。
Turban et al. (2020) 是迄今规模最大的调查幸福感的研究之一。该研究调查了 20,619 名美国成年跨性别者,其中 3,494 人(16.9%)报告其曾有对青春期阻断剂的需求,而这群人里仅有 89 人使用过青春期阻断剂。在曾使用青春期阻断剂的人群中,有 75.3% 曾有自杀意念,而未使用者有 90.2% 曾考虑自杀。而当控制收入、家庭支持状况和教育水平等人口特征之后,青春期阻断剂仍显著与自杀意念的终生几率减少有关。
另一项类似的大型调查由 Green et al. (2021) 进行,其中调查了 11,914 名认同为跨性别或非二元性别的 13–24 岁美国人。该研究将接受过激素治疗或青春期阻断剂治疗的人群,与对青春期阻断剂有需求、但未使用的人群进行了比较;其发现,接受治疗者具有显著更低的抑郁、自杀意念及自杀行为发生率。
13–17 岁人群的情况与此相同——这个群体获取青春期阻断剂的可能性显著更大。
Costa et al. (2015) 对在英国 NHS 性别认同发展服务就诊的 201 名有性别焦虑的青年人进行研究。其中一半被认为符合立即使用青春期阻断剂的条件,并辅以心理支持。另一半则被认为不符合立即用药的条件,其原因包括精神问题、与父母或近亲不合等;他们在 18 个月内仅接受心理支持。各患者的总体心理功能以 CGAS 问卷进行评定。
两个组别接受心理支持后,心理功能皆有显著改善;但仅接受心理支持的一组截至研究结束未再进一步好转,而使用青春期阻断剂的一组有了更大改善。论文作者指出,青春期阻断剂治疗组的最终 CGAS 评分,几乎完全与未发现存在心理、精神症状的青少年的得分相一致。
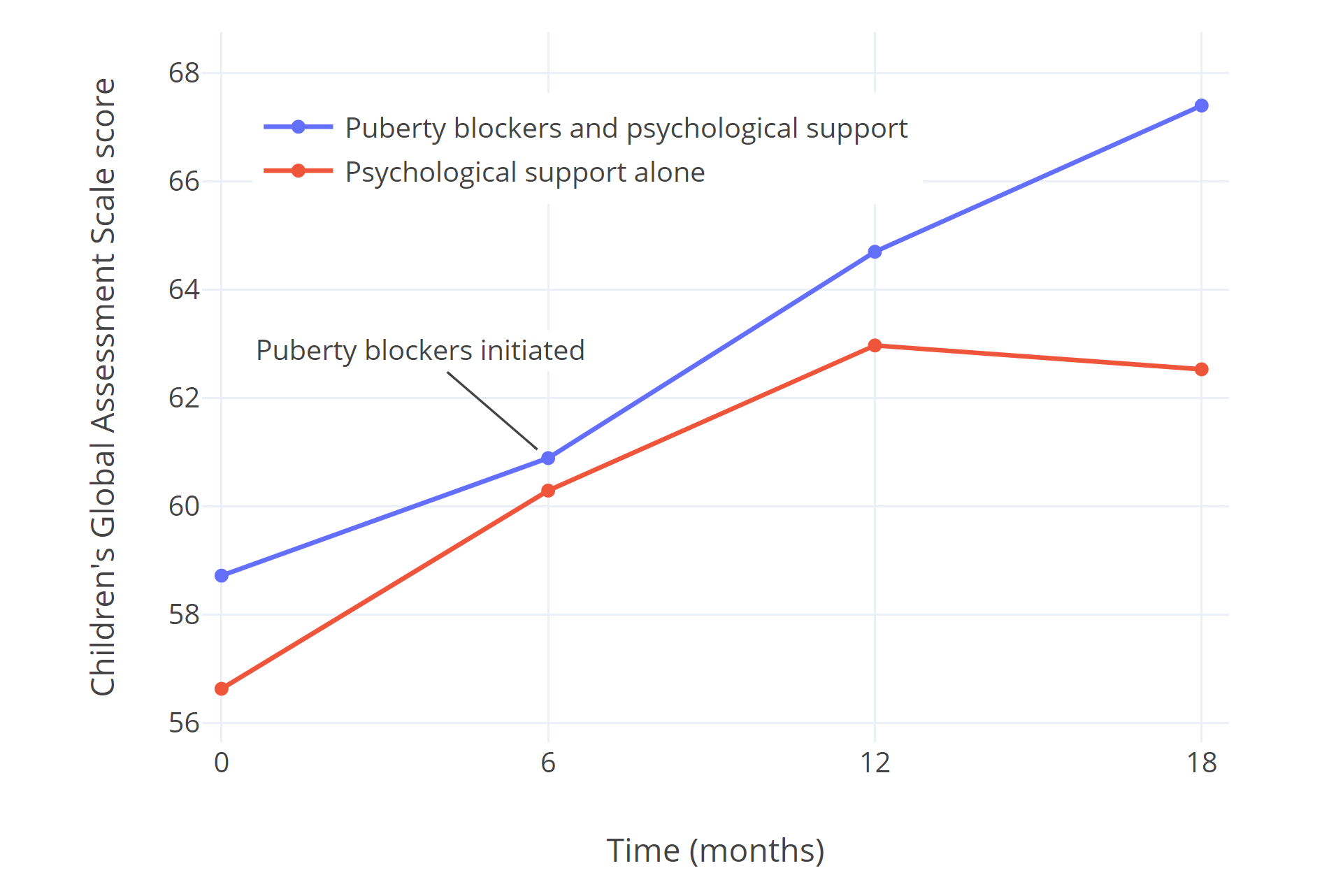
图一: Costa et al. (2015) 的研究中仅接受心理支持(红线)与同时接受青春期阻断剂治疗(蓝线)的跨性别青年的 CGAS 评分比较。
随后,Carmichael et al. (2021) 也在上述英国性别认同诊所开展研究,其公布截然不同的结果之后被英国各大媒体广泛报道。其跟踪了 44 名有性别焦虑、使用青春期阻断剂的青年。相比于上述 2015 年的研究,这批青年的 CGAS 得分基线更高,改善较慢,改善幅度也较小。该研究采用的问卷结果中部分有改善,部分则无;即使从可比数据看,其结论仍与早前大相径庭。
值得注意的是,从部分研究者对幸福感、社会接受程度以及自我认知的衡量尺度看,这批青年均报告自己有很大的改善;而从家长的角度看,则几乎没有改善。
该研究将青春期阻断剂对受试者总体体验的作用定为“有积极作用”,但其难以从中得出任何结论。
De Vries et al. (2011) 与 de Vries et al. (2014) 对在 VUMC 性别诊所就诊、使用青春期阻断剂的同一批跨性别青年的心理表现进行了研究。二者皆以多项测试来调查心理表现,其中 2014 年的研究跟踪用药后多年的状况,以及接受性别重置手术之后的状况。
CGAS 等标准化测试表明,该群体的心理功能随时间改善,抑郁程度随时间降低。以青春期阻断剂治疗期间和治疗后多年(换以激素治疗和手术),幸福感均有显著提高。不同于 Carmichael 等人,该研究中 CBCL 与 YSR 得分均有改善。
Van der Miesen et al. (2020) 分别让三组荷兰青年填写心理感觉问卷,他们是:272 名未曾使用青春期阻断剂的跨性别青年;178 名正使用青春期阻断剂的青年;以及 651 名普通顺性别青年。
该研究发现,未治疗的跨性别青年心理功能较差,而接受青春期阻断治疗者的心理功能及幸福感与顺性别青年相近。以上结果与 Costa et al. (2015) 如出一辙——后者提到青春期阻断剂使用者的 CGAS 得分接近于年龄相近的一般人群。
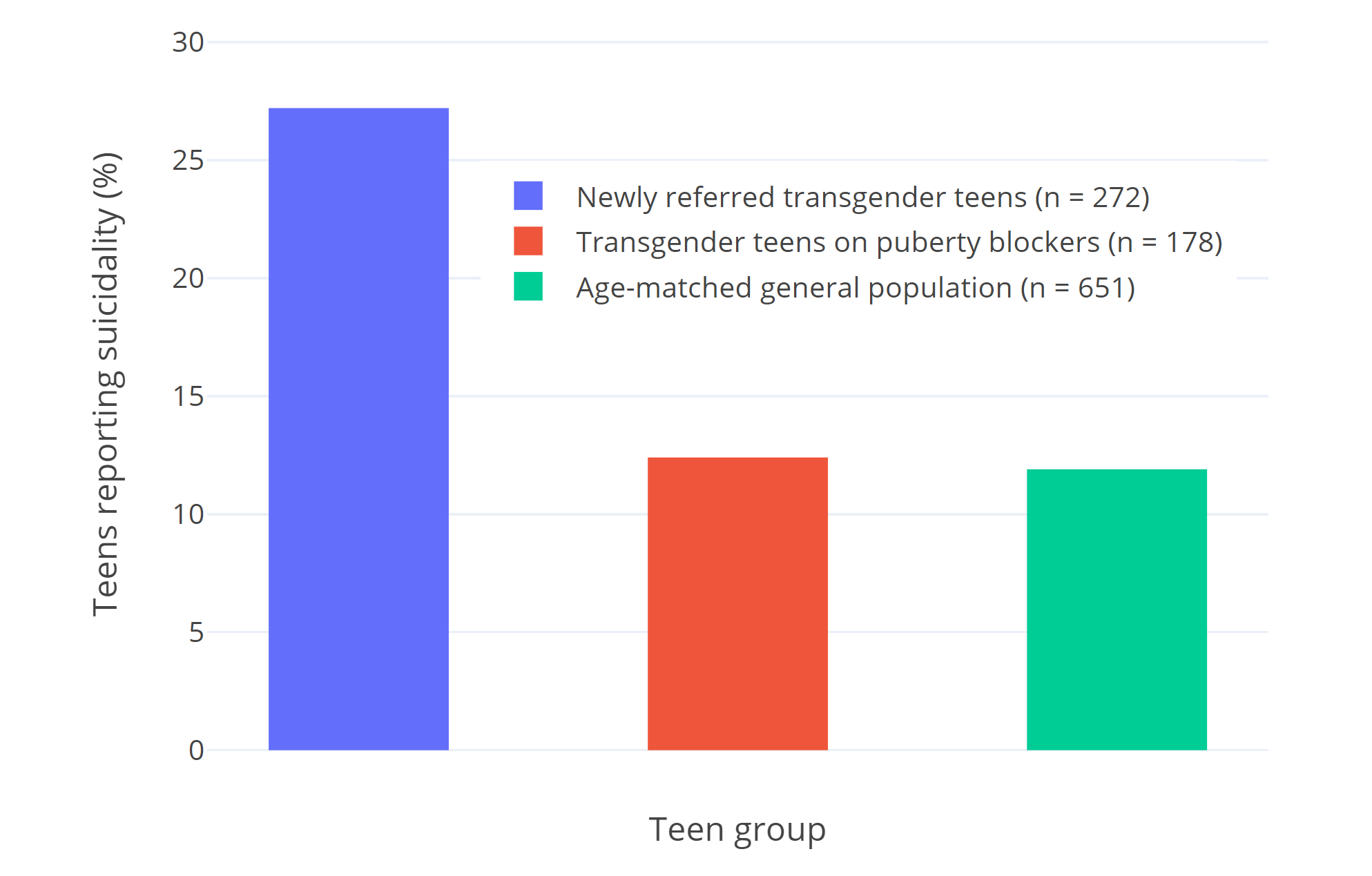
图二: van der Miesen et al. (2020) 的研究中报告有自杀倾向的青年比例。其中:
- 蓝柱——新转诊的跨性别青年(272 人);
- 红柱——正使用青春期阻断剂的跨性别青年(178 人);
- 绿柱——年龄相近的一般人群(651 人)。
如对以下两种说法之一表示认同,即表明有自杀倾向:
- “我会蓄意尝试自残或自杀。”
- “我考虑自杀。”
在荷兰的跨性别青年当中,自杀倾向未随时间明显改变,这使得群体差异可能性不大(Arnoldussen et al., 2020)。
除以上研究之外,还有多项规模较小、相关性较低的研究,也对使用青春期阻断剂的跨性别青年的幸福感进行了评定,其报告(该药)对生活体验有积极作用(Khatchadourian et al., 2014; Achille et al., 2020; Kuper et al., 2020)。无任何研究报告青春期阻断剂会导致心理功能恶化、或出现负面心理作用。
总而言之,以上结果明确表明青春期阻断剂可改善有性别焦虑的儿童的幸福感及心理功能。此外,其还表明如果不恰当地不予青春期阻断剂治疗,可能会在日后产生负面影响,例如自杀倾向增加。
有别于常识的是,以上研究中有多项指出青春期阻断剂并不会让性别焦虑减弱(de Vries et al., 2011; Carmichael et al., 2021)。这里提请注意,这项发现指的是转变意愿,而非心理幸福感;其基于乌得勒支性别焦虑量表而得(de Vries et al., 2006)。具体而言,用于男性倾向跨性别者的量表会询问患者是否对以下说法表示认同:
- “我想表现得像男孩一样。”
- “我希望我出生时就是男孩。”
- “我厌恶有乳房。”
- “每次当我被当成女孩时,我都会很难过。”
关于部分研究所提出的青春期阻断剂不会使性别焦虑减弱这点,其意味着使用青春期阻断剂后的儿童不会改变对自身是跨性别者的认同。他们仍将寻求转变。De Vries et al. (2011) 指出这是预期结果:
符合预期的是,青春期阻断并未使性别焦虑缓解。早前研究已表明,只有跨性别激素治疗及手术等性别重置手段可消除性别焦虑。本研究中有性别焦虑的青年,在青春期阻断期间,无一放弃其重置性别的意愿。这项发现佐证了早前研究的结果——即经严格诊断(有性别焦虑)的青年人,直至青春期后期或成年前期,都维持着性别焦虑。
对生育力的影响
不同于激素治疗,青春期阻断剂被认为不存在任何使生育力永久受损的风险。多项对以青春期阻断剂治疗的患者进行长期跟踪的研究,均发现其生育力保持完好。而 Feuillan et al. (1999)、Heger et al. (1999)、Heger et al. (2006) 以及 Lazar et al. (2014) 等其它研究中则发现,用于治疗性早熟的青春期阻断剂并未造成患者的生育力受损。在治疗后数年到数十年时间里,这批总计数百人的患者群体可正常生育,对辅助生殖技术的需求未增多,受孕也很顺利。
即使连续使用青春期阻断剂达数十年,现有文献也无一指出其会使生育力永久受损。
值得关注的是,跨性别人群即使未经过任何药物治疗,其精子畸形发生率也要高于顺性别人群(Li et al., 2018; Rodriguez-Wallberg et al., 2021)。
与之相反,激素治疗会导致生育力永久受损(Hembree et al., 2017; Cheng et al., 2019)。如青春期阻断剂治疗前从未进行生育力保存,则在进行前必须停药,且最好在激素治疗开始之前进行。停用青春期阻断剂后,非预期的性征会恢复发展。跨性别者可能会对此极其反感,从而会停止继续进行生育力保存。
尚无资料表明生育力完全恢复需要停用多长时间的青春期阻断剂;其可能取决于初次引入青春期阻断剂的年龄。Bertelloni et al. (2000) 发现,患性早熟的男孩停用青春期阻断剂达 0.7~3 年之后,发生了首次遗精。
Barnard et al. (2019) 报告了一名跨性别者自 17 岁起每月服用一次亮丙瑞林,连续六个月;停药三个月后,其产生的精子无一存活;五个月后,其精子变得可存活。
不过,跨性别人群几乎不会进行生育力保存;据估计,在北美仅有不足 5% 进行了生育力保存(Chen et al., 2017; Nahata et al., 2017)。Pang et al. (2020) 的研究有一部分是对 102 名澳大利亚跨性别青年询问其未进行生育力保存的原因。统计结果如下:
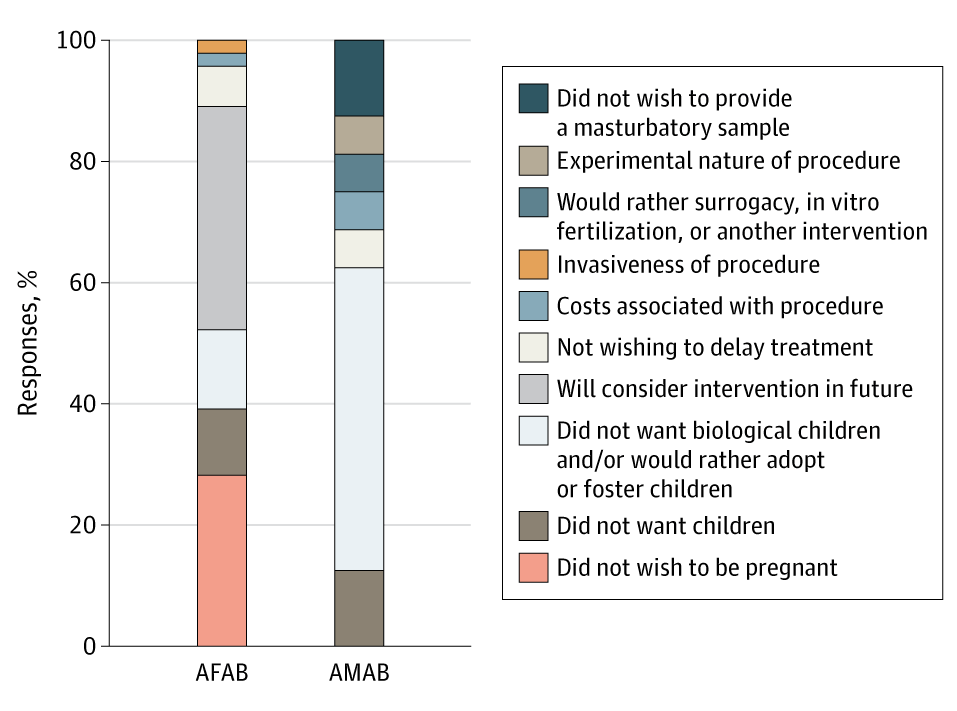
图三: Pang et al. (2020) 的研究中,澳大利亚的跨性别青年未进行生育力保存的原因。由上而下:
- “不愿提供由自慰而来的精子”
- “此举有实验性质”
- “考虑代孕、体外生殖或其它干预手段”
- “此举会造成侵犯”
- “此举开销较大”
- “不愿推迟治疗”
- “考虑将来用干预手段”
- “不想要生物学后代”和/或“考虑收养或领养孩子”
- “不想要孩子”
- “不愿怀孕”
左柱:出生指派性别为女(AFAB);右柱:出生指派性别为男(AMAB)。
综上,目前尚无证据支持青春期阻断剂可造成不育;停用之后生育力会恢复。然而,开始并持续以青春期阻断剂治疗的人群停药率低,进行生育力保存者占比也低,因此不大可能有生物学后代。临床指南建议,应与寻求青春期阻断剂治疗的青年人商讨是否进行生育力保存,同时要求其家长参与讨论(Hembree et al., 2017)。
对骨密度的影响
骨密度是一项衡量骨骼无机物含量的指标;其可通过双能 X 线吸收(DEXA)扫描等成像技术测量,用于预测患者的骨折风险。临床上将低骨密度称为骨量流失,严重者称为骨质疏松症(多见于老年人)。
从本评述的角度看,与骨密度相关性最高的指标是 Z 值:其表示某患者的骨密度相对于其他同年龄、同性别人群的差异。如 Z 值为零,意味着骨密度与一般人群相当;较小的偏差(如 -0.2)表明其不一定相当;而一旦低于 -1,就表明可能有问题了。
已有人对青春期阻断剂对骨骼健康的影响表示关切。青春期对骨密度的积累至关重要:其中性激素是骨密度增加的重要推手。使用青春期阻断剂后,此过程会被推迟,从而会导致短期内骨密度与 Z 值相较正常经历青春期的同龄人偏低。短期 Z 值的偏差可能不那么重要,但其长期效应非常关键——相关问题集中在至成年时 Z 值的长期变化如何,以及青春期阻断剂是否会对日后的骨折风险产生影响。文献上对此尚不明确。
Klink et al. (2015) 发现,跨性别女孩及跨性别男孩在治疗前和治疗后长期跟踪期间,Z 值均偏低。该研究表明青春期阻断剂对骨密度终点有较小负面作用,不过其中多次测量均未形成有统计学意义的差异。该研究中跨性别女孩的 Z 值明显低于跨性别男孩。
Vlot et al. (2017) 发现,激素治疗开始两年后,(患者)Z 值逐渐向正常值恢复。跨性别男孩的 Z 值终点略低;而跨性别女孩(用药后)的效果远更明显,其治疗前及治疗后均测得有意义的较低 Z 值。
无独有偶,Schagen et al. (2020) 也发现在其研究群体中,跨性别男孩的 Z 值终点在三年激素治疗后恢复正常;而跨性别女孩在治疗前及治疗后均维持有意义的较低 Z 值。
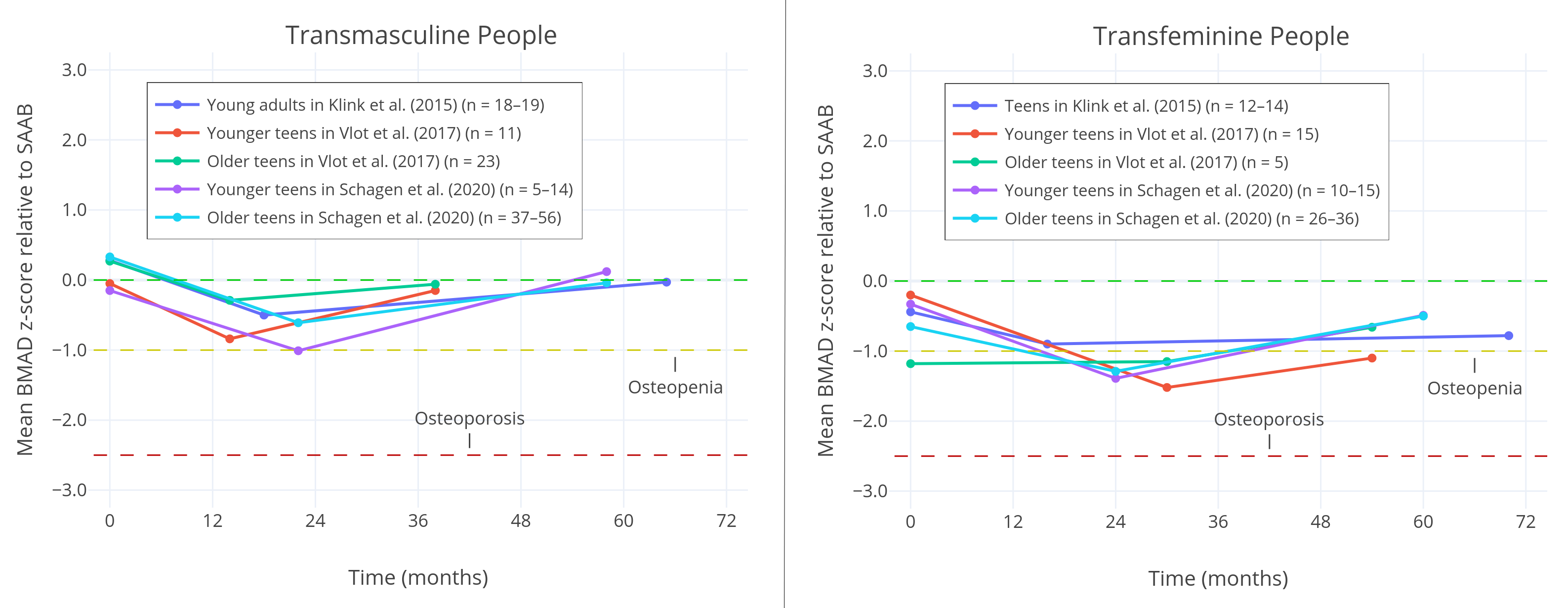
图四: 多项研究中男性、女性倾向跨性别者的腰椎表观骨密度(BMAD)。各研究均在三个时间点进行测量:青春期阻断剂治疗开始时,激素治疗开始时,以及激素治疗多年后。临床上 Z 值低于 -1,视为骨量流失;低于 -2.5,考虑有骨质疏松症。如图所示,跨性别女孩的骨密度在治疗前、治疗期间及治疗后均明显偏低,而跨性别男孩的情况截然不同。跨性别女孩使用青春期阻断剂的时长也偏长。
Guaraldi et al. (2016) 在其文献评述中发现,相比于未治疗的同龄人,使用青春期阻断剂的性早熟患者在治疗期间有较低的骨密度;而青春期开始后骨密度一般会恢复,长期跟踪后骨密度与一般人群相差无几。综合跨性别男孩的相关结果来看,跨性别女孩骨密度偏低可能不应仅归咎于青春期阻断剂本身,还要归咎于后续的激素治疗不够理想。
以上研究中跨性别女孩的激素治疗处方不够理想,体现在以下方面:首先,三项研究中女性倾向跨性别者均使用很低的成人维持剂量(不超过 2 mg/天的口服雌二醇);该剂量应可达到约 50 pg/mL 的血清雌二醇水平,平均雌二醇暴露量低于顺性别妇女(Aly, 2018; Aly, 2020)。多篇临床指南均推荐维持更高的水平;某些研究认为,相较于低剂量,如此可对骨密度终点有较小正面影响(Roux, 1997; Riggs et al., 2012)。事实上,这三项研究的作者自己也提到,以上剂量较低,可能不足以让骨密度达到理想水平。
还需注意,以上研究均使用了口服雌激素。口服雌激素可显著降低胰岛素样生长因子-1(IGF-1)的水平(Isotton et al., 2012; Southmayd & De Souza, 2017)——这种物质被认为对骨密度的积累有重要作用,与骨密度密切相关(Barake, Klibanski & Tritos, 2014; Locatelli & Bianchi, 2014; Ekbote et al., 2015; Lindsey & Mohan, 2016; Barake et al., 2018)。一些专家建议,对患有 Turner 综合征的女孩应使用透皮雌激素、而非口服,以改善骨密度(Davenport, 2010);此举也得到初步证据支持(Zaiem et al., 2017)。
因此,口服雌激素通行于跨性别青年的情况尽管鲜少被临床指南加以讨论,但这确实会带来一些问题;如换以透皮雌激素,可能会对骨密度终点有所改善。
最后一点,以上研究无一对与低骨密度相关的生活方式因素进行控制;例如运动、吸烟、补充维生素 D 以及补钙等。这些对骨密度皆有很大影响。
跨性别者(无论青年还是成年人)吸烟的几率更大,运动及补钙的几率更小(Jones et al., 2018; Kidd, Dolezal & Bockting, 2018);这被确信是各年龄段的跨性别者的骨密度大多在治疗前就偏低的原因。
这些因素如得以控制,对现有资料会造成明显畸变;但未控制的情况下,从以上研究很难得出可靠的结论,也不能证实青春期阻断剂与骨密度终点偏低之间的联系。假设这种联系确实成立,其影响恐怕也不大,不会抵消其带来的益处。
值得一提的是,Antoniazzi et al. (2003) 报告了使用青春期阻断剂的性早熟患者当中,服用钙补剂之后骨密度维持得更好。跨性别青年摄入的钙大多不足(Lee et al., 2020),因此尚需更多改善其骨密度的研究。除补钙以外,生活方式干预、换用透皮雌激素,以及避免使用低于成人生理剂量的雌二醇,对骨骼状态的改善或许要比现有临床实践来得更佳。
对智力与认知发展的影响
有人会对青春期阻断剂对智力及认知发展的影响表示关切。迄今相关研究非常稀缺,其中最常被引用者的研究对象是绵羊,而非人类(Hough et al., 2017);其次是仅含一名患者的个案研究(Schneider et al., 2017)。仅有两项规模较大的研究对此有所探讨:
Staphorsius et al. (2015) 是唯一一项对象为跨性别人群的相关研究,研究中以伦敦塔测验及智力测试来评定受试者表现。研究发现,实验组和对照组之间的执行功能无显著差异;智力方面,接受青春期阻断剂的跨性别女孩表现略低于对照组,而跨性别男孩对比对照组无统计显著性的差异。许多因素可能导致这种差异,例如年龄差、生活方式、样本数很小等。
Wojniusz et al. (2016) 对 15 名患有性早熟的女孩使用青春期阻断剂的情况进行评定,并与对照组的 15 名同龄人进行比较。两组的智力得分相似。
两项研究皆仅有很少的受试者,皆未记录认知表现基线,也未对混杂因素进行控制。因此,很难从中得出有用的结论。临床上将青春期阻断剂用于儿童已有数十年之久,其经验表明该药不大可能会对智力有特别大的影响;但由于缺乏规模更大、质量更好的研究,当下尚无法对此盖棺定论,还需更多研究以佐证。
患者的“断念”
使用青春期阻断剂的患者停药率非常低,仅有不足 5% 停药后未进行激素治疗(Wiepjes et al., 2018; Brik et al., 2020; Kuper et al., 2020)。有人会认为,这可能意味着当儿童被青春期阻断剂推向几乎确定无疑的性别转变之路时,其反而会改变主意。
尽管普遍认为大多数有性别焦虑的儿童长大后会摆脱之,从而无需治疗,但鲜少有强力证据支持该观点——这很令人诧异。现有研究中报告的性别焦虑中止比例,为 43%(Wallien & Cohen-Kettenis, 2008)到 88%(Drummond et al., 2008);但其研究方法存在明显问题。
历史上,在 20 世纪,跨性别认同被视为负面表现:其表明患者需要被矫正,例如接受厌恶疗法。后来,对跨性别者的文化观念发生了改变。较早前有关性别焦虑中止率的研究,大多反映了这种现象。例如,Kosky (1987) 描述了八名男孩因有“女人气”和变装表现,在精神病院住院接受特别治疗以试图矫正。如今,对以上表现的包容度更高了,其与跨性别认同也不再完全划等号。显然,形如 Kosky (1987) 的研究无法用于估计现代有性别焦虑的儿童的断念几率。
另一批 1960 到 1980 年代的研究与此类似(Bakwin, 1968; Lebovitz, 1972; Zuger, 1978; Money & Russo, 1979; Davenport, 1986)。其中大多先于美国《精神疾病诊断与统计手册》第三版(DSM-3),也即有正式诊断标准出现之前发表。这些研究鲜少关注自行报告的性别认同;相反,其更倾向于性别不一致行为,例如变装——这与跨性别认同不完全划等号。多数研究在对患者的治疗中主要试图让其打消念头,采用的一些手段如今已被世界许多地区归为扭转治疗而禁止。如今社会既然开明许多,再用这些研究来推测现代跨性别者的断念几率就不合时宜了。
相关研究倒也有一小部分是近年发表的。近期文献中报告的断念比例最高约为 88%,来自三项被引用较多的加拿大研究:Drummond et al. (2008)、Drummond et al. (2018) 以及 Singh, Bradley & Zucker (2021)。遗憾的是,上述研究显然很可能带有偏见:出现如此断念比例的那家诊所,被指控存在扭转治疗,其后于 2015 年被关闭。一项独立性评述发现,该诊所“无法证明其未使用修复性手段”;评述中写道,多名儿童及其家长报告该诊所对其有侵犯及恫吓行为。例如:
有人描述其评定过程带有侵犯性,甚而带有创伤性,像是“被拨弄”。其像是被多名观察者以单向镜观察着,会令人不适。问的问题很多给人不相干的感觉,或不必要的侵犯(尤其是与性幻想有关的);特别地,有时会不设情境和理由,以及在似乎未得到充分同意、甚至无知情同意的情况下进行询问。另外,尚不清楚是否有这种提问对患者的任何可能益处的解释。小病人的家长报告,他们的孩子显然对(该诊所)就性别不一致询问其的方式感到非常不适,随后跟家人报告这点,“仿佛我的孩子不像个正常人一般”。一名家长表示,她跟该诊所的医师就这点进行沟通时,对方对她“很不耐烦”。
多名患者报告,其就他们的顾虑质疑 Zucker 医生时遭到了威胁,被要求必须服从之。多名消息人士对此有过评论。
从图表资料所展现的立场可以反映,性别表达及性别差异的多样性(在该诊所)未被平等对待。例如,有一名儿童的性别焦虑及身体焦虑均得到解决;多名消息人士表示其情绪维持良好,社交与学业能力也很令人满意。即使如此,该儿童的家长在其出院时仍被要求鼓励其多与其他顺性别男孩作伴,因为其言谈举止很有“女人气”。这并不符合该病人或其家人的目的。
以上或许解释了为何这三项研究所发现的断念比例要高于其它近期文献;这也使如此比例显得不大具备代表性。还有另一种可能:如 Steensma & Cohen-Kettenis (2018) 所述,所在地区对性别不一致的社会氛围可能很大程度上也造就了这种结果。
Steensma et al. (2011) 与 Steensma et al. (2013) 开始就可能导致儿童持续有性别焦虑或对其断念的因素进行调查。其中 2011 年的研究报告断念比例达 45%,而 2013 年的研究中为 73%。以上数值曾受到质疑,原因是在研究中所有未能持续跟踪的儿童均被假定已断念,这可能使得其数值偏高。但更值得一提的是,Steensma & Cohen-Kettenis (2018) 论文的作者声明其论文被人断章取义,其中数值不宜用于推测断念比例:
不同于(外界)所指,我们并未对儿童的性别认同进行研究。实际上,我们研究了儿童因性别不一致引起的痛苦——足以使其寻求医疗帮助——的持续性与对其的断念。[…]
这种情况下,“断念”一词并不能代表断念者的自我认同发生变化。这些儿童仍可能会为其性别体验和性别表达感到疑惑,摇摆不定,想要摸索什么,也会试图搞明白自己想要怎样的生活。显然,在他们那个生命阶段,他们不再需要某种形式的性别肯定治疗。
重申一遍,由于本研究目的及设计所限,我们未报告本研究样本的(持续性性别焦虑或断念)流行率。另外,在 2013 年研究中的样本群体并未包含转诊至阿姆斯特丹诊所的年龄较小的儿童。因此,该群体所报告的持续性性别焦虑或断念流行率并不可靠。
最后仅剩的一个近期研究来自 Wallien & Cohen-Kettenis (2008)。该研究显然质量较高,提供的估计值也最为可信:平均十年跟踪期内,维持性别焦虑的受试者比例为 27%,断念比例为 43%。其余 30% 未能持续跟踪。
以上研究(包括 Wallien & Cohen-Kettenis (2008) 在内)仍存在多个问题,让人怀疑其资料的可靠性。
首先,以上研究中的儿童被通过 DSM-3 或 DSM-4 诊断标准来确诊——此二者如今已被新版本取代。旧版标准中,性别认同并非诊断条件之一:多种性别不一致行为均可作为“性身份障碍”的诊断条件,但自我对另一种性别的认同、或者对其性别身份或性征感到的痛苦,均不计入在内(Temple Newhook et al., 2018)。
惊人的是,除 Steensma et al. (2011) 以外,所有研究或多或少都将根本不符合当时 DSM“性身份障碍”诊断标准的儿童纳入在内。例如在 Wallien & Cohen-Kettenis (2008) 的研究中,有四分之一的受试者不符合诊断标准;这部分人被假定为跨性别者,加入到了断念比例的推断当中,其诊断意见为“性身份障碍,未特指”——这个归类是指可能无必要寻求医学转变,但可能偶尔变装、只考虑要去势、或者是有性别焦虑的间性人。研究者未提及这部分人的具体状况,但 Wallien & Cohen-Kettenis 以及 Steensma et al. 均在其研究中报告,所有(或几乎所有)持续有性别焦虑的人均符合 DSM 诊断标准,而断念者仅有一半左右符合标准。
除上述以外,长期跟踪的资料就很匮乏了。有性别焦虑的儿童可能会在其青年期对性别转变断念,但步入成年后反而开始转变过程;其原因包括同龄人的压迫、家长不理解等。尚未对这种现象是否具有明显的发生率进行研究。
诚然,以上研究表明有不明比例儿童的性别焦虑会随时间化解;但常作为金科玉律被引述的较高断念比例应当缺乏证据支持。有人担心在儿童长大后就会摆脱性别焦虑的情况下,施以青春期阻断剂会使其误入转变之路;这其实属于本末倒置——持续有焦虑的儿童本就有更大几率符合诊断标准,继而才使用青春期阻断剂的。
目前有多项资金充裕、针对有性别焦虑的年轻人的超大型研究,正在美国(Olson-Kennedy et al., 2019)、澳大利亚(Tollit et al., 2019)及英国(Kennedy et al., 2019)开展,其提供的高质量资料不久后有望取代现有文献。
持续比例、断念比例像是一种二元视角,应放到更大尺度的背景下看待。既然儿童的需求会随时间发生改变,我们假设,某个儿童可能会对其性别感到疑惑,甚而在使用青春期阻断剂后仍无法消除其疑惑,但假以时日,其决定不去考虑转变——这种情况下,青春期阻断剂可能在那个特定时段符合儿童之需,并且特别地,由于其效果可逆,其不会造成什么必然损害或者遗憾。无论是成为跨性别者,还是成为顺性别者,均不能视为其负面后果之一。Temple Newhook et al. (2018) 在其评论文章中写道,有必要尊重儿童的意愿与自主性,也应当抛弃诸如“孩子的性别认同今后应该怎么发展”这样的问题,转而考虑更有意义的“怎样才能更好地支持孩子性别认同的发展”。
患者的后悔意愿
考虑持续比例与断念比例时,可以询问患者其对青春期阻断剂治疗的感受如何,以及其是否为此后悔。有关这点的研究较为有限:
一项大型回顾性评述提取了 1972~2015 年期间在荷兰 VUMC 诊所接受治疗的所有 6,793 名患者的医疗档案,发现共有 14 名患者(0.2%)对其治疗感到后悔。14 人中有的接受青春期阻断治疗,有的接受激素治疗,有的接受手术;其中 5 人因缺乏社会接受度而心生悔意(Wiepjes et al., 2018)。
De Vries et al. (2014) 在其跟踪的 55 名接受青春期阻断剂治疗、激素治疗或手术的跨性别患者中,未发现有后悔意愿者。无论接受青春期阻断剂治疗、激素治疗,还是随后的性别重置手术,该群体的心理幸福感均有改善之势。
Vrouenraets et al. (2016) 采访了 13 名曾在荷兰某性别认同诊所就诊的青年人,其中 12 名曾接受青春期阻断剂治疗。当谈及青春期阻断剂的长期风险时,多数人回答,该药让其生活更愉悦的好处远远超过了风险。该研究所采访的儿童引述如下:
“即使有什么长期后果,也不能和痛苦的感觉相提并论;一天不去阻止青春期,就一天都在痛苦。”(18 岁跨性别男孩)
“很多人都说这可以选择,但这对我而言没有选择。当然,这确实是一种抉择:是要快乐地活,还是要痛苦地活。”(14 岁跨性别女孩)
他们还讨论了媒体对跨性别者日益增长的关注度,其中一名说道:
“媒体报道让我了解到‘性别焦虑’这个概念;很多人都有,而且能够得到治疗。在此之前我感觉就我一个人有。”(18 岁跨性别男孩)
获取青春期阻断剂的便利性
尽管不同地域获取青春期阻断剂的难度差别很大,但总体上获取之普遍较困难。
在美国,Turban et al. (2020) 发现青春期阻断剂的获取难度与家庭收入有关;其每年需花费 4,000 至 25,000 美元,且有多种无法被保险垫付。该研究还发现,未认同为异性恋或双性恋的跨性别青年接受青春期阻断剂治疗的可能性较低。在接受青春期阻断剂治疗的人群中,有 60% 报告其就诊路程不超过 25 英里,29% 需驱程 25~100 英里,11% 的路程达 100 英里以上。
截至 2021 年,已有多个州推动立法禁止青春期阻断剂的使用,其中阿肯色州成为首个通过相关法案的州。多个由数千名医学专家组成的大型专业机构,已就相关立法表示谴责(美国青少年精神医学会, 2019; 美国医学会, 2021; 美国内分泌学会, 2021)。
在英国,等待青春期阻断剂初次用药预约的队列可长达四年之久,乃至更长。由于 Bell 诉 Tavistock 案件导致青春期阻断剂合法性的变动,其获取状况变得极其混乱:在案件裁决生效至被推翻的九个月里,17 岁以下人群皆不能从公共医疗系统获取青春期阻断剂,而据报道不受裁决影响的 16 岁以上青年人也被停药了。与 Bell 诉 Tavistock 案件有关的禁令被多个跨性别健康领域的权威医学协会予以谴责,其中包括 WPATH、EPATH、USPATH、AsiaPATH、CPATH、AusPATH 以及 PATHA 等;其在联合声明中说道,他们确信这会对受影响的患者造成很大伤害(WPATH, 2020)。“大赦国际”英国分部也对此予以谴责(“大赦国际”英国分部, 2020)。
在瑞典,卡罗琳斯卡大学附属医院旗下的 Astrid Lindgren 儿童医院于近期停止开出青春期阻断剂处方;其表示动机源自 Bell 诉 Tavistock 案件。
在芬兰,一份新的针对有性别焦虑的青年的处方医师指南于 2020 年发布(循证性别医学学会, 2021)。其与 WPATH 指南分道扬镳,推荐将社会心理支持及心理治疗作为一线疗法用于有性别焦虑的青年,同时不鼓励使用青春期阻断剂,并附上非常严格的使用门槛。芬兰卫生当局称,在进一步研究出现前其不会对以上建议进行修订。
同样在其它多个国家,也出现了等候治疗时间变长、获取难度加大的趋势;获取青春期阻断剂所需程序有时要耗去数年时间。由于其对非预期的永久变化的阻滞作用受时间影响,故治疗越晚,长期效果可能越差。这点已有证据支持,例如一项研究就发现,相比历史对照,减少等候治疗的时间可使得抑郁、焦虑程度降低(Dahlgren Allen et al., 2021)。
结语
关于青春期阻断剂用于跨性别青年的情况,尚存有诸多未知;但从现有研究来看,其风险应当较小,而现有证据也明确表明其与幸福感的提升、心理功能的改善以及自杀倾向的降低有关。
从有关治疗患性早熟的顺性别青年的研究、以及有关跨性别青年的有限研究及临床经验来看,按现有医学指南开出的青春期阻断剂不大可能会对儿童的骨密度终点、终生骨折风险、智力或认知发展有较大负面作用。但是,对于其是否对以上方面毫无影响,现有证据尚不充分。
青春期阻断剂可能对骨密度有较弱的负面影响——尽管缺乏决定性证据支持。此影响可能与阻断剂本身有关,但也可能与后续的激素治疗方案不够理想(尤其是跨性别女孩)、以及生活方式因素有关。这方面的研究所用方法问题颇多,无法建立它们之间确切的因果联系。基于有限证据,处方医师可考虑为接受青春期阻断剂的跨性别青年给予钙补剂,也可考虑在跨性别女孩开始其激素治疗时避免使用口服雌激素。
与顺性别同龄人相比,使用青春期阻断剂的跨性别青年拥有生物学后代的可能性较低;但青春期阻断剂不会对生育力造成永久影响。
迄今引用较多的关于儿童长大后摆脱性别焦虑(即“断念”)的统计数据,采用的是高度不可信的资料。意外的是,从现有证据无法给出一个合理的断念发生率估计值。尽管如此,断念比例既不能作为支持青春期阻断剂使用的论据,也不能作为反对的证据。有必要尊重儿童的意愿及自主性,也有必要寻求能够更好地支持儿童性别认同发展的方法,而不应强行灌输“跨性别或顺性别认同是不好的”观念。
接受青春期阻断剂的患者极少出现后悔念头。从更大角度看,在报告对接受激素治疗或手术感到后悔的极个别的成年跨性别患者中,最常见的后悔理由是缺乏社会支持。
这方面急需开展更多高质量研究;尤其是有关青春期阻断剂对智力、认知发展的影响,治疗后骨骼状况,以及断念比例的研究仍显不足。针对青春期阻断剂的随机对照试验迄今尚未开展,出于实践与伦理问题,也很可能无法进行。这不意味着应忽视其它所有在这方面的研究,也不意味着要给其扣上“有实验性质”的帽子;因为其证据标准可能永远无法满足。
在很多国家,患者要获取青春期阻断剂是极其困难的;其中包括美国、英国和欧洲部分地区。有的国家近期已禁止其使用,或者作更进一步的限制。本评述所提供的证据,可对多个组织就近期阻止跨性别青年获取青春期阻断剂等性别肯定治疗的举动所发表的谴责作出声援——谴责者包括 WPATH、EPATH、USPATH、AsiaPATH、CPATH、AusPATH、PATHA、美国内分泌学会、美国青少年精神医学会以及美国医学会等等。如有可能,应减少对青春期阻断剂的获取设置的障碍,以更好地为有性别焦虑的儿童提供支持。
参考文献
- Achille, C., Taggart, T., Eaton, N. R., Osipoff, J., Tafuri, K., Lane, A., & Wilson, T. A. (2020). Longitudinal impact of gender-affirming endocrine intervention on the mental health and well-being of transgender youths: preliminary results. International Journal of Pediatric Endocrinology, 2020, 8. [DOI:10.1186/s13633-020-00078-2]
- Antoniazzi, F., Zamboni, G., Bertoldo, F., Lauriola, S., Mengarda, F., Pietrobelli, A., & Tatò, L. (2003). Bone mass at final height in precocious puberty after gonadotropin-releasing hormone agonist with and without calcium supplementation. The Journal of Clinical Endocrinology and Metabolism, 88(3), 1096–1101. [DOI:10.1210/jc.2002-021154]
- Arnoldussen, M., Steensma, T. D., Popma, A., van der Miesen, A., Twisk, J., & de Vries, A. (2020). Re-evaluation of the Dutch approach: are recently referred transgender youth different compared to earlier referrals? European Child & Adolescent Psychiatry, 29(6), 803–811. [DOI:10.1007/s00787-019-01394-6]
- Bakwin, H. (1968). Deviant gender-role behavior in children: relation to homosexuality. Pediatrics, 41(3), 620–629. [PubMed] [DOI:10.1542/peds.41.3.620]
- Barake, M., Klibanski, A., & Tritos, N. A. (2014). Effects of recombinant human growth hormone therapy on bone mineral density in adults with growth hormone deficiency: a meta-analysis. The Journal of Clinical Endocrinology and Metabolism, 99(3), 852–860. [DOI:10.1210/jc.2013-3921]
- Barake, M., Arabi, A., Nakhoul, N., El-Hajj Fuleihan, G., El Ghandour, S., Klibanski, A., & Tritos, N. A. (2018). Effects of growth hormone therapy on bone density and fracture risk in age-related osteoporosis in the absence of growth hormone deficiency: a systematic review and meta-analysis. Endocrine, 59(1), 39–49. [DOI:10.1007/s12020-017-1440-0]
- Barnard, E. P., Dhar, C. P., Rothenberg, S. S., Menke, M. N., Witchel, S. F., Montano, G. T., Orwig, K. E., & Valli-Pulaski, H. (2019). Fertility Preservation Outcomes in Adolescent and Young Adult Feminizing Transgender Patients. Pediatrics, 144(3), e20183943. [DOI:10.1542/peds.2018-3943]
- Bertelloni, S., Baroncelli, G. I., Ferdeghini, M., Menchini-Fabris, F., & Saggese, G. (2000). Final height, gonadal function and bone mineral density of adolescent males with central precocious puberty after therapy with gonadotropin-releasing hormone analogues. European Journal of Pediatrics, 159(5), 369–374. [DOI:10.1007/s004310051289]
- Brik, T., Vrouenraets, L., de Vries, M. C., & Hannema, S. E. (2020). Trajectories of Adolescents Treated with Gonadotropin-Releasing Hormone Analogues for Gender Dysphoria. Archives of Sexual Behavior, 49(7), 2611–2618. [DOI:10.1007/s10508-020-01660-8]
- Carmichael, P., Butler, G., Masic, U., Cole, T. J., De Stavola, B. L., Davidson, S., Skageberg, E. M., Khadr, S., & Viner, R. M. (2021). Short-term outcomes of pubertal suppression in a selected cohort of 12 to 15 year old young people with persistent gender dysphoria in the UK. PloS One, 16(2), e0243894. [DOI:10.1371/journal.pone.0243894]
- Cedrin-Durnerin, I., Bidart, J. M., Robert, P., Wolf, J. P., Uzan, M., & Hugues, J. N. (2000). Consequences on gonadotrophin secretion of an early discontinuation of gonadotrophin-releasing hormone agonist administration in short-term protocol for in-vitro fertilization. Human Reproduction, 15(5), 1009–1014. [DOI:10.1093/humrep/15.5.1009]
- Chen, D., Simons, L., Johnson, E. K., Lockart, B. A., & Finlayson, C. (2017). Fertility Preservation for Transgender Adolescents. The Journal of Adolescent Health, 61(1), 120–123. [DOI:10.1016/j.jadohealth.2017.01.022]
- Cheng, P. J., Pastuszak, A. W., Myers, J. B., Goodwin, I. A., & Hotaling, J. M. (2019). Fertility concerns of the transgender patient. Translational Andrology and Urology, 8(3), 209–218. [DOI:10.21037/tau.2019.05.09]
- Cohen-Kettenis, P. T., & van Goozen, S. H. (1998). Pubertal delay as an aid in diagnosis and treatment of a transsexual adolescent. European Child & Adolescent Psychiatry, 7(4), 246–248. [DOI:10.1007/s007870050073]
- Cohen-Kettenis, P. T., Schagen, S. E., Steensma, T. D., de Vries, A. L., & Delemarre-van de Waal, H. A. (2011). Puberty suppression in a gender-dysphoric adolescent: a 22-year follow-up. Archives of Sexual Behavior, 40(4), 843–847. [DOI:10.1007/s10508-011-9758-9]
- Costa, R., Dunsford, M., Skagerberg, E., Holt, V., Carmichael, P., & Colizzi, M. (2015). Psychological Support, Puberty Suppression, and Psychosocial Functioning in Adolescents with Gender Dysphoria. The Journal of Sexual Medicine, 12(11), 2206–2214. [DOI:10.1111/jsm.13034]
- Dahlgren Allen, S., Tollit, M. A., McDougall, R., Eade, D., Hoq, M., & Pang, K. C. (2021). A Waitlist Intervention for Transgender Young People and Psychosocial Outcomes. Pediatrics, 148(2), e2020042762. [DOI:10.1542/peds.2020-042762]
- Davenport, C. W. (1986). A follow-up study of 10 feminine boys. Archives of Sexual Behavior, 15(6), 511–517. [DOI:10.1007/BF01542316]
- Davenport M. L. (2010). Approach to the patient with Turner syndrome. The Journal of Clinical Endocrinology and Metabolism, 95(4), 1487–1495. [DOI:10.1210/jc.2009-0926]
- de Vries, A. L. C., Cohen-Kettenis, P. T., & Delemarre-van de Waal, H. (2006). Clinical Management of Gender Dysphoria in Adolescents. International Journal of Transgenderism, 9(4), 83–94. [DOI:10.1300/J485v09n03_04]
- de Vries, A. L., Steensma, T. D., Doreleijers, T. A., & Cohen-Kettenis, P. T. (2011). Puberty suppression in adolescents with gender identity disorder: a prospective follow-up study. The Journal of Sexual Medicine, 8(8), 2276–2283. [DOI:10.1111/j.1743-6109.2010.01943.x]
- de Vries, A. L., McGuire, J. K., Steensma, T. D., Wagenaar, E. C., Doreleijers, T. A., & Cohen-Kettenis, P. T. (2014). Young adult psychological outcome after puberty suppression and gender reassignment. Pediatrics, 134(4), 696–704. [DOI:10.1542/peds.2013-2958]
- Drummond, K. D., Bradley, S. J., Peterson-Badali, M., & Zucker, K. J. (2008). A follow-up study of girls with gender identity disorder. Developmental Psychology, 44(1), 34–45. [DOI:10.1037/0012-1649.44.1.34]
- Drummond, K. D., Bradley, S. J., Peterson-Badali, M., VanderLaan, D. P., & Zucker, K. J. (2018). Behavior Problems and Psychiatric Diagnoses in Girls with Gender Identity Disorder: A Follow-Up Study. Journal of Sex & Marital Therapy, 44(2), 172–187. [DOI:10.1080/0092623X.2017.1340382]
- Ekbote, V. H., Khadilkar, V. V., Khadilkar, A. V., Mughal, Z., Chiplonkar, S. A., Palande, S. A., Phanse-Gupte, S. S., Patwardhan, V. G., & Shilvant, D. S. (2015). Relationship of insulin-like growth factor 1 and bone parameters in 7–15 years old apparently, healthy Indian children. Indian Journal of Endocrinology and Metabolism, 19(6), 770–774. [DOI:10.4103/2230-8210.167549]
- Feuillan, P. P., Jones, J. V., Barnes, K., Oerter-Klein, K., & Cutler, G. B., Jr. (1999). Reproductive axis after discontinuation of gonadotropin-releasing hormone analog treatment of girls with precocious puberty: long term follow-up comparing girls with hypothalamic hamartoma to those with idiopathic precocious puberty. The Journal of Clinical Endocrinology and Metabolism, 84(1), 44–49. [DOI:10.1210/jcem.84.1.5409]
- Giordano, S., & Holm, S. (2020). Is puberty delaying treatment ‘experimental treatment’? International Journal of Transgender Health, 21(2), 113–121. [DOI:10.1080/26895269.2020.1747768]
- Green, A. E., DeChants, J. P., Price, M. N., & Davis, C. K. (2022). Association of Gender-Affirming Hormone Therapy With Depression, Thoughts of Suicide, and Attempted Suicide Among Transgender and Nonbinary Youth. Journal of Adolescent Health, 70(4), 643–649. [DOI:10.1016/j.jadohealth.2021.10.036]
- Guaraldi, F., Beccuti, G., Gori, D., & Ghizzoni, L. (2016). MANAGEMENT OF ENDOCRINE DISEASE: Long-term outcomes of the treatment of central precocious puberty. European Journal of Endocrinology, 174(3), R79–R87. [DOI:10.1530/EJE-15-0590]
- Heger, S., Partsch, C. J., & Sippell, W. G. (1999). Long-term outcome after depot gonadotropin-releasing hormone agonist treatment of central precocious puberty: final height, body proportions, body composition, bone mineral density, and reproductive function. The Journal of Clinical Endocrinology and Metabolism, 84(12), 4583–4590. [DOI:10.1210/jcem.84.12.6203]
- Heger, S., Müller, M., Ranke, M., Schwarz, H. P., Waldhauser, F., Partsch, C. J., & Sippell, W. G. (2006). Long-term GnRH agonist treatment for female central precocious puberty does not impair reproductive function. Molecular and Cellular Endocrinology, 254–255, 217–220. [DOI:10.1016/j.mce.2006.04.012]
- Hembree, W. C., Cohen-Kettenis, P. T., Gooren, L., Hannema, S. E., Meyer, W. J., Murad, M. H., Rosenthal, S. M., Safer, J. D., Tangpricha, V., & T’Sjoen, G. G. (2017). Endocrine Treatment of Gender-Dysphoric/Gender-Incongruent Persons: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology and Metabolism, 102(11), 3869–3903. [DOI:10.1210/jc.2017-01658]
- Hough, D., Bellingham, M., Haraldsen, I. R., McLaughlin, M., Robinson, J. E., Solbakk, A. K., & Evans, N. P. (2017). A reduction in long-term spatial memory persists after discontinuation of peripubertal GnRH agonist treatment in sheep. Psychoneuroendocrinology, 77, 1–8. [DOI:10.1016/j.psyneuen.2016.11.029]
- Isotton, A. L., Wender, M. C., Casagrande, A., Rollin, G., & Czepielewski, M. A. (2012). Effects of oral and transdermal estrogen on IGF1, IGFBP3, IGFBP1, serum lipids, and glucose in patients with hypopituitarism during GH treatment: a randomized study. European Journal of Endocrinology, 166(2), 207–213. [DOI:10.1530/EJE-11-0560]
- Jones, B. A., Haycraft, E., Bouman, W. P., & Arcelus, J. (2018). The Levels and Predictors of Physical Activity Engagement Within the Treatment-Seeking Transgender Population: A Matched Control Study. Journal of Physical Activity & Health, 15(2), 99–107. [DOI:10.1123/jpah.2017-0298]
- Jung, K. Y., Kim, T., Hwang, S. Y., Lee, T. R., Yoon, H., Shin, T. G., Sim, M. S., Cha, W. C., & Jeon, H. J. (2018). Deliberate Self-harm among Young People Begins to Increase at the Very Early Age: a Nationwide Study. Journal of Korean Medical Science, 33(30), e191. [DOI:10.3346/jkms.2018.33.e191]
- Kennedy, E., Spinner, L., Lane, C., Stynes, H., Ranieri, V., Carmichael, P., Omar, R., Vickerstaff, V., Hunter, R., Wright, T., Senior, R., Butler, G., Baron-Cohen, S., Young, B., & King, M. (2021). Longitudinal Outcomes of Gender Identity in Children (LOGIC): protocol for a prospective longitudinal cohort study of children referred to the UK gender identity development service. BMJ Open, 11(9), e045628. [DOI:10.1136/bmjopen-2020-045628]
- Khatchadourian, K., Amed, S., & Metzger, D. L. (2014). Clinical management of youth with gender dysphoria in Vancouver. The Journal of Pediatrics, 164(4), 906–911. [DOI:10.1016/j.jpeds.2013.10.068]
- Kidd, J. D., Dolezal, C., & Bockting, W. O. (2018). The Relationship Between Tobacco Use and Legal Document Gender-Marker Change, Hormone Use, and Gender-Affirming Surgery in a United States Sample of Trans-Feminine and Trans-Masculine Individuals: Implications for Cardiovascular Health. LGBT Health, 5(7), 401–411. [DOI:10.1089/lgbt.2018.0103]
- Klink, D., Caris, M., Heijboer, A., van Trotsenburg, M., & Rotteveel, J. (2015). Bone mass in young adulthood following gonadotropin-releasing hormone analog treatment and cross-sex hormone treatment in adolescents with gender dysphoria. The Journal of Clinical Endocrinology and Metabolism, 100(2), E270–E275. [DOI:10.1210/jc.2014-2439]
- Kosky, R. J. (1987). Gender-disordered children: does inpatient treatment help? The Medical Journal of Australia, 146(11), 565–569. [DOI:10.5694/j.1326-5377.1987.tb120415.x]
- Kuper, L. E., Stewart, S., Preston, S., Lau, M., & Lopez, X. (2020). Body Dissatisfaction and Mental Health Outcomes of Youth on Gender-Affirming Hormone Therapy. Pediatrics, 145(4), e20193006. [DOI:10.1542/peds.2019-3006]
- Lazar, L., Meyerovitch, J., de Vries, L., Phillip, M., & Lebenthal, Y. (2014). Treated and untreated women with idiopathic precocious puberty: long-term follow-up and reproductive outcome between the third and fifth decades. Clinical Endocrinology, 80(4), 570–576. [DOI:10.1111/cen.12319]
- Lebovitz, P. S. (1972). Feminine behavior in boys: aspects of its outcome. The American Journal of Psychiatry, 128(10), 1283–1289. [DOI:10.1176/ajp.128.10.1283]
- Lee, J. Y., Finlayson, C., Olson-Kennedy, J., Garofalo, R., Chan, Y. M., Glidden, D. V., & Rosenthal, S. M. (2020). Low Bone Mineral Density in Early Pubertal Transgender/Gender Diverse Youth: Findings From the Trans Youth Care Study. Journal of the Endocrine Society, 4(9), bvaa065. [DOI:10.1210/jendso/bvaa065]
- Li, K., Rodriguez, D., Gabrielsen, J. S., Centola, G. M., & Tanrikut, C. (2018). Sperm cryopreservation of transgender individuals: trends and findings in the past decade. Andrology, 6(6), 860–864. [DOI:10.1111/andr.12527]
- Lindsey, R. C., & Mohan, S. (2016). Skeletal effects of growth hormone and insulin-like growth factor-I therapy. Molecular and Cellular Endocrinology, 432, 44–55. [DOI:10.1016/j.mce.2015.09.017]
- Locatelli, V., & Bianchi, V. E. (2014). Effect of GH/IGF-1 on Bone Metabolism and Osteoporsosis. International Journal of Endocrinology, 2014, 235060. [DOI:10.1155/2014/235060]
- Money, J., & Russo, A. J. (1979). Homosexual outcome of discordant gender identity/role in childhood: Longitudinal follow-up. Journal of Pediatric Psychology, 4(1), 29–41. [DOI:10.1093/jpepsy/4.1.29]
- Morey, Y., Mellon, D., Dailami, N., Verne, J., & Tapp, A. (2017). Adolescent self-harm in the community: an update on prevalence using a self-report survey of adolescents aged 13–18 in England. Journal of Public Health, 39(1), 58–64. [DOI:10.1093/pubmed/fdw010]
- Mul, D., Versluis-den Bieman, H. J., Slijper, F. M., Oostdijk, W., Waelkens, J. J., & Drop, S. L. (2001). Psychological assessments before and after treatment of early puberty in adopted children. Acta Paediatrica, 90(9), 965–971. [DOI:10.1080/080352501316978011]
- Nahata, L., Tishelman, A. C., Caltabellotta, N. M., & Quinn, G. P. (2017). Low Fertility Preservation Utilization Among Transgender Youth. The Journal of Adolescent Health, 61(1), 40–44. [DOI:10.1016/j.jadohealth.2016.12.012]
- Nock, M. K., Green, J. G., Hwang, I., McLaughlin, K. A., Sampson, N. A., Zaslavsky, A. M., & Kessler, R. C. (2013). Prevalence, correlates, and treatment of lifetime suicidal behavior among adolescents: results from the National Comorbidity Survey Replication Adolescent Supplement. JAMA Psychiatry, 70(3), 300–310. [DOI:10.1001/2013.jamapsychiatry.55]
- Olson-Kennedy, J., Chan, Y. M., Garofalo, R., Spack, N., Chen, D., Clark, L., Ehrensaft, D., Hidalgo, M., Tishelman, A., & Rosenthal, S. (2019). Impact of Early Medical Treatment for Transgender Youth: Protocol for the Longitudinal, Observational Trans Youth Care Study. JMIR Research Protocols, 8(7), e14434. [DOI:10.2196/14434]
- Pang, K. C., Peri, A., Chung, H. E., Telfer, M., Elder, C. V., Grover, S., & Jayasinghe, Y. (2020). Rates of Fertility Preservation Use Among Transgender Adolescents. JAMA Pediatrics, 174(9), 890–891. [DOI:10.1001/jamapediatrics.2020.0264]
- Riggs, M. M., Bennetts, M., van der Graaf, P. H., & Martin, S. W. (2012). Integrated pharmacometrics and systems pharmacology model-based analyses to guide GnRH receptor modulator development for management of endometriosis. CPT: Pharmacometrics & Systems Pharmacology, 1(10), e11. [DOI:10.1038/psp.2012.10]
- Rodriguez-Wallberg, K. A., Häljestig, J., Arver, S., Johansson, A., & Lundberg, F. E. (2021). Sperm quality in transgender women before or after gender affirming hormone therapy—A prospective cohort study. Andrology, 9(6), 1773–1780. [DOI:10.1111/andr.12999]
- Roux, C. (1997). Estrogen therapy in postmenopausal osteoporosis. What we know and what we don’t. Revue du Rhumatisme (English Ed.), 64(6), 402–409. [Google 学术] [PubMed] [PDF]
- Schagen, S., Wouters, F. M., Cohen-Kettenis, P. T., Gooren, L. J., & Hannema, S. E. (2020). Bone Development in Transgender Adolescents Treated With GnRH Analogues and Subsequent Gender-Affirming Hormones. The Journal of Clinical Endocrinology and Metabolism, 105(12), e4252–e4263. [DOI:10.1210/clinem/dgaa604]
- Schneider, M. A., Spritzer, P. M., Soll, B., Fontanari, A., Carneiro, M., Tovar-Moll, F., Costa, A. B., da Silva, D. C., Schwarz, K., Anes, M., Tramontina, S., & Lobato, M. (2017). Brain Maturation, Cognition and Voice Pattern in a Gender Dysphoria Case under Pubertal Suppression. Frontiers in Human Neuroscience, 11, 528. [DOI:10.3389/fnhum.2017.00528]
- Singh, D., Bradley, S. J., & Zucker, K. J. (2021). A Follow-Up Study of Boys With Gender Identity Disorder. Frontiers in Psychiatry, 12, 632784. [DOI:10.3389/fpsyt.2021.632784]
- Southmayd, E. A., & De Souza, M. J. (2017). A summary of the influence of exogenous estrogen administration across the lifespan on the GH/IGF-1 axis and implications for bone health. Growth Hormone & IGF Research, 32, 2–13. [DOI:10.1016/j.ghir.2016.09.001]
- Staphorsius, A. S., Kreukels, B. P., Cohen-Kettenis, P. T., Veltman, D. J., Burke, S. M., Schagen, S. E., Wouters, F. M., Delemarre-van de Waal, H. A., & Bakker, J. (2015). Puberty suppression and executive functioning: An fMRI-study in adolescents with gender dysphoria. Psychoneuroendocrinology, 56, 190–199. [DOI:10.1016/j.psyneuen.2015.03.007]
- Steensma, T. D., Biemond, R., de Boer, F., & Cohen-Kettenis, P. T. (2011). Desisting and persisting gender dysphoria after childhood: a qualitative follow-up study. Clinical Child Psychology and Psychiatry, 16(4), 499–516. [DOI:10.1177/1359104510378303]
- Steensma, T. D., McGuire, J. K., Kreukels, B. P., Beekman, A. J., & Cohen-Kettenis, P. T. (2013). Factors associated with desistence and persistence of childhood gender dysphoria: a quantitative follow-up study. Journal of the American Academy of Child and Adolescent Psychiatry, 52(6), 582–590. [DOI:10.1016/j.jaac.2013.03.016]
- Steensma, T. D., & Cohen-Kettenis, P. T. (2018). A critical commentary on “A critical commentary on follow-up studies and “desistence” theories about transgender and gender non-conforming children”. International Journal of Transgenderism, 19(2), 225–230. [DOI:10.1080/15532739.2018.1468292]
- Swerdloff, R. S., & Heber, D. (1983). Superactive gonadotropin-releasing hormone agonists. Annual Review of Medicine, 34, 491–500. [DOI:10.1146/annurev.me.34.020183.002423]
- Temple Newhook, J., Pyne, J., Winters, K., Feder, S., Holmes, C., Tosh, J., Sinnott, M.-L., Jamieson, A., & Pickett, S. (2018). A critical commentary on follow-up studies and “desistance” theories about transgender and gender-nonconforming children. International Journal of Transgenderism, 19(2), 212–224. [DOI:10.1080/15532739.2018.1456390]
- Tollit, M. A., Pace, C. C., Telfer, M., Hoq, M., Bryson, J., Fulkoski, N., Cooper, C., & Pang, K. C. (2019). What are the health outcomes of trans and gender diverse young people in Australia? Study protocol for the Trans20 longitudinal cohort study. BMJ Open, 9(11), e032151. [DOI:10.1136/bmjopen-2019-032151]
- Turban, J. L., King, D., Carswell, J. M., & Keuroghlian, A. S. (2020). Pubertal Suppression for Transgender Youth and Risk of Suicidal Ideation. Pediatrics, 145(2), e20191725. [DOI:10.1542/peds.2019-1725]
- van der Miesen, A., Steensma, T. D., de Vries, A., Bos, H., & Popma, A. (2020). Psychological Functioning in Transgender Adolescents Before and After Gender-Affirmative Care Compared With Cisgender General Population Peers. The Journal of Adolescent Health, 66(6), 699–704. [DOI:10.1016/j.jadohealth.2019.12.018]
- Verhulst, F. C., Achenbach, T. M., van der Ende, J., Erol, N., Lambert, M. C., Leung, P. W., Silva, M. A., Zilber, N., & Zubrick, S. R. (2003). Comparisons of problems reported by youths from seven countries. The American Journal of Psychiatry, 160(8), 1479–1485. [DOI:10.1176/appi.ajp.160.8.1479]
- Vlot, M. C., Klink, D. T., den Heijer, M., Blankenstein, M. A., Rotteveel, J., & Heijboer, A. C. (2017). Effect of pubertal suppression and cross-sex hormone therapy on bone turnover markers and bone mineral apparent density (BMAD) in transgender adolescents. Bone, 95, 11–19. [DOI:10.1016/j.bone.2016.11.008]
- Vrouenraets, L. J., Fredriks, A. M., Hannema, S. E., Cohen-Kettenis, P. T., & de Vries, M. C. (2016). Perceptions of Sex, Gender, and Puberty Suppression: A Qualitative Analysis of Transgender Youth. Archives of Sexual Behavior, 45(7), 1697–1703. [DOI:10.1007/s10508-016-0764-9]
- Wallien, M. S., & Cohen-Kettenis, P. T. (2008). Psychosexual outcome of gender-dysphoric children. Journal of the American Academy of Child and Adolescent Psychiatry, 47(12), 1413–1423. [DOI:10.1097/CHI.0b013e31818956b9]
- Wiepjes, C. M., Nota, N. M., de Blok, C., Klaver, M., de Vries, A., Wensing-Kruger, S. A., de Jongh, R. T., Bouman, M. B., Steensma, T. D., Cohen-Kettenis, P., Gooren, L., Kreukels, B., & den Heijer, M. (2018). The Amsterdam Cohort of Gender Dysphoria Study (1972–2015): Trends in Prevalence, Treatment, and Regrets. The Journal of Sexual Medicine, 15(4), 582–590. [DOI:10.1016/j.jsxm.2018.01.016]
- Wojniusz, S., Callens, N., Sütterlin, S., Andersson, S., De Schepper, J., Gies, I., Vanbesien, J., De Waele, K., Van Aken, S., Craen, M., Vögele, C., Cools, M., & Haraldsen, I. R. (2016). Cognitive, Emotional, and Psychosocial Functioning of Girls Treated with Pharmacological Puberty Blockage for Idiopathic Central Precocious Puberty. Frontiers in Psychology, 7, 1053. [DOI:10.3389/fpsyg.2016.01053]
- Zaiem, F., Alahdab, F., Al Nofal, A., Murad, M. H., & Javed, A. (2017). Oral Versus Transdermal Estrogen In Turner Syndrome: A Systematic Review And Meta-Analysis. Endocrine Practice, 23(4), 408–421. [DOI:10.4158/ep161622.or]
- Zuger, B. (1978). Effeminate behavior present in boys from childhood: ten additional years of follow-up. Comprehensive Psychiatry, 19(4), 363–369. [DOI:10.1016/0010-440x(78)90019-6]
译文修订记录
| 日期 | 详情 |
|---|---|
| 2023 年 4 月 15 日 | 初次翻译。 |
| 2023 年 11 月 2 日 | 依国家卫健委公开文件,修订 Relugolix 译名。 |