译者按
⚠免责声明:本文不构成任何医疗、处方建议。如有医疗需要,应于专业医师指导下进行。
本文总计约 7,000 个汉字。
摘要
目前为止,全球已有数家性别诊所成功应用了雌二醇的舌下含服途径——尽管尚鲜有医学文献对其加以评价。舌下含服途径尽管可能存在一些实际不足之处,但在适当剂量下,其有效性与经济性应该能为临床经验与权威评价所证明。对于某些女性倾向跨性别者,舌下含服雌二醇可有效代替口服,用于女性化激素疗法。
前言
药片通常以口服的形式服用;但对于口服雌二醇片剂,也可改以舌下、面颊含服(Kuhl, 2005)。所谓舌下含服是指,将片剂置于舌头下方,使其溶解并被吸收,进入血液循环。而面颊含服与此类似,其需将片剂置于嘴唇与牙龈之间,片剂在此也会快速溶解并被吸收(Gass et al., 2004; Bartlett & Maarschalk, 2012)。
许多女性倾向跨性别者希望了解有关舌下含服雌二醇的详情,也会在网络社群上提问;询问最多的问题有“我应该使用多大剂量的含服雌二醇?”“我应该隔多久含服一次?”“舌下含服比口服要好吗?”等等。
在早前,笔者曾回顾现有文献以比较口服与透皮雌二醇的情况(Sam, 2020a)。尽管不少女性倾向跨性别者曾尝试舌下含服雌二醇,且在自行用药者当中更为常见,但笔者未在该综述当中提及舌下/面颊含服。其中部分原因包括,对此类不同于传统上更常用的途径的雌二醇用法给予关注的研究特别少;这貌似也是许多临床实践指南未讨论舌下含服雌二醇的原因所在(Aly, 2020a)。而且,当时笔者希望只专注于口服雌二醇。
不过,在该综述发表之后,有好几篇关于将舌下含服雌二醇用于女性倾向跨性别者的研究论文都发表了。有了这些新资料,再考虑到女性倾向跨性别者这些常见的问题,笔者认为有必要深入剖析此类用法。本文旨在对已发表的有关舌下含服雌二醇——尤其是其在跨性别照护方面的应用——的医学文献进行概述,以期为上述问题进行释疑。
需要指出,尽管舌下含服与面颊含服完全是两回事,但其作用机理与药理特性非常相似(Perloff, 1950; Chandrasekhara et al., 2002)。因此,虽然笔者在此主要讨论的是舌下含服,但其中许多内容同样适用于雌二醇的面颊含服。
舌下含服雌二醇的药理特性
目前为止,舌下含服雌二醇在临床实践当中的使用,并不及口服或其它形式的雌二醇要普遍;不过,已有一批研究项目对这种形式的药理特性做了考察。这些项目的受试者包括已绝经顺性别女性、女性倾向跨性别者及其他患者群体(Casper & Yen, 1981; Serhal & Craft, 1989; Deutsch, Bhakri & Kubicek, 2015; Cirrincione et al., 2021)。口服雌二醇、口服戊酸雌二醇片剂均可用于舌下含服(Serhal, 1990)。
口服雌二醇之后,片剂成分会被肝脏大量代谢并失活,成为雌激素结合物(Kuhl, 2005)。这些代谢物反过来会逐渐转换成雌二醇,使得雌二醇半衰期延长(约为 13–20 小时)(Stanczyk, Archer & Bhavnani, 2013)。舌下含服雌二醇则与此相反:其不会大量经过肝脏,也不会因肝脏代谢而大幅失活;其很快就被吸收并直接进入血液循环。于是,舌下含服雌二醇的生物利用度要高于口服;这意味着仅需较低剂量,便可达到相近的雌二醇水平曲线下面积(AUC)(Kuhl, 2005)(见下图)。这是舌下含服相较于口服的一项优势,即对剂量需求更小、药费也更少。
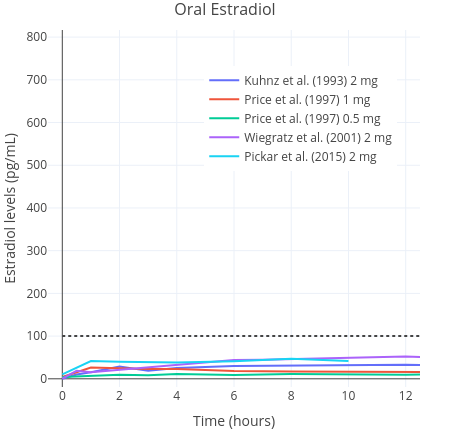
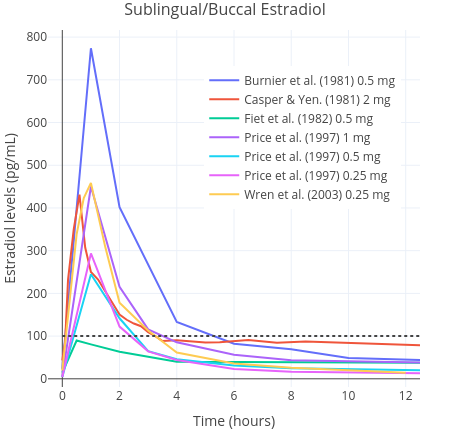
图一和图二:0.25–2 mg 微粉化雌二醇经口服(上)与舌下/面颊含服(下)单次服用之后的药代动力学特性。数据来自多项研究(Burnier et al., 1981; Casper & Yen, 1981; Fiet et al., 1982; Kuhnz, Gansau & Mahler, 1993; Price et al., 1997; Wiegratz et al., 2001; Wren et al., 2003; Pickar et al., 2015)。
其中,横向虚线表示绝经前女性大致的雌二醇综合平均水平(Verdonk et al., 2019)。
由于在舌下含服过程中可能会不慎吞服部分雌二醇,故舌下含服途径实际上很可能是含服与口服给药的结合(Lobo, 1987; Kuhl, 2005)。一项正在开展的有关女性倾向跨性别者的研究在其前期报告里写道,单次舌下含服 1 mg 雌二醇之后 1–2 小时内,雌二醇水平有所上升,最高达 179 pg/mL(657 pmol/L)以上;与此相反,口服 1 mg 雌二醇仅可达到 36 pg/mL(130 pmol/L)的浓度峰值(Doll et al., 2020);此后雌二醇水平快速下降。另一批针对已绝经女性的研究,同样观测到了类似的大幅上升的浓度峰值(Burnier et al., 1981; Price et al., 1997; Wren et al., 2003)。雌二醇水平上升时,增幅被发现可达口服的十倍左右,随后快速下降,而清除半衰期仅有几个小时(Kuhl, 2005)。在这方面,舌下含服雌二醇与静脉注射途径较为相似,后者在注射后也引起雌二醇水平的快速上升、清除半衰期则非常短(Kuhnz, Gansau & Mahler, 1993)。类似情况亦可见于经鼻腔给药途径(Devissaguet et al., 1999)。
由于尖峰较大、作用时间短,舌下含服雌二醇在浓度上的表现并不如其它剂型那样稳定。因此,这是和其它剂型的明显不同之处——像口服雌二醇在一天里就很少有激素水平上的波动。
已有对舌下含服雌二醇之生物利用度的估算范围的报道。一项针对已绝经女性的小型随机性研究发现,在同等剂量下,舌下含服雌二醇引起的雌二醇水平曲线下面积(AUC)约为口服的 2.5 倍(Price et al., 1997)。另一些研究则报道,舌下含服雌二醇的生物利用度估计值相对口服可达 5 倍之多(Pines et al., 1999)。一项以绒猴为对象的研究发现,舌下含服雌二醇的绝对生物利用度为 10%;此数字大约两倍于传统上对口服雌二醇的生物利用度的估计值(5%,不过范围可达 0.1–12%)(Kuhnz, Blode & Zimmermann, 1993)。因此,以 AUC 衡量,舌下含服引起的雌二醇水平应相当于口服的 2–5 倍。
基于上述结果,可以得出用于女性化激素疗法的舌下含服雌二醇大致剂量(见表一)。需要指出,目前由于尚缺乏相关研究,舌下含服雌二醇的相对效力尚未得到恰当评价。
表一:在雌二醇总暴露量上大致相当的口服或舌下含服雌二醇(E2)、戊酸雌二醇(EV)之剂量(Price et al., 1997; Pines et al., 1999):
| 低剂量 | 中等剂量 | 高剂量 | 超高剂量 | |
|---|---|---|---|---|
| 口服 E2 | 2 mg/天 | 4 mg/天 | 8 mg/天 | 10 mg/天 |
| 舌下含服 E2a | 0.5–1 mg/天 | 1–2 mg/天 | 2–4 mg/天 | 2.5–5 mg/天 |
| 口服 EV | 3 mg/天 | 6 mg/天 | 10 mg/天 | 12 mg/天 |
| 舌下含服 EVa | 0.75–1.5 mg/天 | 1.5–3 mg/天 | 2.5–5 mg/天 | 3–6 mg/天 |
(1) 按口服剂量的 25–50% 计,以反映在绝对生物利用度上的差异;按 0.5 mg 取整。
(另注) 雌二醇的生物利用度因人而异,和剂量有关的效应也在个体间相差显著;EV 的分子量更大,在同样剂量下的有效成分含量也更少;需要指出,EV 的相对生物利用度系从无戊酸基团的 E2 推断而来。
舌下含服雌二醇与女性化效果
由于舌下/面颊含服雌二醇的半衰期较其它形式都偏短,一些与将其用于女性化激素疗法之可能性有关的问题浮出了水面。在网络论坛上,有一个最常见的问题是:哪种性别肯定激素治疗方案对于由雌激素产生的女性化效果是“最有效的”——其中包括、但不限于乳房发育和脂肪分布的效果。
目前尚无任何资料可供评价舌下含服雌二醇引起的女性化程度;相比之下,对口服及透皮雌二醇的评价已汗牛充栋(Sam, 2020a)。不过,如上文所述,在女性倾向跨性别者以及性腺发育不良的顺性别女孩的乳房发育及其它女性化效果上,口服与非口服形式的雌二醇并未被发现有任何差别(Rosenfield et al., 2005; Shah et al., 2014; Klaver et al., 2018; de Blok et al., 2021)。因此,对于舌下含服的雌二醇,应该也不会在效力上有别于之。
迄今已有多家性别诊所运用了舌下含服雌二醇;这一事实令人振奋,其表明舌下含服雌二醇可有效促进女性化(Deutsch, Bhakri & Kubicek, 2015; Lim et al., 2019; Cirrincione et al., 2021)。尽管如此,鉴于迄今尚无任何对比并客观评价舌下含服雌二醇之女性化效力的研究,目前还无法肯定口服与舌下含服雌二醇在女性化效果上是否真的有所差别。但愿将来会有更多研究聚焦于此。
舌下含服雌二醇对睾酮的抑制效力
因为舌下含服雌二醇的半衰期很短,还催生了另一个问题:在对睾酮及其它雄激素的抑制能力上,舌下含服途径和其它传统途径的对比如何。
最早在 1940 年代,雌激素首次被评价为具有抗促性腺激素作用的抗雄激素制剂;其以口服人工雌激素(即己烯雌酚)的形式,用于治疗男性的前列腺癌(Huggins & Hodges, 1941)。而口服炔雌醇、一些长效雌二醇酯(如聚磷酸雌二醇)以及透皮雌二醇贴片,也曾有相关研究;其抗雄效力已得到确立(Stege et al., 1996; Kohli, 2006; Sciarra et al., 2015)。由于有关女性倾向跨性别者使用雌激素抑制睾酮的资料稀缺,上述资料对于女性化激素疗法会很有启发。
而另一方面,舌下含服雌二醇从未被用于治疗前列腺癌,因此尚无任何资料表明其抗雄效力如何。
近期一些研究发现,在许多女性倾向跨性别者身上,仅由非舌下含服形式使雌二醇水平达到生理范围——即 100–200 pg/mL(367–734 pmol/L),足以快速且接近完全地将睾酮水平抑制到女性范围(Leinung, Feustel & Joseph, 2018; Pappas et al., 2020)。另外,有一项正于英国开展的多中心随机对照试验研究:前列腺癌透皮激素疗法研究(PATCH)所提供的新资料显示,在约 900 名男性中,通过透皮贴片维持雌二醇水平中位数在 215–250 pg/mL(789–918 pmol/L)之间,可将睾酮水平抑制到去势范围(<50 ng/dL 或 <1.7 nmol/L),有效性约为 95%,与促性腺激素释放激素(GnRH)类似物相当(Langley et al., 2021)。
然而,考虑到舌下含服雌二醇在药代动力学上的显著差异,可以认为,在雌二醇水平 AUC 相当的剂量下,舌下含服雌二醇对睾酮的抑制作用可能低于其它途径。换言之,在睾酮抑制作用上,舌下含服之后波动较大、作用时间更短的雌二醇水平,可能不及更稳定的雌二醇水平那样有效。
对此有一些药理研究可略为佐证。其中一项证据是:一些针对女性的研究报道,尽管舌下含服与静脉注射雌二醇均引起了雌二醇水平在数个小时内的充分升高,也能较快产生对促性腺激素(即促卵泡激素与促黄体激素)的抑制作用,但该作用相对有限(Tsai & Yen, 1971; Burnier et al., 1981; Casper & Yen, 1981; Hoon et al., 1993)。这些研究质量较差,而且由于未测量睾酮抑制作用几何、受试者也仅有顺性别女性,其证据也不够直接。另一个问题在于,这些研究均仅安排单次用药,其结果未必能推广到多次用药的情况。有这样一种可能:重复以生理剂量使用舌下含服雌二醇,便可使促性腺激素抑制效果最大化。
尽管如此,这些研究可能表明:对于女性倾向跨性别者,如果舌下含服雌二醇的剂量不够大、且不使用其它抗雄制剂,则不足以最大程度地抑制性腺功能;而大剂量又会带来更高的健康风险。
还有一种可能:在与有关前列腺癌的研究所采用的剂量(如 2–4 片 100 μg/24 小时的透皮贴片)相当的情况下,舌下含服雌二醇单药疗法可能不及前者有效。因此,对于雌激素单药疗法,可能更为可靠的方案是使用透皮雌二醇贴片、凝胶,或者非肠道途径的雌二醇酯(如戊酸雌二醇,供肌肉或皮下注射)。
另一方面,舌下含服雌二醇已被研究用于女性倾向跨性别者,同时合并或不合并低剂量醋酸甲羟孕酮(MPA,一种人工孕激素制剂)(Jain, Kwan & Forcier, 2019)。研究显示,当女性倾向跨性别者将舌下含服雌二醇与 MPA 合用时,睾酮水平降至女性范围(<50 ng/dL 或 <1.7 nmol/L)的比例至少是比较高的;这表明如果合并其它抗雄制剂(如 10 mg/天的醋酸环丙孕酮)使用,舌下含服雌二醇很可能足以有效地抑制睾酮(Aly, 2019)。
对舌下含服引起的雌二醇水平的监测
由于舌下含服雌二醇所引起雌二醇水平的大幅波动,也进一步产生了是否通过验血来监测雌二醇水平的考虑。目前现有的专家共识指南均未对用药后何时进行验血作出建议(Deutsch, 2016; Cheung et al., 2019; T’Sjoen et al., 2020)。这可能一定程度上出于实际需求的缘故;或者是因为目前尚未有来自任何随机性对照试验的、可供指导女性化激素疗法所用剂量的可靠资料(Haupt et al., 2020)。尽管如此,由于舌下含服后的雌二醇水平波动很大,有必要知道用药后何时进行采血,以确保能够准确理解来自实验室的检测结果。
举个例子,如果刚用药不久便去测量激素水平,则可能会造成误导,因为测得的雌二醇水平会特别高,从而给用药者以一种需减小剂量来控制雌二醇于合理水平的印象。事实上,这是由舌下含服雌二醇的药理特性引起的误解:因为这个采样时间点几乎正值雌二醇水平最高之时。这样得到的结果无法代表雌二醇的平均暴露量——后者方可更准确地衡量总雌激素效力。
类似地,如果在时间轴的另一端——即即将用药时——进行采血,也可能会引起“雌激素水平过低”的误解,从而过量服用雌激素。此类误解在不熟悉舌下含服雌二醇的药理特性的人群当中更为常见:因为雌二醇水平仅在用药后最初几个小时内维持高位,此后快速下降。
有关舌下含服雌二醇的研究也存在这种疏忽的迹象。例如,在上文提到的对舌下含服雌二醇用于性别肯定激素疗法而开展的分析结果当中,并未说明其用药频率与用药之后何时进行测定(Jain, Kwan & Forcier, 2019)。尽管其资料非常宝贵、并且对于在这方面持续开展的研究具备参考价值,但是并没有解答用药后何时测定雌二醇水平这个关键问题。当下很难再对该研究所记录的雌二醇水平作任何评论;而且,无法利用其资料来得出口服与舌下含服雌二醇在何种剂量下(效力)相当。
为了解决因舌下含服后雌二醇水平快速波动而导致的上述问题,或许只需选择在雌二醇水平大概最接近于平均值的时间点进行测定。相关研究发现,对于舌下含服雌二醇,这个时间点一般在服药后四小时左右——不过个体之间差异可能会很大(Kuhl, 2005)。尽管如此,通过这种方式,可以给予最能代表总雌激素暴露量的“大致印象”,也能够帮助使用舌下含服雌二醇的人避免对实验室结果产生误解。
关于每日分多次含服的说明
为补偿舌下含服雌二醇的较短半衰期,可以每日以小剂量分多次服用,以维持稍为更稳定的激素水平(Ahokas, Kaukoranta & Aito, 1999)。
一项研究中,绝经前女性给予高剂量雌激素疗法——即每日舌下含服 3–4 次 2 mg 雌二醇(总剂量 6–8 mg/天)之后,其激素水平有显著性地较每日服一次者更为稳定(Serhal & Craft, 1989)。另一项研究安排每日含服 3–8 次,也复现了上述结果(Ahokas et al., 2001)。
与此相反,在第三项研究中,给予低剂量面颊含服雌二醇——即每日含服 1–2 次 0.25 mg 雌二醇之后的 12 小时观察期内,雌二醇浓度“稳态”无论含服 1 次还是 2 次都没有明显差别(Wren et al., 2003)。
上述结果可能表明,舌下/面颊含服雌二醇需每日分至少三次服用,以使雌二醇浓度更为稳定。
基于上述理由,如果女性倾向跨性别者要使用舌下含服雌二醇,一日内分多次服用的方式会更适合;或许最好每日至少分 3–4 次。例如,比起一次性服用 2 mg,在 24 小时内分四次服用 0.5 mg 的方式应该会更佳(可行的话尽量让间隔均等)。虽然每日分多次含服可能会带来一定不便,但至少雌二醇水平会因此更加均衡、睾酮抑制作用也可能更好。
每日分多次服用的方式可视为舌下含服雌二醇的最佳用法。
安全性与耐受性
遗憾的是,跟舌下/面颊含服雌二醇的药代动力学类似,在此类途径的用药安全性与耐受性方面,现有的医学文献尚显不足。不同于口服及透皮雌二醇(已在围绝经期女性身上进行严谨研究),当下尚无任何有关舌下含服雌二醇的长期用药安全性资料(Rovinski et al., 2018; 乳腺癌激素相关因素合作研究小组, CGHFBC, 2019)。
雌激素的不良健康影响
由于对肝脏的一系列影响,雌激素在暴露量足够高的条件下,会引起血栓风险的上升(Kuhl, 2005; Aly, 2020b)。此外,雌激素在特定条件下还会引起其它心血管并发症(Anderson et al., 2004; Mikkola et al., 2005)。这些是跟性别肯定激素疗法相关的重大健康问题——尽管其绝对风险在短期内很低。
仅有少量研究评价了舌下含服雌二醇对肝脏的影响(Pines et al., 1999; Lim et al., 2019)。资料显示其在脂质与胆固醇上的作用与其它形式的雌激素相似。有一项证据表明舌下含服雌二醇对肝脏的作用要强于透皮雌二醇等其它形式;那就是其引起的雌酮与硫酸雌酮数量显著更高——此二者均为肝脏雌激素暴露量的标志物(Burnier et al., 1981; Cirrincione et al., 2021)。之所以非口服形式的雌二醇在高剂量下诱导高凝状态,正是因为于肝脏产生的强烈雌激素活性(Sam, 2020b; Sam, 2020c)。
尽管有相当一部分的研究对雌激素的短期与长期健康影响有所关注,但其中无一研讨过舌下/面颊含服的情况(Oliver-Williams et al., 2019; Mishra et al., 2021)。考虑到口服雌二醇的风险比非口服形式更高、且舌下含服只是部分(而非完全)避免了肝脏首过效应的代谢作用,可以认为,舌下含服雌二醇的风险不高于口服、但也不低于其它非口服途径。
一项在美国开展的回顾性群组研究发现,经干扰因子修正后,在血栓栓塞发生率上,正服用平均 4 mg/天的口服雌二醇的女性倾向跨性别者约为对照组(未服用激素的顺性别女性)的两倍;相对对照组的风险比率为 2.0(95% 置信区间:1.4–2.8)(Getahun et al., 2018)。该风险增幅已经远比早年女性倾向跨性别者所用配方(含高剂量人工雌激素)的要小;但同时需要注意,即便是此等增幅也会明显增加发病率和死亡率(Morimont, Dogné & Douxfils, 2020)。
宜建议限制舌下/面颊含服雌二醇的剂量;较低的剂量(即 <6 mg/天)既可控制药物损害,也可令性别肯定激素治疗的风险与收益处于平衡。
用药者的不配合行为
对于女性倾向跨性别者,舌下含服有一项很现实的阻碍:即每日需含服三次、四次乃至更多,会带来相当程度的不便。观察性研究结果显示,一般而言,为患者开出的药量与每日剂量,和患者的不配合行为及漏服次数呈正相关性(Jin et al., 2008; Toh et al., 2014)。此结果尤其跟女性倾向跨性别者有关,因为一般情况下,我们需要在数十年间一直服用激素。如果一段时间里仅漏服一次,倒无伤大雅;但连续多次漏服的话,问题就会更明显。
与舌下含服相反的是,口服雌二醇及其透皮凝胶的半衰期长至足以仅需每日用药一次(Wiegratz et al., 2001; Potts & Lobo, 2005)。至于透皮贴片和非肠道给药(如注射——译者注)形式的雌二醇,其补充间隔可长达数日、以至更长(Thurman et al., 2013; Wisner et al., 2015)。因此,如果女性倾向跨性别者准备使用舌下含服而非其它途径,也应当格外留意,每日都要多次含服是否切实可行,或足够便利;如否,则其它剂型可能更适合使用。如要长期用药,那就更应该考虑这点了。
总结
相比于其它雌激素形式,当下对于舌下/面颊含服雌二醇的研究还很少。历史上,诸如口服、透皮雌激素等形式,常用于缓解围绝经期症状及其它用途;因此,在女性化激素疗法当中,这些形式得到了远甚于舌下含服形式的关注度与特性评价。不过,近期多项研究填补了我们对舌下含服雌二醇的认知空白。如果有跨性别照护临床实践指南未曾讨论舌下含服雌二醇之使用的话,可以考虑在相关信息愈发完善之后修订其内容。
舌下含服雌二醇在药理特性上与其它剂型不同。其中最主要的差别是:其会引起雌二醇水平的快速上升和下降。其生物利用度约为口服的 2–4 倍,因此其仅需 25–50% 的剂量* 便可提供相同的雌二醇暴露量。这是其优势所在,因为这不仅使得其开销低于口服,而且同等剂量下也可达到更高的雌二醇水平,有助于抑制睾酮。
* 译者注:原文为“(比口服)低 2–4 倍的剂量”,此说法在数学上并不严谨,故予以更正。
目前尚无任何证据显示或表明,在女性化效果上,舌下含服雌二醇是比其它途径更好还是更差;不过可以确信的是,在同等雌二醇总暴露量下,舌下含服雌二醇对睾酮的抑制作用可能稍弱。尽管如此,当合并服用其它抗雄制剂时,舌下含服雌二醇还是展现出了对睾酮的有效抑制。
使用舌下含服雌二醇时,如要监测雌二醇水平,需要留意(检测时机)以确保其结果可被准确解读。为尽量让上述潜在问题变得最小,可以每日分多次含服。
迄今尚无任何大型观察性或随机性研究对舌下含服雌二醇带来的健康风险进行量化。因此,其引起心血管问题的风险尚未可知——尽管其一部分引起的肝脏首过效应在这方面而言是安全的。
舌下含服雌二醇的使用(尤其是长期使用)可能不大方便,这时可以考虑换用其它剂型。
总而言之,舌下含服雌二醇应具有许多优良特性,可代替口服雌二醇用于女性化激素治疗——尽管其显然还需更多研究来得到更准确的评价。
后记
后记一:舌下含服雌二醇方面新开展的研究——Aly 著
继本文发表以后,下述有关舌下含服雌二醇用于女性倾向跨性别者的研究和论文被陆续发表:
- Doll, E., Gunsolus, I., Thorgerson, A., Tangpricha, V., Lamberton, N., & Sarvaideo, J. L. (2022). Pharmacokinetics of Sublingual Versus Oral Estradiol in Transgender Women. Endocrine Practice, 28(3), 237–242. [DOI:10.1016/j.eprac.2021.11.081]
- Safer, J. D. (2022). Are the Pharmacokinetics of Sublingual Estradiol Superior or Inferior to Those of Oral Estradiol? Endocrine Practice, 28(3), 351–352. [DOI:10.1016/j.eprac.2021.12.018]
- Sarvaideo, J., Doll, E., & Tangpricha, V. (2022). More Studies Are Needed to Establish the Safety and Efficacy of Sublingual Estradiol in Transgender Women. Endocrine Practice, 28(3), 353–354. [DOI:10.1016/j.eprac.2022.01.004]
- Cortez, S., Moog, D., Lewis, C., Williams, K., Herrick, C., Fields, M., Gray, T., Guo, Z., Nicol, G., & Baranski, T. (2023). Effectiveness and Safety of Different Estradiol Regimens in Transgender Women (TREAT Study): Protocol for a Randomized Controlled Trial. JMIR Research Protocols, 12, e53092. [DOI:10.2196/53092]
- Jalal, E., & Baldwin, C. (2023). Supratherapeutic Estrogen Levels in Transgender Women Likely From Sublingual Estradiol. Journal of the Endocrine Society, 7(Suppl 1) [ENDO 2023 Abstracts Annual Meeting of the Endocrine Society], A1095–A1096 (abstract no. SAT391/bvad114.2062). [DOI:10.1210/jendso/bvad114.2062] [PDF]
- Yaish, I., Gindis, G., Greenman, Y., Moshe, Y., Arbiv, M., Buch, A., Sofer, Y., Shefer, G., & Tordjman, K. (2023). Sublingual Estradiol Offers No Apparent Advantage Over Combined Oral Estradiol and Cyproterone Acetate for Gender-Affirming Hormone Therapy of Treatment-Naive Trans Women: Results of a Prospective Pilot Study. Transgender Health, 8(6), 485–493. [DOI:10.1089/trgh.2023.0022]
- Gindis, G., Yaish, I., Greenman, Y., Moshe, Y., Arbiv, M., Buch, A., Sofer, Y., Shefer, G., & Tordjman, K. (May 2023). Sublingual estradiol only, offers no apparent advantage over combined oral estradiol and cyproterone acetate, for Gender Affirming Hormone Therapy (GAHT) of treatment-naive transwomen: Results of a prospective pilot study. Endocrine Abstracts, 90 [25th European Congress of Endocrinology 2023, 13–16 May 2023, Istanbul, Turkey], 274–274 (abstract no. P182). [DOI:10.1530/endoabs.90.p182] [PDF]
- Yaish, I., Gindis, G., Greenman, Y., Shefer, G., Buch, A., Arbiv, M., Moshe, Y., Sofer, Y., & Tordjman, K. M. (October 2023). Sublingual Estradiol Only, Compared To Combined Oral Estradiol And Cyproterone Acetate,Offers No Apparent Advantage For Gender Affirming Hormone Therapy (GHAT), In Treatment Naïve Transwomen: Results Of A Prospective Pilot Study. Journal of the Endocrine Society, 7(Suppl 1) [ENDO 2023 Abstracts Annual Meeting of the Endocrine Society], A1104–A1105 (abstract no. SAT409/bvad114.2080). [DOI:10.1210/jendso/bvad114.2080] [PDF]
- Kariyawasam, N. M., Ahmad, T., Sarma, S., & Fung, R. (2024). Comparison of Estrone/Estradiol Ratio and Levels in Transfeminine Individuals on Different Routes of Estradiol. Transgender Health, online ahead of print. [DOI:10.1089/trgh.2023.0138]
参考文献
- Ahokas, A., Kaukoranta, J., & Aito, M. (1999). Effect of oestradiol on postpartum depression. Psychopharmacology, 146(1), 108–110. [DOI:10.1007/s002130051095]
- Ahokas, A., Kaukoranta, J., Wahlbeck, K., & Aito, M. (2001). Estrogen deficiency in severe postpartum depression: successful treatment with sublingual physiologic 17β-estradiol: a preliminary study. Journal of Clinical Psychiatry, 62(5), 332–336. [DOI:10.4088/jcp.v62n0504] [PDF]
- Anderson, G. L., Limacher, M., Assaf, A. R., Bassford, T., Beresford, S. A., Black, H., Bonds, D., Brunner, R., Brzyski, R., Caan, B., Chlebowski, R., Curb, D., Gass, M., Hays, J., Heiss, G., Hendrix, S., Howard, B. V., Hsia, J., Hubbell, A., Jackson, R., … & Women’s Health Initiative Steering Committee. (2004). Effects of Conjugated Equine Estrogen in Postmenopausal Women With Hysterectomy: The Women’s Health Initiative Randomized Controlled Trial. JAMA, 291(14), 1701–1712. [DOI:10.1001/jama.291.14.1701]
- Bartlett, J. A., & van der Voort Maarschalk, K. (2012). Understanding the oral mucosal absorption and resulting clinical pharmacokinetics of asenapine. AAPS Pharmscitech, 13(4), 1110–1115. [DOI:10.1208/s12249-012-9839-7]
- Burnier, A. M., Martin, P. L., Yen, S. S., & Brooks, P. (1981). Sublingual absorption of micronized 17β-estradiol. American Journal of Obstetrics and Gynecology, 140(2), 146–150. [DOI:10.1016/0002-9378(81)90101-0]
- Casper, R. F., & Yen, S. S. (1981). Rapid absorption of micronized estradiol-17β following sublingual administration. Obstetrics and Gynecology, 57(1), 62–64. [Google 学术] [PubMed] [URL] [PDF]
- Chandrasekhara, D. S., Ali, V., Prost, H. M., & Nader-Estekhari, S. (2002). Buccal estrogen in toothpaste study: systemic absorption of estradiol in postmenopausal or surgically menopausal women when administered as a component in toothpaste. Fertility and Sterility, 78(Suppl 1), S98–S98 (O-258). [DOI:10.1016/S0015-0282(02)03639-7]
- Cheung, A. S., Wynne, K., Erasmus, J., Murray, S., & Zajac, J. D. (2019). Position statement on the hormonal management of adult transgender and gender diverse individuals. Medical Journal of Australia, 211(3), 127–133. [DOI:10.5694/mja2.50259]
- Cirrincione, L. R., Winston McPherson, G., Rongitsch, J., Sadilkova, K., Drees, J. C., Krasowski, M. D., Dickerson, J. A., & Greene, D. N. (2021). Sublingual Estradiol Is Associated with Higher Estrone Concentrations than Transdermal or Injectable Preparations in Transgender Women and Gender Nonbinary Adults. LGBT Health, 8(2), 125–132. [DOI:10.1089/lgbt.2020.0249]
- Collaborative Group on Hormonal Factors in Breast Cancer. (2019). Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. The Lancet, 394(10204), 1159–1168. [DOI:10.1016/S0140-6736(19)31709-X]
- Cortez, S., Moog, D., Lewis, C., Williams, K., Herrick, C., Fields, M., Gray, T., Guo, Z., Nicol, G., & Baranski, T. (2023). Effectiveness and Safety of Different Estradiol Regimens in Transgender Women (TREAT Study): Protocol for a Randomized Controlled Trial. JMIR Research Protocols, 12, e53092. [DOI:10.2196/53092]
- de Blok, C., Dijkman, B., Wiepjes, C. M., Staphorsius, A. S., Timmermans, F. W., Smit, J. M., Dreijerink, K., & den Heijer, M. (2021). Sustained Breast Development and Breast Anthropometric Changes in 3 Years of Gender-Affirming Hormone Treatment. The Journal of Clinical Endocrinology & Metabolism, 106(2), e782–e790. [DOI:10.1210/clinem/dgaa841]
- Deutsch, M. B., Bhakri, V., & Kubicek, K. (2015). Effects of cross-sex hormone treatment on transgender women and men. Obstetrics and Gynecology, 125(3), 605–610. [DOI:10.1097/AOG.0000000000000692]
- Deutsch, M. B. (Ed.). (2016). Guidelines for the Primary and Gender-Affirming Care of Transgender and Gender Nonbinary People, 2nd Edition. San Francisco: University of California, San Francisco/UCSF Transgender Care. [URL] [PDF]
- Devissaguet, J. P., Brion, N., Lhote, O., & Deloffre, P. (1999). Pulsed estrogen therapy: pharmacokinetics of intranasal 17-beta-estradiol (S21400) in postmenopausal women and comparison with oral and transdermal formulations. European Journal of Drug Metabolism and Pharmacokinetics, 24(3), 265–271. [DOI:10.1007/BF03190030]
- Doll, E. E., Gunsolus, I., Lamberton, N., Tangpricha, V., & Sarvaideo, J. L. (2020). Pharmacokinetics of Sublingual Versus Oral Estradiol in Transgender Women. Journal of the Endocrine Society, 4(Suppl 1), A1128–A1128 (SUN-LB9). [DOI:[10.1210/jendso/bvaa046.2237][doi-07b1d2f6]]
- Doll, E., Gunsolus, I., Thorgerson, A., Tangpricha, V., Lamberton, N., & Sarvaideo, J. L. (2022). Pharmacokinetics of Sublingual Versus Oral Estradiol in Transgender Women. Endocrine Practice, 28(3), 237–242. [DOI:10.1016/j.eprac.2021.11.081]
- Fiet, J., Hermano, M., Witte, J., Villette, J. M., Haimart, M., Gourmel, B., Tabuteau, F., Rouffy, J., & Dreux, C. (1982). Post-menopausal concentrations of plasma oestradiol, oestrone, FSH and LH and of total urinary oestradiol and oestrone after a single sublingual dose of oestradiol-17β. Acta Endocrinologica, 101(1), 93–97. [DOI:10.1530/acta.0.1010093]
- Gass, M. S., Rebar, R. W., Cuffie-Jackson, C., Cedars, M. I., Lobo, R. A., Shoupe, D., Judd, H. L., Buyalos, R. P., & Clisham, P. R. (2004). A short study in the treatment of hot flashes with buccal administration of 17-β estradiol. Maturitas, 49(2), 140–147. [DOI:10.1016/j.maturitas.2003.12.004]
- Getahun, D., Nash, R., Flanders, W. D., Baird, T. C., Becerra-Culqui, T. A., Cromwell, L., Hunkeler, E., Lash, T. L., Millman, A., Quinn, V. P., Robinson, B., Roblin, D., Silverberg, M. J., Safer, J., Slovis, J., Tangpricha, V., & Goodman, M. (2018). Cross-sex hormones and acute cardiovascular events in transgender persons: a cohort study. Annals of Internal Medicine, 169(4), 205–213. [DOI:10.7326/M17-2785]
- Gindis, G., Yaish, I., Greenman, Y., Moshe, Y., Arbiv, M., Buch, A., Sofer, Y., Shefer, G., & Tordjman, K. (May 2023). Sublingual estradiol only, offers no apparent advantage over combined oral estradiol and cyproterone acetate, for Gender Affirming Hormone Therapy (GAHT) of treatment-naive transwomen: Results of a prospective pilot study. Endocrine Abstracts, 90 [25th European Congress of Endocrinology 2023, 13–16 May 2023, Istanbul, Turkey], 274–274 (abstract no. P182). [DOI:10.1530/endoabs.90.p182] [PDF]
- Haupt, C., Henke, M., Kutschmar, A., Hauser, B., Baldinger, S., Saenz, S. R., & Schreiber, G. (2020). Antiandrogen or estradiol treatment or both during hormone therapy in transitioning transgender women. Cochrane Database of Systematic Reviews, 11(11), CD013138. [DOI:10.1002/14651858.CD013138.pub2]
- Hoon, T. J., Dawood, M. Y., Khan‐Dawood, F. S., Ramos, J., & Batenhorst, R. L. (1993). Bioequivalence of a 17β‐Estradiol Hydroxypropyl‐β‐Cyclodextrin Complex in Postmenopausal Women. The Journal of Clinical Pharmacology, 33(11), 1116–1121. [DOI:10.1002/j.1552-4604.1993.tb01949.x]
- Huggins, C., & Hodges, C. V. (1941). Studies on prostatic cancer. I. The effect of castration, of estrogen and of androgen injection on serum phosphatases in metastatic carcinoma of the prostate. Cancer Research, 1(4), 293–297. [DOI:10.3322/canjclin.22.4.232]
- Jain, J., Kwan, D., & Forcier, M. (2019). Medroxyprogesterone acetate in Gender-Affirming therapy for Transwomen: results from a retrospective study. The Journal of Clinical Endocrinology & Metabolism, 104(11), 5148–5156. [DOI:10.1210/jc.2018-02253]
- Jalal, E., & Baldwin, C. (2023). Supratherapeutic Estrogen Levels in Transgender Women Likely From Sublingual Estradiol. Journal of the Endocrine Society, 7(Suppl 1) [ENDO 2023 Abstracts Annual Meeting of the Endocrine Society], A1095–A1096 (abstract no. SAT391/bvad114.2062). [DOI:10.1210/jendso/bvad114.2062] [PDF]
- Jin, J., Sklar, G. E., Oh, V. M. S., & Li, S. C. (2008). Factors affecting therapeutic compliance: A review from the patient’s perspective. Therapeutics and Clinical Risk Management, 4(1), 269–286. [DOI:10.2147/TCRM.S1458]
- Kariyawasam, N. M., Ahmad, T., Sarma, S., & Fung, R. (2024). Comparison of Estrone/Estradiol Ratio and Levels in Transfeminine Individuals on Different Routes of Estradiol. Transgender Health, online ahead of print. [DOI:10.1089/trgh.2023.0138]
- Klaver, M., de Blok, C. J. M., Wiepjes, C. M., Nota, N. M., Dekker, M. J., de Mutsert, R., Schreiner, T., Fisher, A. D., T’Sjoen, G., & den Heijer, M. (2018). Changes in regional body fat, lean body mass and body shape in trans persons using cross-sex hormonal therapy: results from a multicenter prospective study. European Journal of Endocrinology, 178(2), 163–171. [DOI:10.1530/EJE-17-0496]
- Kohli, M. (2006). Phase II study of transdermal estradiol in androgen‐independent prostate carcinoma. Cancer, 106(1), 234–235. [DOI:10.1002/cncr.21528]
- Kuhl, H. (2005). Pharmacology of estrogens and progestogens: influence of different routes of administration. Climacteric, 8(Suppl 1), 3–63. [DOI:10.1080/13697130500148875] [PDF]
- Kuhnz, W., Blode, H., & Zimmermann, H. (1993). Pharmacokinetics of exogenous natural and synthetic estrogens and antiestrogens. In Oettel, M., & Schillinger, E. (Eds.). Estrogens and Antiestrogens II: Pharmacology and Clinical Application of Estrogens and Antiestrogen (Handbook of Experimental Pharmacology, Volume 135, Part 2) (pp. 261–322). Berlin/Heidelberg: Springer. [DOI:10.1007/978-3-642-60107-1_15]
- Kuhnz, W., Gansau, C., & Mahler, M. (1993). Pharmacokinetics of estradiol, free and total estrone, in young women following single intravenous and oral administration of 17β-estradiol. Arzneimittelforschung, 43(9), 966–973. [Google 学术] [PubMed] [PDF]
- Langley, R. E., Gilbert, D. C., Duong, T., Clarke, N. W., Nankivell, M., Rosen, S. D., Mangar, S., Macnair, A., Sundaram, S. K., Laniado, M. E., Dixit, S., Madaan, S., Manetta, C., Pope, A., Scrase, C. D., Mckay, S., Muazzam, I. A., Collins, G. N., Worlding, J., Williams, S. T., … & Parmar, M. (2021). Transdermal oestradiol for androgen suppression in prostate cancer: long-term cardiovascular outcomes from the randomised Prostate Adenocarcinoma Transcutaneous Hormone (PATCH) trial programme. The Lancet, 397(10274), 581–591. [DOI:10.1016/S0140-6736(21)00100-8]
- Leinung, M. C., Feustel, P. J., & Joseph, J. (2018). Hormonal treatment of transgender women with oral estradiol. Transgender Health, 3(1), 74–81. [DOI:10.1089/trgh.2017.0035]
- Lim, H. H., Jang, Y. H., Choi, G. Y., Lee, J. J., & Lee, E. S. (2019). Gender affirmative care of transgender people: a single center’s experience in Korea. Obstetrics & Gynecology Science, 62(1), 46–55. [DOI:10.5468/ogs.2019.62.1.46]
- Lobo, R. A. (1987). Absorption and metabolic effects of different types of estrogens and progestogens. Obstetrics and Gynecology Clinics of North America, 14(1), 143–167. [PubMed] [DOI:10.1016/S0889-8545(21)00577-5] [URL] [PDF]
- Mikkola, A., Aro, J., Rannikko, S., Oksanen, H., Ruutu, M., & Finnprostate Group. (2005). Cardiovascular complications in patients with advanced prostatic cancer treated by means of orchiectomy or polyestradiol phosphate. Scandinavian Journal of Urology and Nephrology, 39(4), 294–300. [DOI:10.1080/00365590510031228]
- Mishra, S. R., Chung, H. F., Waller, M., & Mishra, G. D. (2021). Duration of estrogen exposure during reproductive years, age at menarche and age at Menopause, and risk of cardiovascular disease events, all‐cause and cardiovascular mortality: a systematic review and meta‐analysis. BJOG: An International Journal of Obstetrics & Gynaecology, 128(5), 809–821. [DOI:10.1111/1471-0528.16524]
- Morimont, L., Dogné, J. M., & Douxfils, J. (2020). Letter to the Editors-in-Chief in response to the article of Abou-Ismail, et al. entitled “Estrogen and thrombosis: A bench to bedside review” (Thrombosis Research 192 (2020) 40–51). Thrombosis Research, 193, 221–223. [DOI:10.1016/j.thromres.2020.08.006]
- Oliver-Williams, C., Glisic, M., Shahzad, S., Brown, E., Pellegrino Baena, C., Chadni, M., Chowdhury, R., Franco, O. H., & Muka, T. (2019). The route of administration, timing, duration and dose of postmenopausal hormone therapy and cardiovascular outcomes in women: a systematic review. Human Reproduction Update, 25(2), 257–271. [DOI:10.1093/humupd/dmy039]
- Pappas, I. I., Craig, W. Y., Spratt, L. V., & Spratt, D. I. (2021). Efficacy of Sex Steroid Therapy Without Progestin or GnRH Agonist for Gonadal Suppression in Adult Transgender Patients. The Journal of Clinical Endocrinology & Metabolism, 106(3), e1290–e1300. [DOI:10.1210/clinem/dgaa884]
- Perloff, W. H. (1950). Estradiol buccal tablets in the treatment of the menopause. American Journal of Obstetrics and Gynecology, 59(1), 223–225. [DOI:10.1016/0002-9378(50)90390-5]
- Pickar, J. H., Bon, C., Amadio, J. M., Mirkin, S., & Bernick, B. (2015). Pharmacokinetics of the first combination 17β-estradiol/progesterone capsule in clinical development for menopausal hormone therapy. Menopause, 22(12), 1308–1316. [DOI:10.1097/GME.0000000000000467]
- Pines, A., Averbuch, M., Fisman, E. Z., & Rosano, G. M. (1999). The acute effects of sublingual 17β-estradiol on the cardiovascular system. Maturitas, 33(1), 81–85. [DOI:10.1016/S0378-5122(99)00036-5]
- Potts, R. O., & Lobo, R. A. (2005). Transdermal drug delivery: clinical considerations for the obstetrician–gynecologist. Obstetrics & Gynecology, 105(5), 953–961. [DOI:10.1097/01.AOG.0000161958.70059.db]
- Price, T. M., Blauer, K. L., Hansen, M., Stanczyk, F., Lobo, R., & Bates, G. W. (1997). Single-dose pharmacokinetics of sublingual versus oral administration of micronized 17β-estradiol. Obstetrics & Gynecology, 89(3), 340–345. [DOI:10.1016/S0029-7844(96)00513-3]
- Rosenfield, R. L., Devine, N., Hunold, J. J., Mauras, N., Moshang Jr, T., & Root, A. W. (2005). Salutary effects of combining early very low-dose systemic estradiol with growth hormone therapy in girls with Turner syndrome. The Journal of Clinical Endocrinology & Metabolism, 90(12), 6424–6430. [DOI:10.1210/jc.2005-1081]
- Rovinski, D., Ramos, R. B., Fighera, T. M., Casanova, G. K., & Spritzer, P. M. (2018). Risk of venous thromboembolism events in postmenopausal women using oral versus non-oral hormone therapy: a systematic review and meta-analysis. Thrombosis Research, 168, 83–95. [DOI:10.1016/j.thromres.2018.06.014]
- Safer, J. D. (2022). Are the Pharmacokinetics of Sublingual Estradiol Superior or Inferior to Those of Oral Estradiol? Endocrine Practice, 28(3), 351–352. [DOI:10.1016/j.eprac.2021.12.018]
- Sarvaideo, J., Doll, E., & Tangpricha, V. (2022). More Studies Are Needed to Establish the Safety and Efficacy of Sublingual Estradiol in Transgender Women. Endocrine Practice, 28(3), 353–354. [DOI:10.1016/j.eprac.2022.01.004]
- Sciarra, A., Gentile, V., Cattarino, S., Gentilucci, A., Alfarone, A., D’Eramo, G., & Salciccia, S. (2015). Oral ethinylestradiol in castration‐resistant prostate cancer: a 10‐year experience. International Journal of Urology, 22(1), 98–103. [DOI:10.1111/iju.12613]
- Serhal, P., & Craft, I. (1989). Oocyte donation in 61 patients. The Lancet, 333(8648), 1185–1187. [DOI:10.1016/S0140-6736(89)92762-1]
- Serhal, P. (1990). Oocyte donation and surrogacy. British Medical Bulletin, 46(3), 796–812. [DOI:10.1093/oxfordjournals.bmb.a072432]
- Shah, S., Forghani, N., Durham, E., & Neely, E. K. (2014). A randomized trial of transdermal and oral estrogen therapy in adolescent girls with hypogonadism. International Journal of Pediatric Endocrinology, 2014(1), 12. [DOI:10.1186/1687-9856-2014-12]
- Stanczyk, F. Z., Archer, D. F., & Bhavnani, B. R. (2013). Ethinyl estradiol and 17β-estradiol in combined oral contraceptives: pharmacokinetics, pharmacodynamics and risk assessment. Contraception, 87(6), 706–727. [DOI:[10.1016/j.contraception.2012.12.011][doi-0f01501d]]
- Stege, R., Gunnarsson, P. O., Johansson, C. J., Olsson, P., Pousette, Å., & Carlström, K. (1996). Pharmacokinetics and testosterone suppression of a single dose of polyestradiol phosphate (Estradurin®) in prostatic cancer patients. The Prostate, 28(5), 307–310. [DOI:10.1002/(SICI)1097-0045(199605)28:5<307::AID-PROS6>3.0.CO;2-8]
- T’Sjoen, G., Arcelus, J., De Vries, A. L., Fisher, A. D., Nieder, T. O., Özer, M., & Motmans, J. (2020). European Society for Sexual Medicine position statement “assessment and hormonal management in adolescent and adult trans people, with attention for sexual function and satisfaction”. The Journal of Sexual Medicine, 17(4), 570–584. [DOI:10.1016/j.jsxm.2020.01.012]
- Thurman, A., Kimble, T., Hall, P., Schwartz, J. L., & Archer, D. F. (2013). Medroxyprogesterone acetate and estradiol cypionate injectable suspension (Cyclofem) monthly contraceptive injection: steady-state pharmacokinetics. Contraception, 87(6), 738–743. [DOI:10.1016/j.contraception.2012.11.010]
- Toh, M. R., Teo, V., Kwan, Y. H., Raaj, S., Tan, S. Y. D., & Tan, J. Z. Y. (2014). Association between number of doses per day, number of medications and patient’s non-compliance, and frequency of readmissions in a multi-ethnic Asian population. Preventive Medicine Reports, 1, 43–47. [DOI:10.1016/j.pmedr.2014.10.001]
- Tsai, C. C., & Yen, S. S. C. (1971). Acute effects of intravenous infusion of 17β-estradiol on gonadotropin release in pre-and post-menopausal women. The Journal of Clinical Endocrinology & Metabolism, 32(6), 766–771. [DOI:10.1210/jcem-32-6-766]
- Verdonk, S. J., Vesper, H. W., Martens, F., Sluss, P. M., Hillebrand, J. J., & Heijboer, A. C. (2019). Estradiol reference intervals in women during the menstrual cycle, postmenopausal women and men using an LC-MS/MS method. Clinica Chimica Acta, 495, 198–204. [DOI:10.1016/j.cca.2019.04.062]
- Wiegratz, I., Fink, T., Rohr, U. D., Lang, E., Leukel, P., & Kuhl, H. (2001). Überkreuz-Vergleich der Pharmakokinetik von Estradiol unter der Hormonsubstitution mit Estradiolvalerat oder mikronisiertem Estradiol. [Cross-over comparison of the pharmacokinetics of estradiol during hormone replacement therapy with estradiol valerate or micronized estradiol.] Zentralblatt für Gynäkologie, 123(9), 505–512. [PubMed] [DOI:10.1055/s-2001-18223]
- Wisner, K. L., Sit, D. K., Moses-Kolko, E. L., Driscoll, K. E., Prairie, B. A., Stika, C. S., Eng, H. F., Dills, J. L., Luther, J. F., & Wisniewski, S. R. (2015). Transdermal estradiol treatment for postpartum depression: a pilot randomized trial. Journal of Clinical Psychopharmacology, 35(4), 389–395. [DOI:10.1097/JCP.0000000000000351]
- Wren, B. G., Day, R. O., McLachlan, A. J., & Williams, K. M. (2003). Pharmacokinetics of estradiol, progesterone, testosterone and dehydroepiandrosterone after transbuccal administration to postmenopausal women. Climacteric, 6(2), 104–111. [DOI:10.1080/cmt.6.2.104.111]
- Yaish, I., Gindis, G., Greenman, Y., Moshe, Y., Arbiv, M., Buch, A., Sofer, Y., Shefer, G., & Tordjman, K. (2023). Sublingual Estradiol Offers No Apparent Advantage Over Combined Oral Estradiol and Cyproterone Acetate for Gender-Affirming Hormone Therapy of Treatment-Naive Trans Women: Results of a Prospective Pilot Study. Transgender Health, 8(6), 485–493. [DOI:10.1089/trgh.2023.0022]
- Yaish, I., Gindis, G., Greenman, Y., Shefer, G., Buch, A., Arbiv, M., Moshe, Y., Sofer, Y., & Tordjman, K. M. (2023). Sublingual Estradiol Only, Compared To Combined Oral Estradiol And Cyproterone Acetate,Offers No Apparent Advantage For Gender Affirming Hormone Therapy (GHAT), In Treatment Naïve Transwomen: Results Of A Prospective Pilot Study. Journal of the Endocrine Society, 7(Suppl 1) [ENDO 2023 Abstracts Annual Meeting of the Endocrine Society], A1104–A1105 (abstract no. SAT409/bvad114.2080). [DOI:10.1210/jendso/bvad114.2080] [PDF]
译文修订记录
| 日期 | 详情 |
|---|---|
| 2022 年 10 月 25 日 | 初次翻译。 |
| 2025 年 5 月 29 日 | 第一次修订,增补了后记,更正了多处翻译错误和不当叙述,整理链接。 |