摘要
在女性化激素疗法当中,口服孕酮是最常用的孕酮形式。早前,通常治疗用剂量的口服孕酮,被认为可达到顺性别妇女在黄体期通常的孕酮水平(约 7–22 ng/mL),这由早年一些未有准确验血结果(即使用了未经充分层析纯化的免疫测定法)的研究项目所支持。然而,新近的研究项目通过更精确的验血方法(经层析纯化的免疫测定法、和质谱测定法等)发现,无论饭前或饭后,每日服用 100 mg 孕酮仅可达到很低的约 2–3 ng/mL 的孕酮水平峰值,以及约 0.1–0.6 ng/mL 的 24 小时内孕酮平均水平。无独有偶,临床研究也发现口服孕酮仅产生较弱的孕酮效力。
如为提高孕酮水平而使用更大剂量的孕酮,则作用很有限;这是因为,1) 孕酮水平仍旧很低;2) 肝脏的首过效应产生的神经甾体有显著副作用;3) 个体间会有明显差别。
这种孕酮水平对于顺性别妇女,显然足可对子宫内膜起保护作用;但对于女性倾向跨性别者则不大能按预期奏效。
因此,如欲起到足够的孕激素效力,女性倾向跨性别者及其医师要避免采用口服孕酮;非口服途径(如经直肠给药,或注射)孕酮的生物利用度更高,可以一用。合成孕酮制剂可替代孕酮使用,其同样具有完全的孕激素效力。
前言
人体中的主要雌性激素有雌激素和孕激素;二者可用于女性化激素治疗。当用于女性倾向跨性别者时,孕激素有助于抑制睾酮水平,并可能影响乳房发育(但作用不明确)。
孕激素分为两种:(天然)孕酮和人工合成的孕激素制剂。其中,孕酮在药代动力学上相对欠妥,而合成孕激素解决了这项问题;但是,后者的药效学特性与孕酮不同,有的可能会引起负面作用。因此,尽管有药代动力学上的不足,但孕酮仍受到某些女性倾向跨性别者和其他人群(如顺性别妇女)的关注;相比于合成孕激素,其更宁愿使用孕酮。
市面上,孕酮以多种不同给药途径的形式提供;其中包括口服片、舌下含服片、外用制剂、阴道制剂、直肠制剂和注射剂等(维基百科; 表格)。口服是最易于获取和使用的途径;相应地,口服孕酮也是女性倾向跨性别者最常用的孕酮形式。然而,孕酮存在一些药代动力学相关的问题,这限制了口服孕酮的有利性;此外,这种局限性实际上明显超出人们普遍认为的程度,但这项事实却被许多(并非全部)有关口服孕酮之药代动力学研究的方法局限性所掩盖。
本文旨在对这类研究进行解释和回顾,并探讨在女性倾向跨性别者的孕激素治疗中有哪些能够取代口服孕酮的方案和选项。
口服孕酮引起的孕酮水平
制药厂规模生产的口服(微粉化)孕酮,是一种包含孕酮微晶的油悬浮液胶囊。其上市品牌包括 Prometrium、Utrogestan、Microgest 等等。受肠道及肝脏的首过效应影响,口服孕酮的生物利用度非常低,不大于 10%——绝大部分孕酮在进入血流前,会被代谢成为别孕烷醇酮、孕烷醇酮等神经甾体(de Lignieres, Dennerstein, & Backstrom, 1995)。这就是为什么口服孕酮会有镇静等类似于酒精的副作用,而经阴道给药或注射的孕酮则无此影响。 不过,在生物利用度低的情况下,临床上口服孕酮的通常剂量(如 100–300 mg/天)已被报告可产生和顺性别妇女月经周期当中的黄体期相当的孕酮水平(通过免疫测定法测得)(Simon et al., 1993)。因此,口服孕酮被确信可达到较高的、符合生理所需的孕酮水平。
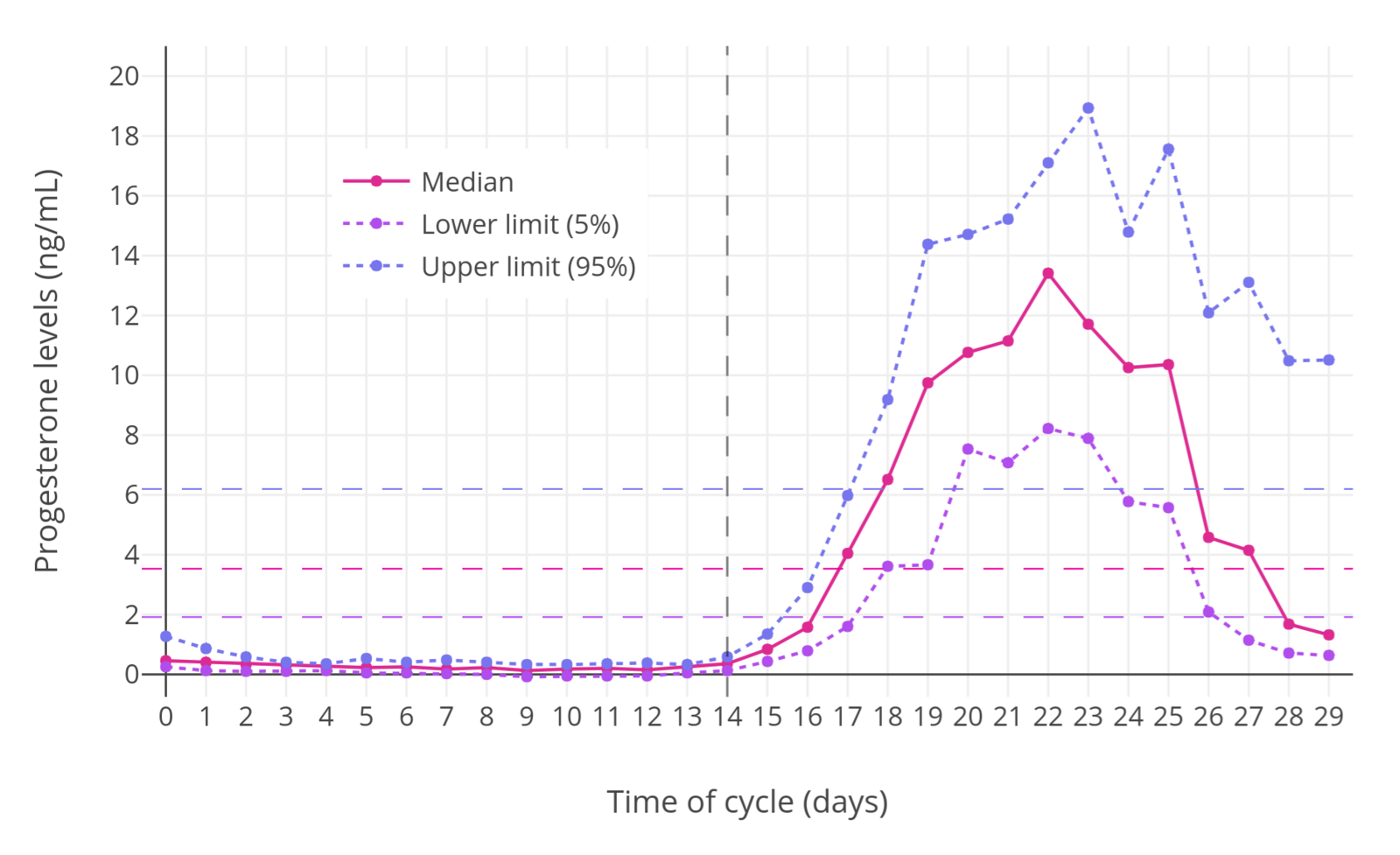
「图一」正常绝经前妇女的月经周期当中,孕酮水平的变化(Stricker et al., 2006)。其中,横向虚线代表各折线的平均水平;纵向虚线区分排卵前后。通常仅当在黄体期内,孕酮水平才会升高。
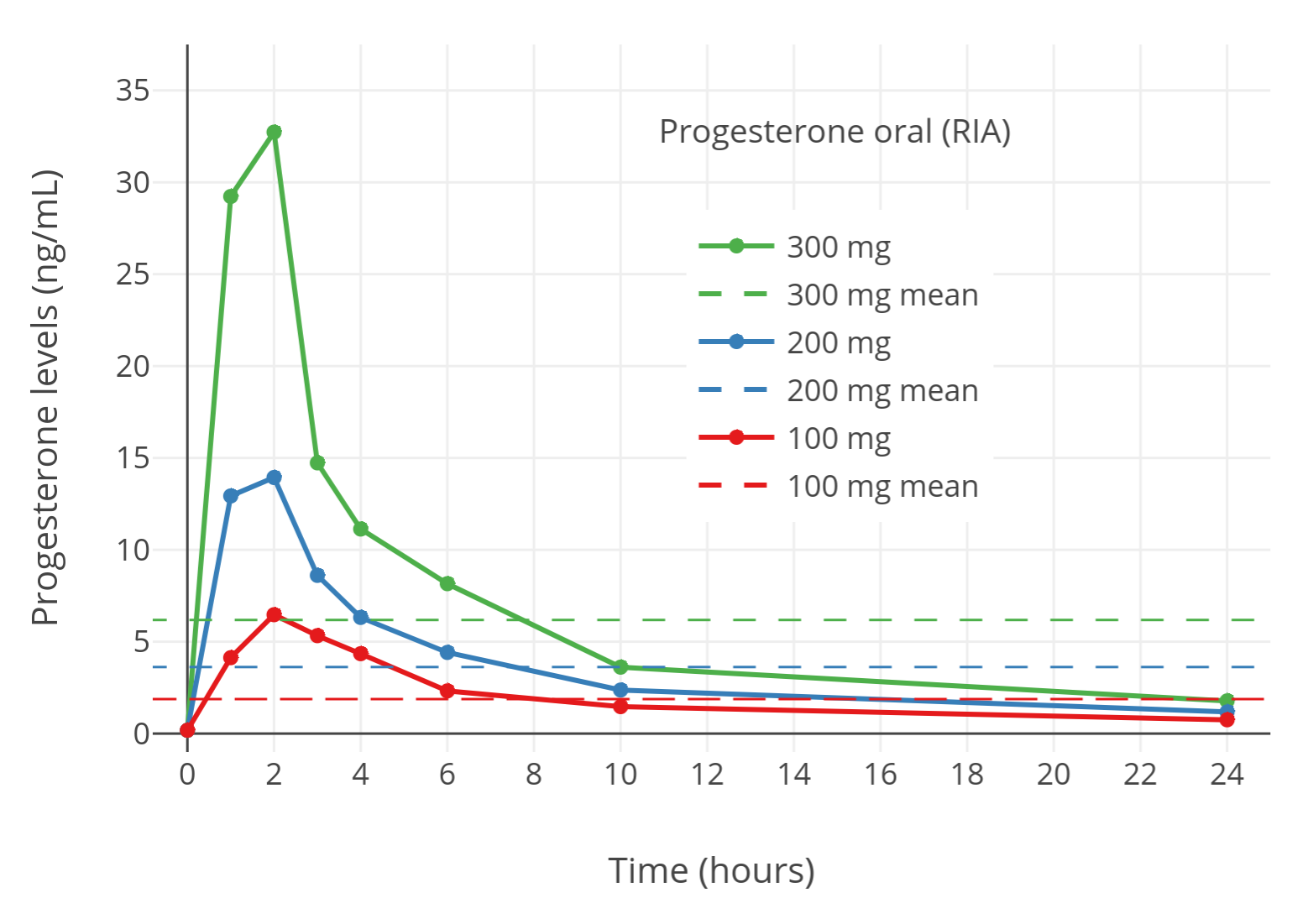
「图二」已绝经妇女单次口服 100–300 mg 孕酮(微粉化)之后,孕酮水平的变化(通过免疫测定法测得)(Simon et al., 1993)。其中,横向虚线代表各折线的 24 小时平均水平。服药达成的孕酮水平似乎与正常黄体期的水平相一致。然而,使用免疫测定法得到的结果其实并不准确(Nahoul & de Ziegler, 1994)。
目前可以肯定,上述结论并不属实。这是因为,免疫测定法年代久远,在准确度和可靠性上存在缺陷;对于孕酮的测定,其暴露出了特异性不足的问题。其中,用于测定孕酮的免疫蛋白,会跟孕酮的代谢物——5α-二氢孕酮、别孕烷醇酮、孕烷醇酮等——产生交叉反应,最终计入到孕酮总量当中。由于口服孕酮的首过效应所产生的孕酮游离代谢物水平较高,这种交叉反应显然导致采用免疫测定法的研究项目(正如 Simon et al., 1993 等),明显高估了孕酮口服后产生的水平(Nahoul et al., 1993; Nahoul & de Ziegler, 1994)。 另外一些采用了特异性更佳的测定方法的研究项目,则发现了口服孕酮所达到的孕酮水平其实非常低(Nahoul, Dehennin, & Scholler, 1987; Nahoul & de Ziegler, 1994; Levine & Watson, 2000; Kuhl, 2011; Kuhl & Schneider, 2013; Davey, 2018)。其测定方法包括:经充分层析纯化的免疫测定法,以及液相色谱—质谱联用法(LC-MS;被认为是临床上测定性激素水平的“黄金标准”)(Kuhl & Schneider, 2013; Woodward & Rumsby, 2019; Conklin & Knezevic, 2020)。
有一项使用 LC-MS 的研究发现,在单次口服 100 mg 孕酮之后,孕酮水平峰值仅达 2 ng/mL,24 小时内的平均水平仅有 0.14 ng/mL(Levine & Watson, 2000; Kuhl & Schneider, 2013)。另一项更新近、同样采用 LC-MS 的研究则发现,饭后单次口服 100 mg 孕酮之后,孕酮水平峰值约达 2.5–3 ng/mL,24 小时内的平均水平约为 0.6 ng/mL(Lobo et al., 2019)——需要提及的是,饭后口服孕酮,可将其生物利用度翻上好几倍(维基百科; 经 FDA 批准的 Bijuva 药品说明书; Simon et al., 1993; FDA 对 Prometrium 药品的评述, 1996; Pickar et al., 2015)。这样的孕酮水平明显低于正常黄体期的孕酮水平——后者经 LC-MS 测定,介乎 7–22 ng/mL(Nakamoto, 2016)。 一些研究项目将以免疫测定法与其它更可靠方法测定的孕酮结果进行直接比较,发现免疫测定法下,孕酮水平会被高估 5–8 倍(Nahoul, Dehennin, & Scholler, 1987; Nahoul & de Ziegler, 1994; Levine & Watson, 2000; Kuhl, 2011; Kuhl & Schneider, 2013; Davey, 2018)。有一项包含几名受试者的小型研究,采用了多种已商业化的免疫测定法,其高估程度在 2 倍到 40 倍之间(Sapin et al., 2000)。 这些发现相当偏僻,在科研及医学界至今尚鲜为人知。但无论如何,可以肯定的是,口服孕酮所达到的孕酮水平远低于早年一度认为的那样,亦低于黄体期的水平——后者是女性倾向跨性别者在治疗过程中应该要达到的。
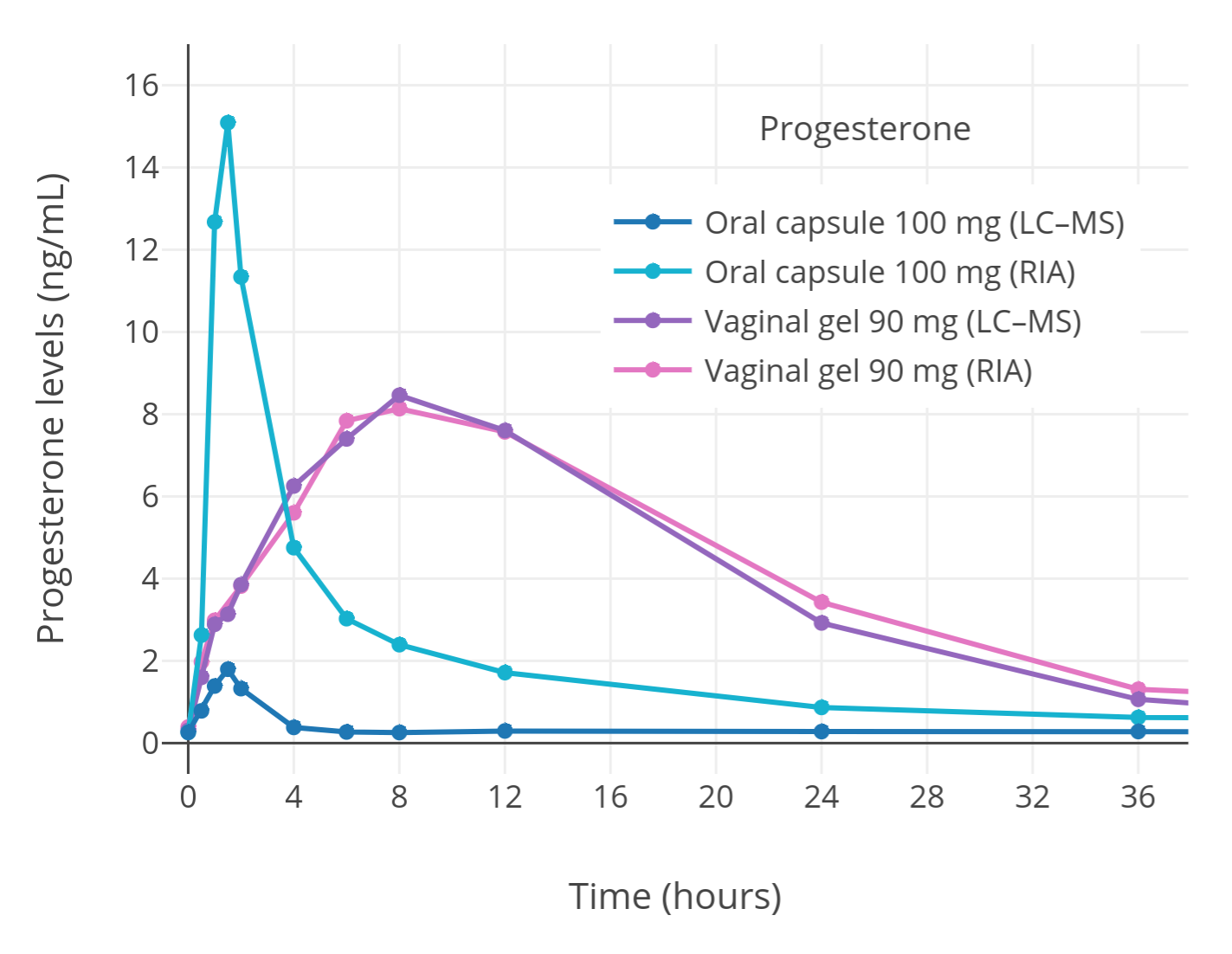
「图三」已绝经妇女单次口服或经阴道给予孕酮(微粉化)之后,孕酮水平的变化(通过免疫测定法或 LC-MS 测得)(Levine & Watson, 2000; Kuhl & Schneider, 2013)。其中,口服孕酮后使用免疫测定法的结果受交叉反应影响,错误地偏高了。而以 LC-MS 测定的结果,和经阴道给药后的测定结果,可认为较准确。
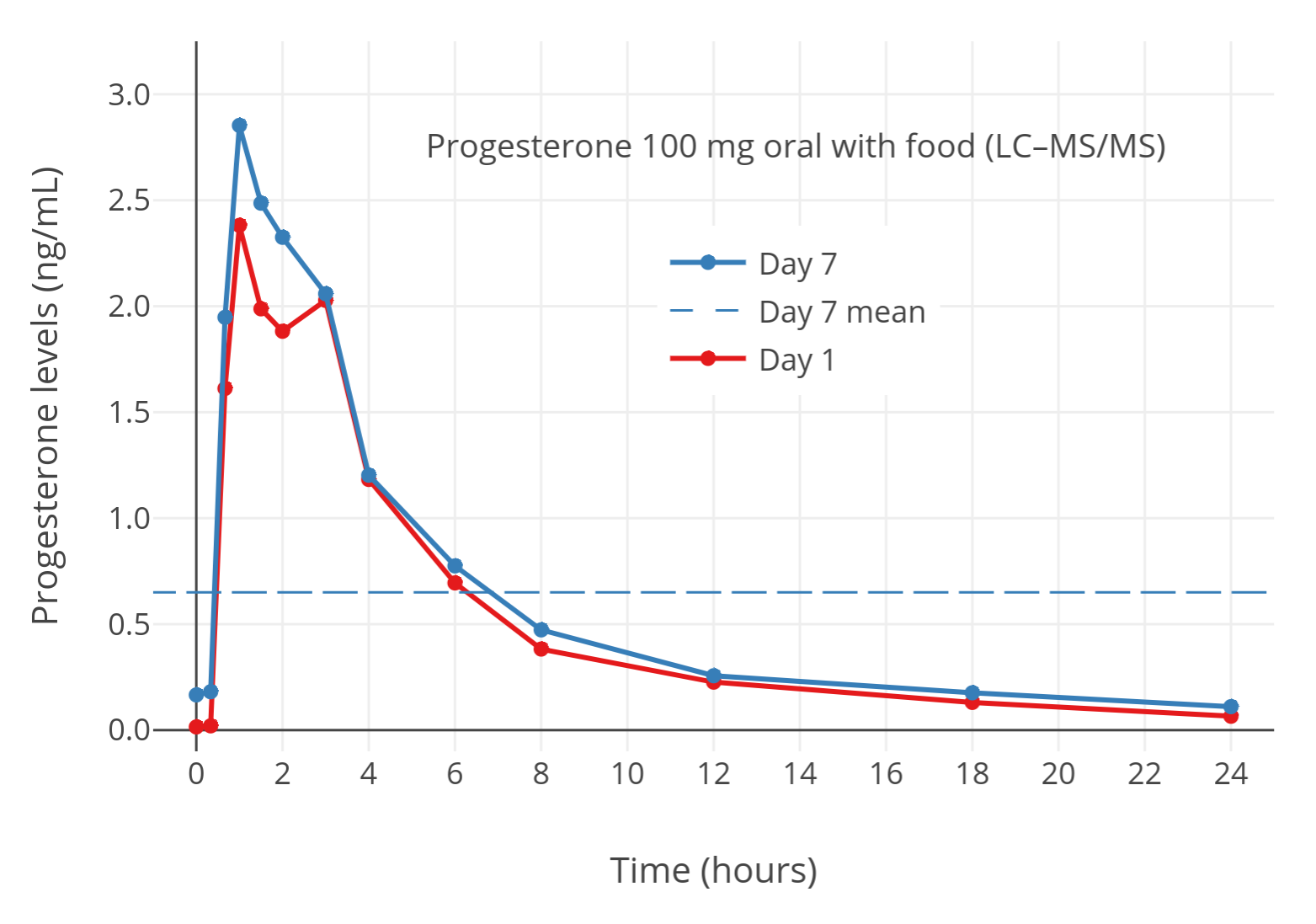
图 4:已绝经妇女饭后口服 100 mg/天的孕酮(微粉化)之后,孕酮水平的变化(通过 LC-MS 测得)(Lobo et al., 2019)。其中,横向虚线表示 24 小时内的平均水平。饭后口服孕酮可将孕酮水平提升约 2–3 倍(Bijuva 药品说明书; Simon et al., 1993)。本项目结果使用 LC-MS 测定,可认为较准确。
临床表现
孕激素效力与效应
数十年间,有一系列关于口服孕酮引起的孕激素临床效应的发现涌现了出来,其在当时令人费解;而今有了以更精确的测定方法得到的有关口服孕酮的数据,它们变得顺理成章了。临床医学上,口服孕酮多被用于更年期妇女,保护子宫内膜免受雌激素的不受控制的刺激,从而可避免雌激素引起的子宫内膜增生——即便是在临床上的通常剂量所达到孕酮水平较低的情况下(维基百科)。不过,根据一项大型观察性研究,口服孕酮并不足以抑制由雌激素促成的子宫内膜癌之风险(Davey, 2018)。即便采用超高剂量,口服孕酮仍无法促成子宫内膜的完全转化(黄体期内高孕酮水平所带来的正常效应);而经阴道给药或注射的孕酮则可有效促成转化(de Ziegler et al., 2013)。因此,和胃肠外给药不同,口服孕酮被认为不适合用于辅助生育(de Ziegler et al., 2013)。 此外,对于顺性别男性,即便使用超高剂量(400 mg/天)的口服孕酮,亦未能压制其睾酮水平(Trollan et al., 1993; 维基百科)。与此相反,顺性别男性使用直肠给药的孕酮、注射用孕酮与合成孕酮制剂,皆可实实在在地压制其睾酮水平(维基百科; Aly, 2019)。 对于更年期顺性别妇女,口服孕酮同样仅表现出了些微、以至无明显的抗促性腺激素效应,这亦和合成孕酮制剂的表现大相迥异(Holst, 1983; Holst et al., 1983; Ottosson, 1984; Maxson & Hargrove, 1985; Saarikoski, Yliskosk, & Penttilä, 1990)。
目前认为,更年期妇女使用雌激素疗法时加入口服孕酮,并不会额外提高患静脉血栓栓塞(VTE)的风险,这与其它临床上使用的孕酮情况不同(维基百科);其在短期(小于 5 年)的疗程内,也不会增加乳腺癌风险(维基百科)。然而,在长期治疗(不小于 5 年)的情况下,使用雌激素与孕酮(口服)合并疗法的乳腺癌风险将显著高于单雌激素疗法——这与其它孕激素形式相似(Aly, 2020; Sam, 2020; 维基百科; 表格)。 已有人评论道,由于口服孕酮对乳腺的增生作用很弱,其对乳腺癌风险之增长的作用需要更长的暴露时间方可显现,这与上述相一致(Kuhl & Schneider, 2013; Davey, 2018)。有临床前研究也表明了孕酮及其受体的激活在乳腺当中有致癌性作用(Kuhl & Schneider, 2013; Trabert et al., 2020)。 以上有关口服孕酮对子宫内膜之效力、对睾酮与促性腺激素之压制、对静脉血栓与乳腺癌风险之影响的临床发现,和有关其它几乎所有临床使用的合成孕酮制剂的情况皆大相径庭(但表现类似于口服孕酮的制剂:地屈孕酮除外)。这种差别在早年曾令人费解,但如今发现口服孕酮所达成的孕酮水平相当低之后,一切都变得顺理成章。
生物利用度、半衰期与持续时间
在一些采用更精确的测定方法的研究项目观察到口服孕酮所达到的水平远低于早年资料之后,有必要重新评估口服孕酮的生物利用度。在(早年)采用免疫测定法的研究当中,口服孕酮的生物利用度被报告大致为 10%(维基百科)。至于其真实的生物利用度,由于迄今尚未有采用更可靠的测定方法的项目进行过(测量),故并未可知;无论如何,基于免疫测定法会将孕酮水平高估 5–8 倍的发现,可以估计其应接近于 1–2%。
关于口服孕酮之后的消除半衰期,迄今已有采用免疫测定法的研究项目测定其为 16–18 小时(维基百科)。考虑到孕酮在静脉注射之后仅有很短的约 3 分钟至 1.5 小时的半衰期(维基百科),口服孕酮有如此持久的半衰期显然超乎预期。相比之下,口服雌二醇由于在首过效应之后会形成雌二醇结合物的血清“蓄水池”,可缓慢释放出雌二醇,故其半衰期较长,达 13–20 小时(Kuhl, 2005; 维基百科)。不过,不同于雌二醇,孕酮并无可供结合的羟基团,从而不具备形成类似雌二醇的孕酮结合物“蓄水池”的可能性(Kuhl, 2005)。
一些采用 LC-MS 等更可靠的测定方法的研究发现,口服孕酮的半衰期为 5–10 小时,而较高孕酮水平的维持时长仅有约 4–8 小时(维基百科; 图表)。这些发现也表明,口服孕酮的作用时长远小于早前所认为的那样。因此,如要使用口服孕酮,应建议每日分多次服用以维持稳定的孕酮暴露量。
高剂量口服孕酮与神经甾体副作用的关系
使用高于常规剂量的口服孕酮,似乎会相应提高孕酮水平(表格)。然而,既然已经从较可靠的测定方法知道了口服孕酮引起的孕酮水平有多低,那么可以确信,在大多数情况下,即便用超高剂量也不会有多高的孕酮水平。另外,使用高剂量口服孕酮会导致体内其神经甾体代谢物的水平变得很高,而这被发现会大大增强类似于酒精的副作用(即对神经中枢的抑制及其衍生效应)(维基百科1; 维基百科2)。这些限制因素会让高剂量的口服孕酮变得不大可行。
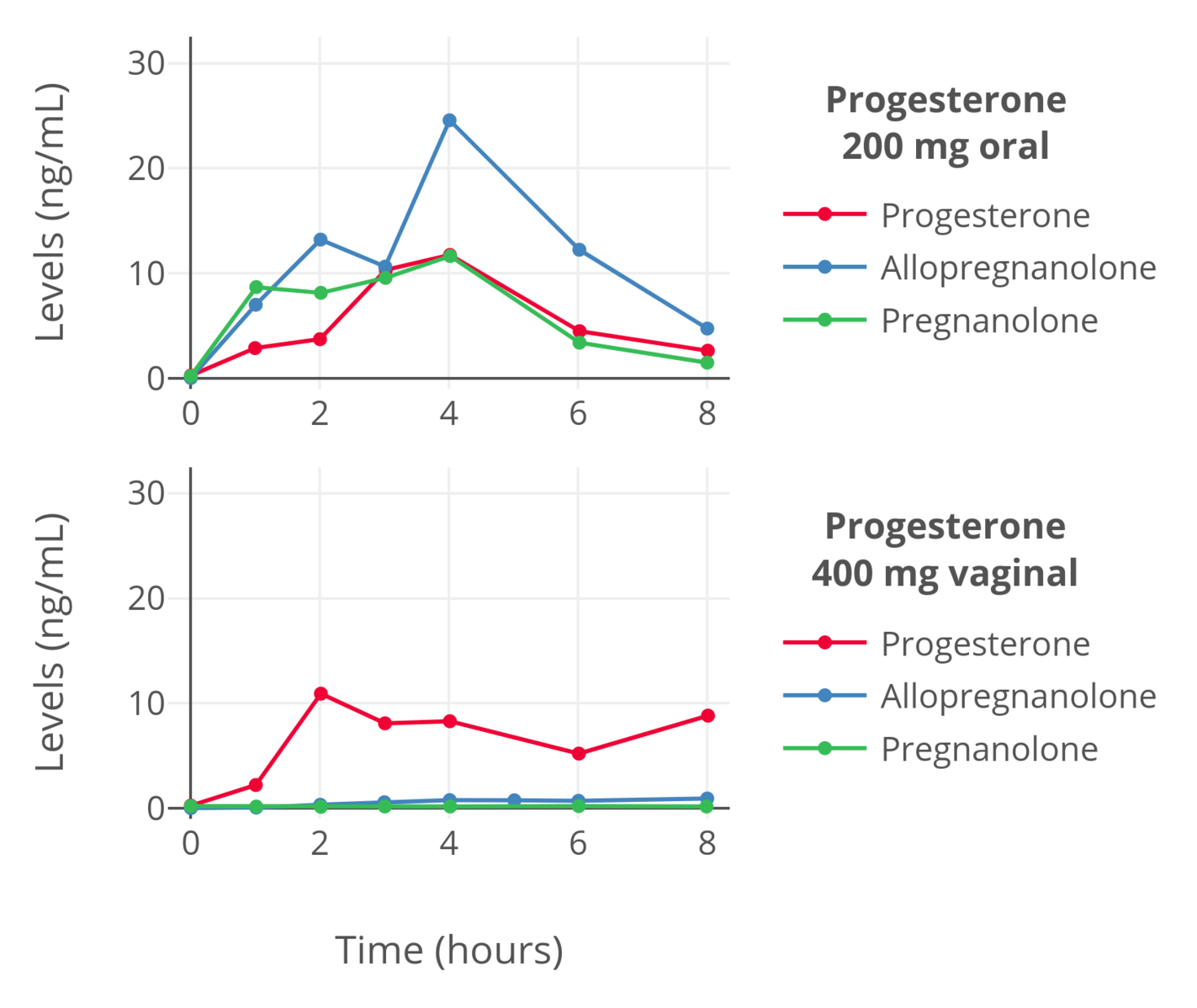
图 5:绝经前妇女单次口服(或经阴道给予栓剂)孕酮之后,体内孕酮、别孕烷醇酮和孕烷醇酮水平的变化(de Lignieres, Dennerstein, & Backstrom, 1995)。其中,别孕烷醇酮和孕烷醇酮以质谱分析法测定,而孕酮则以经层析纯化的免疫测定法测定;故此,以上数据应当可靠。
关于口服孕酮之代谢物的补充
口服孕酮在首过效应之后,孕酮水平之低与孕酮代谢物数量之高显得不成比例(Sitruk-Ware et al., 1987; de Lignieres, Dennerstein, & Backstrom, 1995; de Lignieres, 1999; de Ziegler & Fanchin, 2000; Lobo, 2000; Kuhl, 2005)。此外,有一部分孕酮代谢物尽管在效力上远弱于孕酮,但其孕激素活性被发现和孕酮本身相当(例如 Besch et al., 1965; Junkermann, Runnebaum, & Lisboa, 1977; Lobo, 2000)。其活性来源有两方面:其本身固有的孕激素活性;或者其又被转化成孕酮或其它孕酮代谢物(这属于某些组织的胞内活动的一部分,例如子宫)。这些代谢物包括:20α-二氢孕酮、20β-二氢孕酮、5α-二氢孕酮、3β-二氢孕酮、别孕烷醇酮和 11-去氧皮质酮等等。 如果口服孕酮可以通过代谢物产生大部分孕激素活性,那么其孕激素作用强度会大于其在孕酮水平上所体现的那样;然而,这仅仅存在理论可能,而且迄今罕有文献对此加以讨论。尚需更多研究来确定口服孕酮之代谢物是否真的会在口服孕酮效力上发挥一定作用。 无论如何,基于临床对口服孕酮的孕激素效应之研究,其依旧是效力相对较弱的一种孕激素形式。
口服孕酮的替代选项
非口服形式的孕酮
诸如阴道栓剂、直肠栓剂、舌下含服制剂以及注射剂等非口服形式的孕酮,已知可达到远高于口服的孕酮水平(维基百科)。它们可取代口服孕酮使用,以达到更高、更合适的孕酮水平。然而很遗憾,它们尽管有更高效力,但也有各自的限制因素。
首先是孕酮阴道栓剂:对于女性倾向跨性别者,如未进行阴道成形术,其显然无法使用之;即便经过手术,其新阴道的内壁亦并非正常的阴道粘膜,而是皮瓣(阴茎翻转法)或肠壁(乙状结肠移植法)。因此,经新阴道给药的吸收特征可能和(原生)阴道的情况不同(Aly, 2018)。需要指出,透皮给予孕酮所达到的孕酮水平,和口服同样低,故而其并非孕酮治疗的一个好选项(维基百科; Hermann et al., 2005; 图表)。如以阴茎翻转法再造阴道,当使用孕酮阴道栓剂时,应该仅可达到很低的孕酮水平。
其次是孕酮直肠栓剂:其可达到和正常黄体期一样高的孕酮水平,是一种不错的给药途径。不过,其给药后作用时长稍短,可能需要一日使用两次以维持孕酮水平稳定。 更大的问题在于,目前世界上由制药厂出品的孕酮直肠栓剂供应有限,在大部分国家均未上市(维基百科)。不过,一些国家的配药房可制作此类栓剂。 另外,可以轻松获得的孕酮口服胶囊,在用于阴道给药时取得了成功(Miles et al., 1994; Wang et al., 2019)。孕酮口服胶囊用于直肠给药的形式显然卓有成效,也可达到远高于口服的孕酮水平,颇似直肠栓剂(Aly, 2019)。然而,这种应用形式尚未经过正式研究,而一些女性倾向跨性别者亦报告了以此法仅可获得很低的孕酮水平。 直肠栓剂尽管很高效,但使用(尤其是长期使用)则较为不便。不过无论如何,在非口服途径的孕酮形式当中,直肠栓剂或为最优之选。
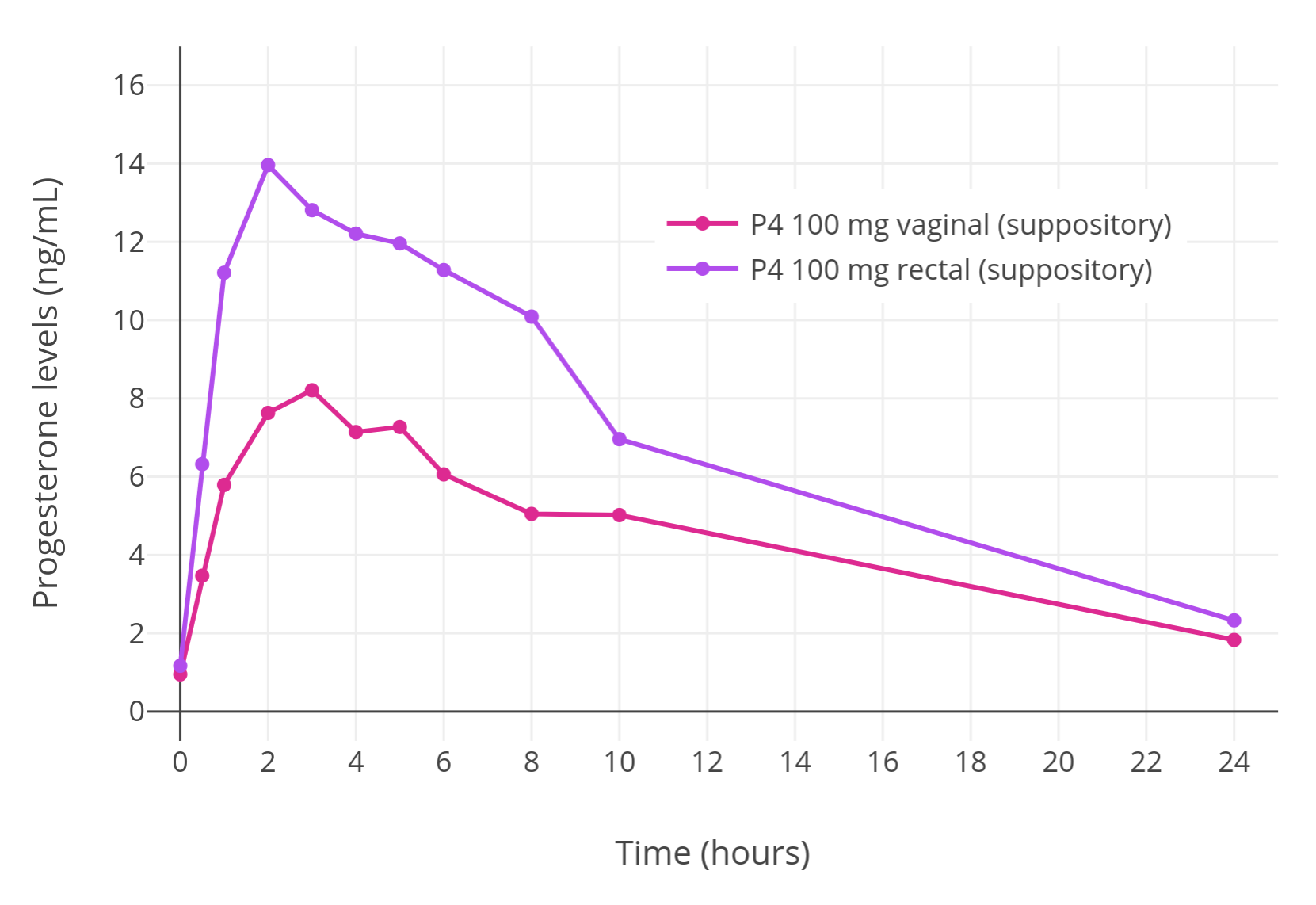
图 6:绝经前妇女单次经直肠或阴道给予 100 mg 孕酮栓剂之后,孕酮水平的变化(Chakmakjian & Zachariah, 1987)。
再次是舌下含服的孕酮:其可达到较高的、比口服更接近生理的孕酮水平,但维持高水平的时长也较短,每日需分多次服用(维基百科; 图表)。另外,早年其曾于全球广泛上市(维基百科),而今仅在一些东欧国家可用(维基百科)。不过,某些国家的药店可能亦有售。 迄今已有人描述了口服(微粉化)孕酮用于舌下含服的经过,而此用法尚未被正式研究过;不过,考虑到口服孕酮的剂型是油悬浮液胶囊,其用于舌下含服并不容易。因此,舌下含服口服用(微粉化)孕酮看来有难度,可能也不大舒适。
最后是孕酮注射剂(肌注或皮下注射):其可轻松达到相当高的孕酮水平(维基百科1; 多图表1; 维基百科2; 图表2),但孕酮维持时间在诸性激素注射剂当中较短,每 1–3 日便需注射一次。对多数人而言(尤其是长期用药者),如此注射间隔显然过于频繁。此外,相较肌注更为方便的、用于皮下注射的孕酮,供应很有限,目前基本仅在欧洲上市(维基百科)。 由于孕酮无任何可供结合为酯的羟基团,因此也不可能合成孕酮酯,这种酯本应具有更佳的脂溶性、并在注射后延长孕酮维持时间;此性质与雌二醇、睾酮等其它性激素截然不同。除此之外,孕酮水悬浮液注射剂曾因其维持时长远甚于当下正在使用的油溶液、水溶液注射剂,而上市了一段时间(维基百科1; 维基百科2; Aly, 2019);但其代价是注射位点会引起疼痛等不适,从而导致其退市。不过,当下在一些东欧国家,似乎尚可见到孕酮水悬浮液注射剂在使用(Aly, 2019)。
合成孕酮制剂
合成孕酮制剂可代替孕酮使用(Aly, 2018)。其中一些存在脱靶效应(例如较弱的雄激素/糖皮质激素活性),从而不适合用于女性化激素疗法;这些制剂包括醋酸甲羟孕酮和大多数 19-去甲睾酮类似物(如炔诺酮、左炔诺孕酮)等(Kuhl, 2005; Aly, 2018)。 不过,有许多其它合成孕酮具备更适合用于该疗法的特性,问题也更少;例如醋酸环丙孕酮(低剂量)(Aly, 2019)、屈螺酮、地诺孕素、醋酸诺美孕酮、己酸羟孕酮和苯乙酮缩二羟孕酮等(Kuhl, 2005)。上述制剂均不表现除孕激素之外的任何不良生理活性(Kuhl, 2005)。 另外,还有一种叫地屈孕酮的合成制剂,其虽无任何不利的生理活性,但却表现出不寻常的孕激素特性,无法确保能够提供和非口服途径的孕酮、或其它类型孕激素相当的完全孕激素效力(维基百科)。 目前尚无任何合成孕酮会产生神经甾体代谢物及其衍生反应,这点与孕酮相反(Kuhl, 2005)。
总结
总的而言,临床剂量下的口服孕酮仅可达到很低的孕酮水平,其孕激素效力也远弱于生理所需的水平。尽管加大其剂量似乎能提高体内孕酮水平,但事实上孕酮水平仍维持低值,而且伴随而来的神经甾体之副作用会更大、更难以承受,从而使此法变得不可行。
基于以上限制,如要达到产生足够孕激素效力的目的,女性倾向跨性别者及其医师应避免使用口服孕酮。替代选项有非口服途径的孕酮(如直肠给药、注射,但有可用地域少、使用不便等限制),以及合成孕酮制剂(尤其是特性上更合乎需求者)。
准确来说,口服孕酮大体上应该归类为一种具有较弱孕激素效力的强效神经甾体前体药。与此相反,非口服途径的孕酮、以及合成孕酮制剂,皆可视为强效孕激素——前者具有生理强度的神经甾体效力,后者则无。
扩展材料
相关文献
本文所引用资料来源、文献等,已汇总于此处;其中,某些文献被本文引用,以讨论有关测量问题、以及口服孕酮后体内水平之低的话题,此处将其引用片段列出。
外部链接
参考文献
- Besch, P. K., Barry, R. D., Vorys, N., Stevens, V., & Ullery, J. C. (1965). A review of some aspects of the metabolism of progestational agents. Metabolism, 14(3), 432–443. [DOI:10.1016/0026-0495(65)90031-4]
- Bijuva Estradiol/Progesterone Label. U.S. Food and Drug Administration. [URL] [PDF]
- Chakmakjian, Z. H., & Zachariah, N. Y. (1987). Bioavailability of progesterone with different modes of administration. The Journal of Reproductive Medicine, 32(6), 443–448. [Google Scholar] [PubMed] [PDF]
- Conklin, S. E., & Knezevic, C. E. (2020). Advancements in the gold standard: Measuring steroid sex hormones by mass spectrometry. Clinical Biochemistry, 82, 21–32. [DOI:10.1016/j.clinbiochem.2020.03.008]
- Davey, D. A. (2018). Menopausal hormone therapy: a better and safer future. Climacteric, 21(5), 454–461. [DOI:10.1080/13697137.2018.1439915]
- de Lignières, B., Dennerstein, L., & Backstrom, T. (1995). Influence of route of administration on progesterone metabolism. Maturitas, 21(3), 251–257. [DOI:10.1016/0378-5122(94)00882-8]
- de Lignières, B. (1999). Oral micronized progesterone. Clinical Therapeutics, 21(1), 41–60. [DOI:10.1016/S0149-2918(00)88267-3]
- de Ziegler, D., & Fanchin, R. (2000). Progesterone and progestins: applications in gynecology. Steroids, 65(10–11), 671–679. [DOI:10.1016/S0039-128X(00)00123-9]
- de Ziegler, D., Streuli, I., Marszalek, A., Gayet, V., & Chapron, C. (2013). Preparing the Endometrium to Maximize Success: The Dynamics of Artificial Cycles. In Sauer, M. V. (Ed.). Principles of Oocyte and Embryo Donation, 2nd Edition (pp. 109–127). London: Springer. [DOI:10.1007/978-1-4471-2392-7_9]
- Hermann, A. C., Nafziger, A. N., Victory, J., Kulawy, R., Rocci Jr, M. L., & Bertino Jr, J. S. (2005). Over‐the‐Counter Progesterone Cream Produces Significant Drug Exposure Compared to a Food and Drug Administration‐Approved Oral Progesterone Product. The Journal of Clinical Pharmacology, 45(6), 614–619. [DOI:10.1177/0091270005276621]
- Holst, J. (1983). Percutaneous estrogen therapy: Endometrial response and metabolic effects. Acta Obstetricia et Gynecologica Scandinavica, 62(Suppl 115), 4–30. [DOI:10.3109/00016348309155363]
- Holst, J., Cajander, S., Carlström, K., Damber, M. G., & von Schoultz, B. (1983). Percutaneous oestrogen therapy opposed by lynestrenol or natural progesterone-effects on circulating oestrogens, FSH, sex hormone binding globulin and pregnancy zone protein. Maturitas, 5(1), 1–8. [DOI:10.1016/0378-5122(83)90015-4]
- Junkermann, H., Runnebaum, B., & Lisboa, B. P. (1977). New progesterone metabolites in human myometrium. Steroids, 30(1), 1–14. [DOI:10.1016/0039-128X(77)90131-3]
- Kuhl, H. (2005). Pharmacology of Estrogens and Progestogens: Influence of Different Routes of Administration. Climacteric, 8(Suppl 1), 3–63. [DOI:10.1080/13697130500148875] [PDF]
- Kuhl, H. (2011). Pharmacology of progestogens. Journal für Reproduktionsmedizin und Endokrinologie [Journal of Reproductive Medicine and Endocrinology], 8(1), 157–177. [URL]
- Kuhl, H., & Schneider, H. P. G. (2013). Progesterone–promoter or inhibitor of breast cancer. Climacteric, 16(Suppl 1), 54–68. [DOI:10.3109/13697137.2013.768806]
- Lobo, R. A. (2000). Progestogens. In Lobo, R. A., Kelsey, J., & Marcus, R. (Eds.). Menopause: Biology and Pathobiology (pp. 429–444). Burlington: Academic Press. [Google Books]
- Lobo, R. A., Liu, J., Stanczyk, F. Z., Constantine, G. D., Pickar, J. H., Shadiack, A. M., Bernick, B., & Mirkin, S. (2019). Estradiol and progesterone bioavailability for moderate to severe vasomotor symptom treatment and endometrial protection with the continuous-combined regimen of TX-001HR (oral estradiol and progesterone capsules). Menopause (New York, NY), 26(7), 720–727.[DOI:10.1097/GME.0000000000001306]
- Levine, H., & Watson, N. (2000). Comparison of the pharmacokinetics of Crinone 8% administered vaginally versus Prometrium administered orally in postmenopausal women. Fertility and Sterility, 73(3), 516–521. [DOI:10.1016/S0015-0282(99)00553-1]
- Maxson, W. S., & Hargrove, J. T. (1985). Bioavailability of oral micronized progesterone. Fertility and Sterility, 44(5), 622–626. [DOI:10.1016/S0015-0282(16)48977-6]
- Miles, R. A., Paulson, R. J., Lobo, R. A., Press, M. F., Dahmoush, L., & Sauer, M. V. (1994). Pharmacokinetics and endometrial tissue levels of progesterone after administration by intramuscular and vaginal routes: a comparative study. Fertility and Sterility, 62(3), 485–490. [DOI:10.1016/S0015-0282(16)56935-0]
- Nahoul, K., Dehennin, L., & Scholler, R. (1987). Radioimmunoassay of plasma progesterone after oral administration of micronized progesterone. Journal of Steroid Biochemistry, 26(2), 241–249. [DOI:10.1016/0022-4731(87)90078-1]
- Nahoul, K., Dehennin, L., Jondet, M., & Roger, M. (1993). Profiles of plasma estrogens, progesterone and their metabolites after oral or vaginal administration of estradiol or progesterone. Maturitas, 16(3), 185–202. [DOI:10.1016/0378-5122(93)90064-O]
- Nahoul, K., & de Ziegler, D. (1994). “ Validity” of serum progesterone levels after oral progesterone. Fertility and Sterility, 61(4), 790–792. [DOI:10.1016/S0015-0282(16)56666-7]
- Nakamoto, J. (2016). Endocrine Testing. In Jameson, J. L., & De Groot, L. J. (Eds.). Endocrinology: Adult and Pediatric, 7th Edition (pp. 2655–2688.e1). Philadelphia: Saunders/Elsevier. [DOI:10.1016/B978-0-323-18907-1.00154-2]
- Ottosson, U. B. (1984). Oral progesterone and estrogen/progestogen therapy: effects of natural and synthetic hormones on subfractions of HDL cholesterol and liver proteins. Acta Obstetricia et Gynecologica Scandinavica, 63(Suppl 127), 1–37. [DOI:10.3109/00016348409157016]
- Pickar, J. H., Bon, C., Amadio, J. M., Mirkin, S., & Bernick, B. (2015). Pharmacokinetics of the first combination 17β-estradiol/progesterone capsule in clinical development for menopausal hormone therapy. Menopause (New York, NY), 22(12), 1308–1316. [DOI:10.1097/GME.0000000000000467]
- Prometrium FDA Review 1996. Application Number: NDA 19-781. Clinical Pharmacology and Biopharmaceutics Review(s) [Prometrium]. Center for Drug Evaluation and Research, U.S. Food and Drug Administration. [PDF]
- Saarikoski, S., Yliskosk, M., & Penttilä, I. (1990). Sequential use of norethisterone and natural progesterone in pre-menopausal bleeding disorders. Maturitas, 12(2), 89–97. [DOI:10.1016/0378-5122(90)90086-L]
- Sapin, R., Neamtu, D., Gasser, F., Ohl, J., Grunenberger, F., & Grucker, D. (2000). De la prudence lors de l’utilisation des dosages directs de progestérone. [Caution when using direct progesterone assays.] Immuno-analyse et Biologie Spécialisée, 3(15), 203–204. [DOI:10.1016/S0923-2532(00)80010-1] [英译本]
- Simon, J. A., Robinson, D. E., Andrews, M. C., Hildebrand III, J. R., Rocci Jr, M. L., Blake, R. E., & Hodgen, G. D. (1993). The absorption of oral micronized progesterone: the effect of food, dose proportionality, and comparison with intramuscular progesterone. Fertility and Sterility, 60(1), 26–33. [DOI:10.1016/S0015-0282(16)56031-2]
- Sitruk-Ware, R., Bricaire, C., De Lignieres, B., Yaneva, H., & Mauvais-Jarvis, P. (1987). Oral micronized progesterone: Bioavailability pharmacokinetics, pharmacological and therapeutic implications—A review. Contraception, 36(4), 373–402. [DOI:10.1016/0010-7824(87)90088-6]
- Stricker, R., Eberhart, R., Chevailler, M. C., Quinn, F. A., Bischof, P., & Stricker, R. (2006). Establishment of detailed reference values for luteinizing hormone, follicle stimulating hormone, estradiol, and progesterone during different phases of the menstrual cycle on the Abbott ARCHITECT® analyzer. Clinical Chemistry and Laboratory Medicine (CCLM), 44(7), 883–887. [DOI:10.1515/CCLM.2006.160]
- Tollan, A., Øian, P., Kjeldsen, S. E., Eide, I., & Maltau, J. M. (1993). Progesterone reduces sympathetic tone without changing blood pressure or fluid balance in men. Gynecologic and Obstetric Investigation, 36(4), 234–238. [DOI:10.1159/000292636]
- Trabert, B., Sherman, M. E., Kannan, N., & Stanczyk, F. Z. (2020). Progesterone and breast cancer. Endocrine Reviews, 41(2), 320–344. [DOI:10.1210/endrev/bnz001]
- Wang, H., Liu, M., Fu, Q., & Deng, C. (2019). Pharmacokinetics of hard micronized progesterone capsules via vaginal or oral route compared with soft micronized capsules in healthy postmenopausal women: a randomized open-label clinical study. Drug Design, Development and Therapy, 13, 2475–2482. [DOI:10.2147/dddt.s204624]
- Woodward, G. M., & Rumsby, G. (2019). Steroid Profiling: Analytical Perspectives. In Rumsby, G., Woodward, G. M. (Eds.). Disorders of Steroidogenesis: Guide to Steroid Profiling and Biochemical Diagnosis (pp. 27–40). Cham: Springer. [DOI:10.1007/978-3-319-96364-8_3]
译文修订历史
| 时间 | 备注 |
|---|---|
| 2022 年 10 月 11 日 | 首次翻译。 |
| 2022 年 11 月 18 日 | 更正 progesterone(孕酮)的名称,增补一条新引用的文献(Wang et al. (2019)),加入若干指向维基百科的链接。 |
| 2023 年 7 月 3 日 | 第一次修订,增补“前言”一章,更新 Sapin et al. (2000) 引用链接。 |