本页为在中国大陆销售的戊酸雌二醇片(“补佳乐”,1 mg)的原厂中文说明书,格式略有改动。请仔细阅读说明书并在医师指导下使用。
核准日期:2006 年 10 月 13 日
修改日期:2007 年 6 月 27 日、2010 年 12 月 5 日、2014 年 1 月 23 日、2016 年 12 月 21 日、2017 年 12 月 18 日、2020 年 9 月 30 日、2021 年 12 月 28 日
警示语
无论是否与孕激素合用,雌二醇均不得用于心血管疾病或痴呆症的二级预防。(参见 注意事项)
女性健康倡议(WHI)研究中,绝经后女性(年龄为 50 至 79 岁)口服结合雌激素 (CEE 0.625 mg)与醋酸甲羟孕酮(MPA 2.5 mg)为期 5 年的治疗期间,与安慰剂对比,降低了髋骨骨折,和结直肠癌风险;
女性健康倡议(WHI)研究中绝大多数受试者超重或肥胖,这可能会增加受试者的乳腺癌风险。
有激素补充治疗既往史女性的浸润性乳腺癌风险增加,而初次治疗者 5–7 年内无统计学意义的风险增加。
女性健康倡议(WHI)研究中的亚组分析表明:对于 60 岁以下,绝经 10 年内没有心血管疾病的受试者,使用激素补充治疗不会引起早期损害,并能降低冠心病的发病率和死亡率。增加 70 岁以上女性的心肌梗死,卒中、肺栓塞和下肢深静脉血栓栓塞风险。(参见 禁忌 和 注意事项)
女性健康倡议记忆研究(WHIMS)是 WHI 的一项子研究;该研究报告称,在年龄大于等于 65 岁的绝经后女性中,与安慰剂相比,单用结合雌激素进行为期 5.2 年的治疗以及口服结合雌激素加醋酸甲羟孕酮进行为期 4 年的治疗,期间痴呆症的发生风险出现升高。这一发现不适用于较年轻的绝经后早期女性。(参见 注意事项)
在 WHI 研究中,未研究口服结合雌激素与醋酸甲羟孕酮的其它剂量,亦未研究雌激素和孕激素的其它复方及剂型,目前尚末有充足数据来比较风险是否等同。没有理由强制性限制激素补充治疗使用时限。是否继续激素补充治疗取决于具有充分知情权的医患双方的审慎决定,并视患者个体化的特殊治疗目的和对后续风险与收益的客观评估而定。激素补充治疗应该控制在最低有效剂量。
药品名称
- 通用名称:戊酸雌二醇片
- 商品名称:补佳乐® Progynova®
- 英文名称:Estradiol valerate tablets
- 汉语拼音:Wusuan Ci’erchun Pian
成份
本品主要成份及其化学名称为:
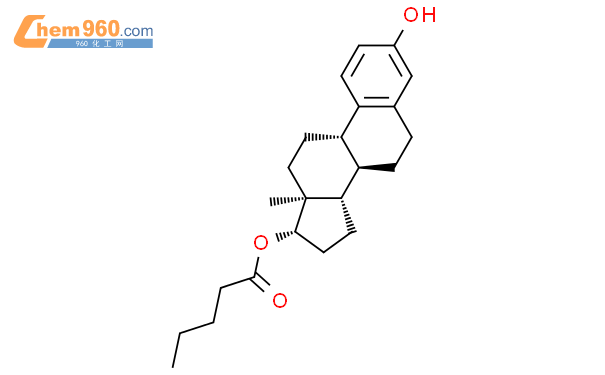
- 戊酸雌二醇: 1,3,5(10)-雌三烯-3,17β-二醇-17-戊酸酯
- 分子式:C23H32O3
- 分子量:356.50
- CAS:979-32-8
- 其化学结构式为:
性状
本品为淡黄色糖衣片,除去包衣后显白色。
适应症
与孕激素联合使用建立人工月经周期中用于补充主要与自然或人工绝经相关的雌激素缺乏:血管舒缩性疾病(潮热),生殖泌尿道营养性疾病(外阴阴道萎缩,性交困难,尿失禁)以及精神性疾病(睡眠障碍,衰弱)。
规格
1 mg
用法用量
口服给药。
剂量根据个体调整,一般每日一片。
根据临床情况,调整个体所需的剂量:一般而言,出现乳房发胀,易激惹的感觉表明剂量太高。如果选择的剂量尚未缓解雌激素缺乏的症状,必须增加剂量。
戊酸雌二醇片 1 mg 可以根据下面的治疗方案给药:
- 间断治疗(周期性)连续 20–25 天后,中断所有治疗 5–6 天,在这一间期内将会发生撤退性出血。
- 连续性,无任何治疗中断。
对于做过子宫切除手术的妇女,如果在停药间期内出现雌激素缺三症状的再次显著的反跳,提示可能适于给予连续性,非周期性的治疗。
对于没有切除子宫的妇女,每个周期必须加用至少 12 天的孕激素治疗,以防止出现雌激素引起的子宫内膜过度增生。
使用孕激素的序贯治疗必须按照下列方案进行:
- 如果以连续方式给予治疗,推荐每月至少服用 12 天的孕激素。
- 如果以间断方式给予治疗,至少在雌激素治疗的最后 12 天内给予孕激素治疗。这样,在每个周期的停药间期内,不给予任何激素治疗。
在两种情况下,孕激素治疗停止后可能发生出血。
应该定期(每 6 个月)进行利弊权衡再评估,以便在需要时调整或放弃治疗:
- 在整个戊酸雌二醇片 1 mg 治疗期间,或
- 由其他激素治疗转换到戊酸雌二醇片 1 mg,或
- 遵医嘱。
不良反应
与 HRT 相关的严重不良反应同时在 注意事项 列出。
下表列出了激素补充治疗使用者报告的,根据 MedDRA(1) 系统器宫分类排列的不良反应(上市后监察)。
| 系统器官分类 | 常见 ≥1/100 至 <1/10 | 不常见 ≥1/1000 至 <1/100 | 罕见 ≥1/10000 至 <1/1000 |
|---|---|---|---|
| 免疫系统疾病 | 超敏反应 | ||
| 代谢和营养类疾病 | 体重变化(体重增加或减轻) | ||
| 精神病类 | 抑郁症 | 焦虑症、性欲增强或减弱 | |
| 神经系统疾病 | 头痛 | 眩晕 | 偏头痛 |
| 眼部疾病 | 视觉障碍 | 隐形眼镜不耐受 | |
| 心脏疾病 | 心悸 | ||
| 胃肠道疾病 | 恶心、腹痛 | 消化不良、食欲增加 | 气胀、呕吐 |
| 皮肤和皮下组织疾病 | 皮疹、瘙痒 | 黄褐斑、荨麻疹、 多形性红斑、 结节性红斑、 血管性紫癜 | 多毛症、痤疮、脱发 |
| 肌肉骨骼和结缔组织疾病 | 肌肉痛性痉挛 | ||
| 生殖系统和乳房疾病 | 月经出血特征变化、 撤退性出血增强或减弱、 经间期出血(2) | 乳房发紧感和疼痛 | 痛经、 阴道分泌物改变、 经前综合征、 乳房增大 |
| 全身疾病和给药部位症状 | 水肿 | 疲劳 |
(1) MedDRA 即“监管活动医学词典”。——编者注
(2) 表现为点滴状出血或突破性出血(继续治疗后,这些不规则出血通常会消失)
乳腺癌
- 接受雌二醇—孕激素联合治疗超过 5 年的女性患者中,诊断为乳腺癌的风险增加 2 倍。
- 使用雌二醇单药治疗患者乳腺癌的风险增加低于雌二醇—孕激素联合治疗患者。
- 风险水平取决于治疗持续时间(参见 注意事项)。
- 大型随机安慰剂对照研究(WHI 研究)的结果和大型前瞻性流行病学研究的荟萃分析,列出了绝对风险的估计值。
大型前瞻性流行病学研究的荟萃分析
BMI 为 27(kg/m2)的女性接受 HRT 治疗 5 年的乳腺癌额外风险估算:
- 开始 HRT 的年龄
- 50 岁
- 50–54 岁每 1,000 例从未接受过 HRT 治疗的女性观察 5 年的乳腺癌发生例数 *
- 13.3 例
- 相对风险 #
- 雌二醇单药治疗:1.2
- 雌二醇—孕激素联合治疗:1.6
- 每 1,000 例接受 HRT 治疗的女性用药 5 年相比未用药人群乳腺癌发生例数的额外增加数
- 雌二醇单药治疗:2.7
- 雌二醇—孕激素联合治疗:8.0
BMI 为 27(kg/m2)的女性接受 HRT 治疗 10 年的额外乳腺癌风险估算:
- 开始 HRT 的年龄
- 50 岁
- 50-54 岁每 1,000 例从未接受过 HRT 治疗的女性观察 10 年的乳腺癌发生例数 *
- 26.6 例
- 相对风险
- 雌二醇单药治疗:1.3
- 雌二醇—孕激素联合治疗:1.8
- 每 1,000 例接受 HRT 治疗的女性用药 10 年相比未用药人群乳腺癌发生例数的额外增加数
- 雌二醇单药治疗:7.1
- 雌二醇—孕激素联合治疗:20.8
* 与 2015 年英格兰女性(BMI 为 kg/m2)的基线发生率相关。
请注意:由于不同欧盟国家的乳腺癌基线发生率不同,乳腺癌额外增加的例数也成比例变化。
美国 WHI 研究 - 接受 HRT 治疗 5 年的额外乳腺癌风险
- 年龄范围:50–79 岁
- 使用安慰剂治疗 5 年 1,000 例女性的乳腺癌发生例数
- 雌激素 单药治疗(CEE):21 例
- 雌激素—孕激素联合治疗(CEE + MPA)#:17 例
- 相对风险(95% 可信区间)
- 雌激素 单药治疗(CEE):0.8 (0.7 – 1.0)
- 雌激素—孕激素联合治疗(CEE + MPA)#:1.2 (1.0 + 1.5)
- 使用 HRT 治疗 5 年每 1,000 例女性相比安慰剂人群乳腺癌发生例数的额外增加数(95% CI)
- 雌激素 单药治疗(CEE):-4 (-6 – 0) *
- 雌激素—孕激素联合治疗(CEE + MPA)#:+4 (0 – 9) *
* WHI 在子宫切除女性患者中进行,该研究表明乳腺癌风险并未增加。
# 当分析仅限于研究开始前未使用 HRT 的女性患者时,治疗 5 年内风险似乎并未增加。5 年后,风险高于未经治疗女性。
子宫内膜癌
具有完整子宫的绝经后女性
在未使用 HRT 具有完整子宫的女性患者中,每 1000 例中有 5 例被诊断为子宫内膜癌。在未进行子宫切除的女性患者中,不建议接受雌二醇单药治疗,因为雌二醇可增加子宫内膜癌风险(参见 注意事项)。
根据雌二醇单药治疗持续时间和雌二醇剂量,流行病学研究中年龄介于 50 岁至 65 岁的患者,每 1000 例中有 5 至 55 例额外病例子宫内膜癌风险增加。
每个周期至少 12 天将孕激素加入到雌二醇单药治疗中可预防风险增加。在百万女性研究中,使用联合(序列或连续)HRT 治疗 5 年并未增加子宫内膜癌风险(相对风险率为 1.0,95% 可信区间:0.8 - 1.2)。
卵巢癌风险
使用雌二醇单药治疗或雌二醇联合孕激素补充治疗与卵巢癌诊断风险增加相关(参见 注意事项)。
52 项流行病学研究荟萃分析报告相对于未使用 HRT 的女性患者,目前正在接受 HRT 治疗女性患者的卵巢癌风险增加(相对风险率 1.43,95% 可信区间 1.31 - 1.56)。
在年龄介于 50 和 54 岁之间使用 HRT 治疗 5 年的女性患者中,在 2000 例患者中有 1 例额外病例。
在年龄介于 50 和 54 岁之间未接受 HRT 治疗的女性患者中,在 5 年内每 2000 例患者中有 2 例诊断为卵巢癌。
静脉血栓栓塞
静脉血栓栓塞(VTE)风险增加 1.3–3 倍,例如:在接受 HRT 治疗的患者中,腿部或骨盆深静脉血栓形成或肺栓塞增加。与随后几年相比,在治疗的第一年更可能发生此类事件(参见 注意事项)。
WHI 研究关于静脉血栓栓塞的研究结果如下:
WHI 研究 - HRT 治疗 5 年后 VTE 额外风险
| 疗法 | 年龄范围(岁) | 5 年内安慰剂组每 1000 例 女性患者中的发生率 | 相对风险(95%可信区间) | 接受 HRT 治疗 5 年后 1000 例患者中的额外病例 |
|---|---|---|---|---|
| 口服雌二醇单药治疗* | 50–59 | 7 | 1.2 (0.6–2.4) | 1 (-3 – 10) |
| 雌二醇—孕激素口服联合治疗 | 50–59 | 4 | 2.3 (1.2–4.3) | 5 (1 – 13) |
* 在进行子宫切除的女性患者中进行研究
冠心病
在年龄超过 60 岁接受雌二醇—孕激素联合治疗 的患者中,冠心病的风险略微增加(参见 注意事项)。
卒中
在接受雌二醇单药治疗或雌二醇—孕激素联合治疗的患者中,缺血性卒中风险增加 1.5 倍。接受 HRT 治疗患者的出血性卒中风险并未增加。该相对风险与年龄和使用持续时间相关。
由于基线风险具有较高的年龄依赖性,使用 HRT 女性患者的总体风险随年龄增加(参见 注意事项)。
WHI 研究 - HRT 治疗 5 年后缺血性卒中额外风险 *
- 年龄范围:50 – 59 岁
- 5 年内安慰剂组每 1,000 例女性患者中的发生率:8
- 相对风险(95% CI):1.3 (1.1 – 1.6)
- 接受 HRT 治疗 5 年后 1,000 例患者中的额外病例:3 (1 – 5)
* 未对缺血性和出血性卒中进行区分。
肝脏肿瘤
在罕见情况下,使用类固醇激素类药物,例如戊酸雌二醇片后观察到良性肝脏肿瘤,甚至具有更罕见的恶性肝脏肿瘤报告,在散发病例中,这些肿瘤可导致致死性腹腔内出血。如果患者出现重度上腹痛、肝脏增大或腹腔内出血的迹象,鉴别诊断时应考虑肝脏肿瘤。
其它不良反应
雌二醇单药治疗中还报告了以下不良反应:
- 糖耐量改变
- 心情改变
- 高血压
- 静脉曲张加重或炎症
- 胃气胀
- 腹泻
- 肝功能不全
- 念珠菌性阴道炎
- 宫颈分泌物过多
- 宫颈糜烂
- 子宫肌瘤生长
- 乳房分泌物
- 鼻出血
在出现遗传性血管性水肿的女性中,外源性雌二醇可导致或加重血管性水肿的症状(参见 注意事项)。
其他与雌二醇/孕激素治疗相关的不良反应:
- 胆囊疾病;
- 年龄超过 65 岁女性患者的疑似痴呆(参见 注意事项)。
禁忌
下面所列的任何一种情况存在时,不应开始激素替代治疗(HRT)。如果在 HRT 用药过程中出现下列任何一种情况,应立即停药。
- 妊娠和哺乳
- 未确诊的阴道出血
- 已知或可疑乳腺癌
- 己知或可疑受性激素影响的癌前病变或恶性肿瘤
- 现有或既往有肝脏肿瘤病史(良性或恶性)
- 重度肝脏疾病
- 急性动脉血栓栓塞(如心肌梗死,中风)
- 活动性深静脉血栓形成,血栓栓塞性疾病,或有记录的这些疾病的病史
- 静脉或动脉血栓高危因素
- 重度高甘油三酯血症
- 对活性成份或任何辅料过敏
注意事项
HRT 仅用于治疗严重影响生活质量的绝经后症状。
在所有病例中,至少每年应慎重考虑 1 次相对风险和收益。只有在收益大于风险时,才应继续进行 HRT 治疗。
关于过早绝经 HRT 风险的可用数据有限。虽然在年轻女性患者中的相对风险较低,但相对于老年女性患者而言,年轻女性患者的收益—风险关系可能更有利。
医学检查/检查
在开始或恢复激素补充治疗前,必须采集患者完整的个人病史和家族史。应根据这些医学史以及该药物的禁忌症和使用警告进行体检(包括盆腔和乳房)。建议在治疗期间进行定期检查。
必须根据女性患者的风险状态确定检查频率和类型。
必须告知女性患者,出现哪些乳房改变时必须报告医师或护士(参见下文的“乳腺癌”)。应根据现行常规临床实践和个体患者临床需要进行乳腺 X 线等影像学检查。
如果患者有泌乳素腺瘤,则需要进行密切医疗监督(包括定期测量催乳素水平)。
需要进行监测的情況
如果目前存在或既往存在以下状况或疾病之一或在妊娠期间或既往激素治疗期间加重,则应对患者进行密切监测。
如果在戊酸雌二醇片激素补充治疗期间,下列状况或疾病之一发生或加重,则上文所述也适用:
- 平滑肌瘤(子宫肌瘤)或子宫内膜异位症
- 血栓栓塞危险因素(参见下文)
- 雌二醇依赖性肿瘤的危险因素,例如一级亲属患有乳腺癌
- 高血压
- 肝脏疾病
- 糖尿病伴或不伴血管损害
- 胆石症
- 偏头痛或(严重)头痛
- 系统性红斑狼疮(SLE)
- 子宫内膜增生病史(参见下文)
- 癫痫
- 哮喘
- 耳硬化
- 纤维囊性乳腺疾病
- 慢性特发性黄疸 (Dubin-Johnson 综合征和 Rotor 综合征)
- 镰状细胞性贫血
- 妊娠特发性黄疸和妊娠期间重度瘙痒病史
- 病态肥胖症
- 小舞蹈病
立即停止治疗的原因
如果患者有禁忌症或出现以下状况,应立即停止治疗:
- 黄疸或肝功能恶化
- 严重的血压升高
- 新发的偏头痛型头痛
- 急性视觉障碍或其他损伤
- 妊娠。
子宫内膜增生和癌症
在具有完整子宫的女性患者中,当长期进行雌二醇单药治疗后,子宫内膜增生和子宫内膜癌的风险增加。根据用药持续时间和雌二醇的剂量水平,使用雌二醇单药治疗女性患者子宫内膜癌的增加风险是不接受 HRT 治疗女性患者的 2 至 12 倍(参见 不良反应)。停止治疗后,至少在 10 年内风险仍然很高。
在子宫完整的女性患者中,每个月或每 28 天至少 12 天接受额外孕激素周期性给药或连续进行雌二醇—孕激素联合治疗弥补了雌二醇单药治疗相关的子宫内膜病变的风险。
对于口服超过 2 mg 雌二醇或超过 0.625 mg 结合型雌二醇或接受雌二醇贴剂活性成分释放超过 50 μg/天的患者,其子宫内膜安全性尚未得到证实。
在治疗的前几个月,患者可出现突破性出血和点滴状出血。如果在治疗期间出现此类出血和/或在治疗结束后持续出血,应确定出血原因,包括进行子宫内膜组织活检以排除子宫内膜病变。
无对抗雌二醇刺激可导致癌前病变或子宫内膜异位症残留灶出现恶性转化。因此,在因子宫内膜异位症接受子宫切除术以及有残留子宫内膜异位症的患者中,建议在雌二醇补充疗法中添加孕激素。
乳腺癌
有研究结果表明,接受雌二醇—孕激素联合使用 HRT 或仅接受雌二醇制剂 HRT 的女性患者,其罹患乳腺癌的总体风险增加(风险取决于接受 HRT 的时长)。
雌二醇—孕激素联合治疗
- 作为随机化、安慰剂对照研究的一部分,女性健康主观研究(WHI 研究)和前膽性流行病学研究的的荟萃分析中均发现在接受雌二醇—孕激素联合治疗 HRT 的患者中,其罹患乳腺癌的风险增加。约 3(1–4)年后风险增加显著(参见 不良反应)。
雌二醇单药治疗
- WHI 研究表明在接受雌二醇单药治疗的子宫切除术患者中罹患乳腺癌的风险未增加。观察性研究通常发现,在接受雌二醇单药治疗的女性患者中,其诊断为乳腺癌的风险略微增加,但低于接受雌二醇—孕激素联合治疗的风险(参见 不良反应)。
- 一项大型荟萃分析的结果表明,治疗结束后风险随时间降低,恢复至该年龄相关的基线期正常风险所需的时间取决于既往接受 HRT 的时长。当接受 HRT 超过 5 年时,风险可能会持续 10 年或更长时间。
HRT,尤其是雌二醇和孕激素联合治疗,导致乳房 X 线检查中乳腺密度增加,这可能会对乳腺癌影像学诊断产生不利影响。
卵巢癌风险
卵巢癌比乳腺癌更罕见。大型荟萃分析流行病学研究结果表明,在使用雌激素制剂单药治疗或接受雌二醇—孕激素制剂联合治疗 HRT 的女性患者中,卵巢癌风险略微增加,在接受治疗后 5 年内风险增加显著,但在治疗结束后风险随时间降低。
包括 WHI 研究在内的其他一些研究表明,当使用联合 HRT 时,同等风险相当或略低(参见 不良反应)。
静脉血栓栓塞
- HRT 与静脉血栓栓塞(VTE)风险增加 1.3 至 3 倍相关,尤其是深静脉血栓形成和肺栓塞。相对于后续治疗而言,在接受 HRT 治疗的第一年内更可能发生 VTE(参见不良反应)。
- 已知具有易栓症的患者罹患 VTE 的风险增加。HRT 可增加此类风险,因此 VTE 患者禁用。
- 静脉血栓栓塞的一般危险因素包括雌二醇的使用、年老、大手术、长期固定、严重超重(BMI > 30kg/m2)、妊娠/产后期间、系统性红斑狼疮(SLE)和癌症。尚未对静脉曲张在静脉血栓栓塞中可能的作用达成一致。
- 与所有术后患者相似,必须考虑术后预防措施。如果选择性手术后建议延长制动时间,则建议在术前停用激素补充治疗 4 至 6 周。在女性患者完全恢复活动前,不应恢复治疗。
- 考虑对无个人 VTE 病史但一级亲属在较低年龄出现 VTE 病史的女性患者进行易栓症筛查。应在筛查前告知患者该程序并不是确定性的(仅确定导致易栓症的部分缺陷)。如果检测到血栓形成性缺陷且在患者亲属中已知具有血栓形成,或者检测到重度缺陷(例如抗凝血酶,蛋白 S 和/或蛋白 C 缺陷或联合缺陷),则禁用 HRT。
- 对于长期接受抗凝剂治疗的患者,应在使用 HRT 之前慎重考虑风险—收益关系。
- 如果在启动激素补充治疗之后静脉血栓栓塞进展,则必须停药。如果患者出现血栓栓塞的可能症状(尤其是腿部痛性肿胀、突发性胸痛、呼吸急促),必须立即联系医生。
冠心病
- 随机化对照研究无证据表明 HRT 联合雌二醇和孕激素或雌二醇单药治疗能防止女性患者出现心肌梗死,而与该类患者是否具有冠心病无关。
雄二醇-孕激素联合治疗:
接受 HRT 联合雌二醇和孕激素治疗的患者,其罹患冠心病的相对风险略微增加。因为冠心病的基线风险在很大程度上与年龄相关,在健康绝经前女性患者中,由 HRT 联合雌二醇和孕激素治疗导致的额外病例数量很少。病例数量随年龄增加。
雄二醇单药治疗:
随机对照研究并未表明在进行子宫切除术的患者中,接受雌二醇单药治疗导致其冠心病风险增加。
卒中
雌二醇和孕激素联合治疗以及雌二醇单药治疗与卒中风险增加至 1.5 倍相关。
相对风险与绝经年龄和绝经时间无关。但是由于卒中基本风险的年龄依赖性高,因此接受 HRT 治疗女性患者的整体卒中风险随年龄增加(参见 不良反应)。
其他疾病
雌激素可导致液体潴留;因此,心功能或肾功能不全患者必须接受密切监测。由于认为戊酸雌二醇片活性成分的血浆浓度升高,因此必须对终末肾功能衰竭患者进行密切监测。
已患有高甘油三酯血症的女性在接受雌二醇单药治疗或雌二醇—孕激素补充治疗期间必须接受密切监测,因为据报告在雌二醇治疗期间出现血浆甘油三酯显著升高导致胰腺炎的病例。
雌二醇可增加甲状腺素结合球蛋白(TBG)的浓度,从而导致总循环甲状腺激素水平升高,根据蛋白结合碘(PBI)水平、T4 水平(使用柱分离法或放射免疫分析法)或 T3 水平(放射免疫分析法)进行测定。T3 树脂摄取量下降,反映了 TBG 水平升高。游离 T3 和 T4 浓度未发生变化。
其他结合蛋白,例如肾上腺皮质激素结合球蛋白(CBG)和性激素结合球蛋白(SHBG)的血清水平可能升高,可导致循环皮质激素/性激素水平升高。游离或生物学活性激素浓度保持不变。
其他血浆蛋白水平可能升高(血管紧张素原/肾素底物、α1-抗胰蛋白酶、血浆铜蓝蛋白)。
HRT 无法改善认知能力。有证据表明在年龄超过 65 岁,持续接受联合治疗或雌二醇单药治疗 HRT 的女性患者中,可疑痴呆风险增加。
在出现遗传性血管性水肿的女性中,外源性雌二醇可导致或加重血管性水肿的症状。
戊酸雌二醇片不可用作避孕药且不能预防 HIV。
该药品含有乳糖水合物和蔗糖。具有罕见遗传性半乳糖或果糖不耐受、乳糖酶缺乏症、葡萄糖-半乳糖吸收障碍或蔗糖-异麦芽糖酶缺乏症患者不得服用戊酸雌二醇片。
儿科患者群体
戊酸雌二醇片不适于儿童和青少年使用。
对驾驶和机械操作能力的影响
未进行关于对驾驶和机械操作能力影响的研究。
在使用戊酸雌二醇片的患者中观察到未对驾驶和机械操作能力产生影响。
孕妇及哺乳期妇女用药
戊酸雌二醇不能用于妊娠及哺乳期妇女。如果在戊酸雌二醇治疗期间怀孕,应立即停止治疗。
甾体激素用于避孕和激素替代治疗的大规模流行病学研究显示,妊娠前使用这类激素的妇女,其新生儿出生缺陷的风险没有增加,妊娠早期意外服用这些药物也没有致畸作用。
少量性激素可以在人体乳汁中分泌。
儿童用药
戊酸雌二醇片不用于儿童和青少年。
老年用药
没有数据显示对于老年患者需要调整剂量。
65 岁及 65 岁以上妇女应用请参见 注意事项。
药物相互作用
注意:应参考任何规定联合药物的药品说明书以确定其潜在相互作用。
其他药物对戊酸雌二醇的影响
可增加性激素清除率的药物成分(通过酶诱导降低疗效),例如:
联合使用可代谢药物,尤其是细胞色素酶 P450 可增加雌二醇(和孕激素)的代谢。这些药物成分包括抗惊厥药物(例如:巴比妥类药物、苯妥英,扑米酮、卡马西平)和抗感染药(例如:利福平、利福布汀、奈韦拉平、依法韦仑),也可能含有非尔氨脂、灰黄霉素、奥卡西平、托吡酯和含圣约翰草的草药补救治疗。
在临床上,雌二醇代谢增加可导致激素活性减退以及子宫出血特征改变。
仅在治疗几天后可观察到酶诱导。通常可在几周内观察到最大酶诱导。治疗停止后,酶诱导可持续长达 4 周。
对性激素清除率具有不同影响的药物成分:
HIV-蛋白酶抑制剂与非核苷逆转录酶抑制剂(包括与 HCV 抑制剂联合)的多种组合可在与性激素联合给药时增加或降低血浆雌二醇浓度。在某些病例中,这些变化的有效效应可能具有临床意义。
因此,应参考任何联合处方 HIV/HCV 药物的药品说明书,以便确定潜在的相互作用和相关建议。
降低性激素清除率的药物成分(酶抑制剂):
强效和中度 CYP3A4 抑制剂,例如:唑类抗真菌剂(例如氟康唑、伊曲康唑、酮康唑、伏立康唑)、戊脉安、大环内酯类药物(例如:克拉霉素、红霉素)、地尔硫卓和葡萄柚汁可增加雌二醇的血药浓度。
雌二醇可增强丙咪嗪的效应和副作用。
联合使用环孢菌素可导致环孢菌素、肌酐和转录酶的血浓度升高,原因是环孢菌素的肝脏清除作用减弱。
联合服用活性炭和/或抗生素,例如氨苄西林或四环素后,可观察到肠道菌群改变导致药物浓度下降,可能导致戊酸雌二醇片的疗效减退。因此,报告了月经期间出血率增加。
通过胃肠道期间可发生较大程度结合的其他药物,例如:对乙酰氨基酚可在很大程度上与雌二醇结合作用发生竞争,从而增加雌二醇的利用度。
由于雌二醇对于糖耐量和胰岛素应答产生影响,因此口服降糖药或胰岛素治疗的必要性和剂量可能发生变化。
其他相互作用形式
实验室检查 :
使用性激素可能会影响某些实验室检查结果,包括肝脏、甲状腺、肾上腺和肾脏功能生化指标,(载体)蛋白血浆水平,例如:皮质类固醇结合球蛋白和脂质/脂蛋白组分、碳水化合物代谢参数,凝血和纤维蛋白溶解参数。参数变化通常保持在正常的实验室范围内。
药物过量
用药过量可能导致一些女性患者出现恶心和呕吐症状。不存在特效抗毒剂,应对症治疗。
药理毒理
药效学特性
药物治疗组:天然和半合成雌激素,单方制剂
ATC 代码:GO3CA03
戊酸雌二醇片含有雌激素戊酸雌二醇,是人体天然雌激素 17β-雌二醇的前体。
使用戊酸雌二醇片期间不会抑制排卵,也基本不影响内源性激素的生成。
更年期时,卵巢雌二醇分泌的减少及最终消失,导致体温调节的不稳定,引起伴随睡眠障碍及多汗的潮热,以及伴有阴道干燥,性交困难和尿失禁症状的泌尿生殖道萎缩。经常提到的但特异性较低的部分更年期综合征症状为诸如心绞痛主诉、心悸、易怒、神经质、乏力、注意力不能集中、健忘、性欲丧失和关节肌肉疼痛等。激素替代治疗(HRT)可以减轻绝经妇女的许多雌激素缺乏的症状。
采用适量的雌激素的 HRT,如戊酸雌二醇片,可以减少骨吸收,延缓或阻止绝经后的骨丢失。当 HRT 中止时,骨量降低的速度与刚绝经时相仿。无证据提示 HRT 使骨量恢复到绝经前的水平。HRT 对皮肤胶原含量及皮肤厚度也有积极的作用,并能延迟皮肤皱纹的发展。
HRT 改变了脂质谱。它降低了总胆固醇和低密度脂蛋白胆固醇,并且可以增加高密度脂蛋白胆固醇及甘油三酯的水平。这种代谢效应在某种程度上可以被加入的孕激素抵消。
对于有完整子宫的妇女,推荐在一个雌激素替代方案中,如戊酸雌二醇片,加用一种孕激素,每周期至少 10 天。这可减少这些妇女子宫内膜增生的危险及伴随的腺癌危险。尚未显示在一个雌激素替代方案中加用一种孕激素会干扰雌激素对已批准的适应症的疗效。
观察性研究和妇女健康倡议(WHI)研究表明:
在使用结合马雌激素联合醋酸甲羟孕酮(MPA)进行 HRT 治疗的绝经后妇女中,结肠癌发病率降低。单独使用结合马雌激素的妇女健康倡议(WHI)研究中,未观察到类似的风险降低。尚不知道其他的 HRT 产品是否有类似的发现。
临床前安全性资料
雌二醇的毒理特征已为人所熟知。除了已经包含在其它部分的资料外,目前不再有可提供给处方医师的临床前资料。
- 致癌性:
重复给药的毒理学研究,包括致肿瘤性的研究结果没有显示与人类使用相关的特殊风险。然而,必须牢记性激素能够促进一些激素依赖性组织和肿瘤的生长。 - 胚胎毒性/致畸性:
戊酸雌二醇的生殖毒理学研究没有提示潜在的致畸性。由于戊酸雌二醇的使用不会造成非生理性的戊酸雌二醇血浆浓度,因此该制剂未显示对于胎儿有风险。\ - 致突变性:
关于 17β-雌二醇的体外和体内研究没有提示致突变的潜在性。
药代动力学
吸收
戊酸雌二醇吸收迅速而且完全。在吸收和首次通过肝脏的过程中,类固醇酯分解为雌二醇和戊酸。同时,雌二醇进一步代谢为雌酮、雌三醇和硫酸雌酮。
口服戊酸雌二醇后,只有约 3% 的雌二醇得到生物利用。食物不影响雌二醇的生物利用度。
分布
服药后通常 4 – 9 小时达到雌二醇的最高血清浓度,约为 15 pg/ml。服药后 24 小时内血清雌二醇浓度下降至约 8 pg/ml。
雌二醇与白蛋白和性激素结合球蛋白(SHBG)结合。血清中未结合的雌二醇约为 1 – 1.5%,与 SHBG 结合的部分为 30 – 40%。
雌二醇在单次静脉给药后的表观分布容积约为 1 L/kg。
代谢
外源性给予戊酸雌二醇的酯分解后,药物的代谢遵循内源性雌二醇的生物转化途径。雌二醇主要在肝脏代谢,但也在肝外,如肠道、肾、骨骼肌及靶器宫代谢。这些过程包括雌酮、雌三醇、儿茶酚雌激素及这些化合物的硫酸盐、葡萄糖醛酸化物轭合物的形成,这些物质的雌激素活性明显降低,或甚至无雌激素活性。
清除
单次静脉内给药后,雌二醇的总血清清除率显示高度的变异性,范围在 10–30 ml/min/kg。
一定量的雌二醇代谢产物可以分泌到胆汁中,进入所谓的肝肠循环。
最终的雌二醇代谢产物主要以硫酸盐及葡萄糖醛酸化物的形式从尿液中排出。
稳态情况
多次给药后观察到,血清雌二醇水平较单次剂量时约高 2 倍。雌二醇浓度的平均值在 15 pg/ml(最低水平)– 30 pg/ml(最高水平)之间。
雌酮作为一个低雌激素活性的代谢产物,血清浓度约升高 8 倍。硫酸雌酮浓度约升高 150 倍。
停用戊酸雌二醇片后 2–3 天内,雌二醇、雌酮浓度恢复到治疗前的水平。
贮藏
30 °C 以下保存。
妥善贮藏所有药物,勿使儿童触及。
包装
铝箔和聚氯乙烯透明膜组成的水泡眼包装(边缘热封)。
21 片/盒。
有效期
60 个月(5 年)
执行标准
进口药品注册标准 JX20100066
批准文号
进口药品注册证号:H20160679
药品批准文号:国药准字 J20171038
药品上市许可持有人
名称:Jenapharm GmbH & Co. KG
地址:Otto-Schott-Strasse 15 07745 Jena, Germany
生产企业
- 企业名称:DELPHARM Lille S.A.S.
- 生产地址:Parc d’Activités Roubaix-Est 22, rue de Toufflers CS 50070
59452 Lys-Lez-Lannoy Cedex, France - 电话:+3 33 20208211
- 传真:+3 33 20208611
分包装企业
企业名称:拜耳医药保健有限公司广州分公司
生产地址:中国广州市经济技术开发区友谊路 103 号
邮政编码:510730
电话:+86 20 37185114
传真:+86 20 82214681
热线:400-810-0360