譯者按
- ⚠ 免責宣告:本文不構成任何醫療、處方建議。如有醫療需要,應於專業醫師指導下進行。
- 因譯者能力所限,部分術語之翻譯或有紕漏,煩請指正。
摘要
外生殖器皮膚(如陰囊、陰莖和陰唇皮膚)的吸收能力似乎要強於其它皮膚區域。人們通常會將雌二醇、睪酮等透皮激素製劑應用於手臂、臀部和腹部等區域;不過對於外生殖器給藥卻鮮有研究。
通常 100 μg/天劑量的雌二醇透皮貼片可引起平均約 100 pg/ml 的雌二醇水平。在阿根廷,有一項關於前列腺癌患者透過陰囊使用雌二醇貼片的臨床研究發現,陰囊給藥所提供的雌二醇水平比前臂給藥高得多;在此 100 μg/天劑量的雌二醇透皮貼片能引起平均 500 pg/ml 的雌二醇水平。這與以下認知一致:陰囊給藥的效率是常規皮膚部位的 5 倍。
至於雌二醇透皮凝膠用於外生殖器的用法,至今尚未有文獻評估;但有關睪酮凝膠與乳劑用於陰囊的研究已發現,相比於常規皮膚部位,陰囊給藥引起的睪酮水平要高出 5-8 倍。由於雌二醇與睪酮的化學性質相似,且透過陰囊給予的雌二醇貼片同樣可達到高雌二醇水平,故這項發現應該可推導至雌二醇凝膠。
對於女性化激素治療,外生殖器對雌二醇的高吸收率也許大有可為。如果女性傾向跨性別者透過透皮給藥並不能達到理想的雌二醇水平,需要更高水平(例如在高劑量雌激素單藥療法當中)來抑制睪酮;那麼可改為外生殖器給藥。
前言
雌二醇可透過多種形式與途徑給藥(維基百科)。其中一種途徑是透皮給藥,其形式包括雌二醇貼片、凝膠、乳劑與噴霧劑;不過,貼片與凝膠是迄今使用最多的。傳統上,透皮雌二醇會被應用於手臂、腹部等皮膚部位。
每塊 100 μg/天的雌二醇貼片通常可引起 50-100 pg/mL 左右的雌二醇水平;而每 3 mg/天的雌二醇凝膠引起的水平通常約為 100 pg/mL(Aly, 2020; 維基百科)。不過,雌二醇水平在個體間差別顯著(維基百科);在透皮雌二醇的形式與劑量相同的情況下,某些人會有偏高或者偏低的雌二醇水平。對一部分人而言,其雌二醇水平可能低得不足以產生理想的療效,對睪酮的抑制作用也不充分;如使用高劑量透皮雌二醇單藥療法,其也很難獲得抑制睪酮所需的高雌二醇水平。
1960 年代,一篇有關氫化可的松用於人皮膚不同部位的透皮吸收率的臨床研究論文公開發表(Feldmann & Maibach, 1967; 相關材料)。(需要指出,氫化可的松——也稱皮質醇——作為一種甾體激素,在結構上與雌二醇、睪酮等性激素很相似。)此研究將氫化可的松用放射性同位素標記,並將其溶液塗抹於男性的不同皮膚部位,然後對用藥後排出的尿液中的放射性物質(氫化可的松及其代謝物)之含量進行測定(Feldmann & Maibach, 1967)。
研究者發現,尿液的放射性在不同用藥部位之間有很大分別;其中,陰囊給藥後所檢出的放射性遠遠高於前臂及其它部位。不同部位用藥後的尿液放射性係數分別為(以前臂為基準,由高到低)(Feldmann & Maibach, 1967):
- 陰囊(42.0)
- 下頜角(13.0)
- 前額(6.0)
- 腋下(3.6)
- 頭皮(3.5)
- 背部(1.7)
- 前臂(1.0)
- 手掌(0.8)
- 腳踝(0.4)
- 足底(0.1)
這是第一項表明了外生殖器(如陰囊)皮膚的透皮吸收率可顯著高於其它皮膚部位的研究。
從陰囊對氫化可的松及其它藥品吸收更佳的發現,也衍生出了一個問題:雌二醇與睪酮用於外生殖器是否也具有更大的生物利用度。其中睪酮已在 1980 年代被確認有此特性,此後睪酮的陰囊貼片(品牌 Testoderm)得以研發並於 1993 年在美國批准上市(Place et al., 1990; Mazer et al., 1992; Atkinson, Chang, & Snyder, 1998)。
與此相反的是,透皮雌二醇似乎從未被研究用於陰囊;這也許是因為雌激素極少用於男性。不過,最近筆者偶然發現了這篇很晦澀的、關於患前列腺癌的男性在高劑量雌激素療法當中透過陰囊使用雌二醇透皮貼片的研究論文:
- Premoli, F., Re, I., Asenjo, G., Maximino, G., & Micheletti, L. (2005). Tratamiento del Cáncer de Próstata Avanzado con Estrógenos Transdérmicos Escrotales (ETE). [陰囊給藥的透皮雌激素貼片(TSEP)在晚期前列腺癌治療當中的應用] Revista Argentina de Urología, 70(4), 231–241. [Google 學術] [網址] [PDF 文件] [英譯文]
這應該是第一項、也是迄今唯一一項調研陰囊給藥的透皮雌二醇的研究。其論文並非以英語撰寫,因此早前的文獻檢索並未發現之。
在討論該研究的結果之前,下文將會介紹關於陰囊給藥的透皮雌二醇的一些背景和原理。
如讀者對研究結果更感興趣,可跳轉到“研究結果”一章。
背景
高劑量的雌激素有很強的抗雄性素效力,因此常作為一種雄激素匱乏療法,用於男性前列腺癌的治療。具體而言,雌激素可透過其抗促性腺激素作用來抑制性腺睪酮的產生;同時,還可增加性激素結合球蛋白 (SHBG) 的產生和血清水平,以降低遊離(即具備生物活性)的雄激素之比例。大劑量雌激素療法的抗雄效力,與性腺切除術和促性腺激素釋放激素 (GnRH) 促效劑、拮抗劑相當,不過其具有獨特的優缺點。
雌激素療法的優點包括減少潮熱、保持骨密度、保留部分性慾、改善生活質量、以及低得多的成本。其缺點包括女性化、男性乳房發育症(對順性別男性來說乳房發育當然是不受歡迎的)、以及心血管毒性。
相比於口服或非生物同質性雌激素(如己烯雌酚、炔雌醇和結合雌激素),使用非腸胃途徑、具生物同質性的雌二醇是更好的選擇——例如注射用雌二醇酯和透皮雌二醇。這是因為後者的心血管毒性傾向要低得多(Aly,2020)。
注射雌二醇酯可以有效對抗前列腺癌,但傳統上用於治療的長效雌二醇酯(如聚磷酸雌二醇與十一酸雌二醇)皆已停產。至於戊酸雌二醇、環戊丙酸雌二醇等短效雌二醇酯,儘管可作為替代,但其注射頻率更頻繁(例如每週注射一次),而且在全球多個地區的供應有限。此外,注射過程並不方便,且可能引起部分患者的痛苦和焦慮。
透皮雌二醇貼片也較有效,但通常需要 3-4 個 100 μg/天的貼片才能完全抑制睪酮水平(Ockrim, Lalani, & Abel, 2006; Langley et al., 2008; Langley et al., 2021)。同時使用多個貼片不僅可能帶來不適,而且開銷會很大。
透皮雌二醇凝膠也曾被用於治療前列腺癌,但其所需劑量很高(≥6 mg/天);並且即使如此,也只能有限地提高雌二醇水平,對睪酮的抑制也不完全(Aly, 2019)。
透皮藥劑可經皮膚滲透吸收。不同皮膚部位的吸收能力有異。早在數十年前,人們便已認識到,陰囊皮膚對藥劑的吸收能力遠高於其它絕大多數部位(Feldmann & Maibach, 1967 [相關材料]; 維基百科)。這裡需要指出,最早用於醫療用途的透皮睪酮貼片,是陰囊貼片;這是因為男性所需的睪酮不少。此後,非陰囊給藥的睪酮貼片才得以推出,而且為提供基本等量的睪酮,其尺寸必須變得更大(Behre & Nieschlag, 2012; Khera, 2013)。
綜上,考慮到雌二醇在結構上近似於睪酮,可以認為透皮雌二醇製劑用於陰囊時也有遠高於常規部位的吸收率。
說回上文“前言”一章提及的 Premoli 等人 (2005) 的研究:其對在前列腺癌治療中透過陰囊使用單個透皮雌二醇貼片的狀況進行了評估。研究者均來自阿根廷;在這個貧困率很高的國家,大部分人口無力承擔高昂的藥費。因此,除了雌激素療法相對於常規抗雄性素療法的優勢以外,經濟方面的因素也成為他們研究的動機之一。
他們的基本目標是:為了能夠完全抑制睪酮水平、並治療前列腺癌,透過非腸胃給藥、毒性更小的途徑來達到較高的雌二醇水平,同時維持較小的開銷、和較好的便利性。除了治療前列腺癌之外,這與許多女性傾向跨性別者的治療目標非常相似。因此,這種療法或許對女性化激素治療也很有價值。
許多女性傾向跨性別者會為了達到更高的雌二醇水平並抑制睪酮,而選擇將口服雌二醇錠劑用於舌下含服。不過,舌下含服存在一些缺點,例如作用時間短、雌二醇水平波動大;同時還有一部分雌二醇會在肝臟內過度暴露,從而可能引起更高的健康風險(如血栓與心血管問題)(Sam,2021;維基百科)。
因此,如果有一種替代選項能夠引起更穩定、持久的雌二醇水平,其應該會很受歡迎。
研究結果
Premoli 等人 (2005) 首先對兩名患前列腺癌的男性進行了交叉型概念驗證預實驗,以評估陰囊對透皮雌二醇的吸收是否優於非陰囊部位。其中一名患者先以前臂使用 50 μg/天的雌二醇貼片,然後再以陰囊給藥;另一名患者同樣先以前臂、再以陰囊給藥,不過使用的是 100 μg/天的雌二醇貼片。
研究者發現,陰囊給藥後的最大雌二醇水平遠高於前臂:
表 1: 在上述預實驗中,前臂、陰囊給予雌二醇貼片之後的雌二醇水平:
| 患者 | 雌二醇貼錠劑量 | 給藥部位 | 最大雌二醇水平 | 差異 |
|---|---|---|---|---|
| 患者甲 | 50 μg/天 | 前臂 | 55 pg/mL | – |
| 陰囊 | 200 pg/mL | 3.6 倍 | ||
| 患者乙 | 100 μg/天 | 前臂 | 180 pg/mL | – |
| 陰囊 | 500 pg/mL | 2.8 倍 |
下圖將這項微型初期預實驗的全過程結果視覺化(受試者 2 人,交叉對照):
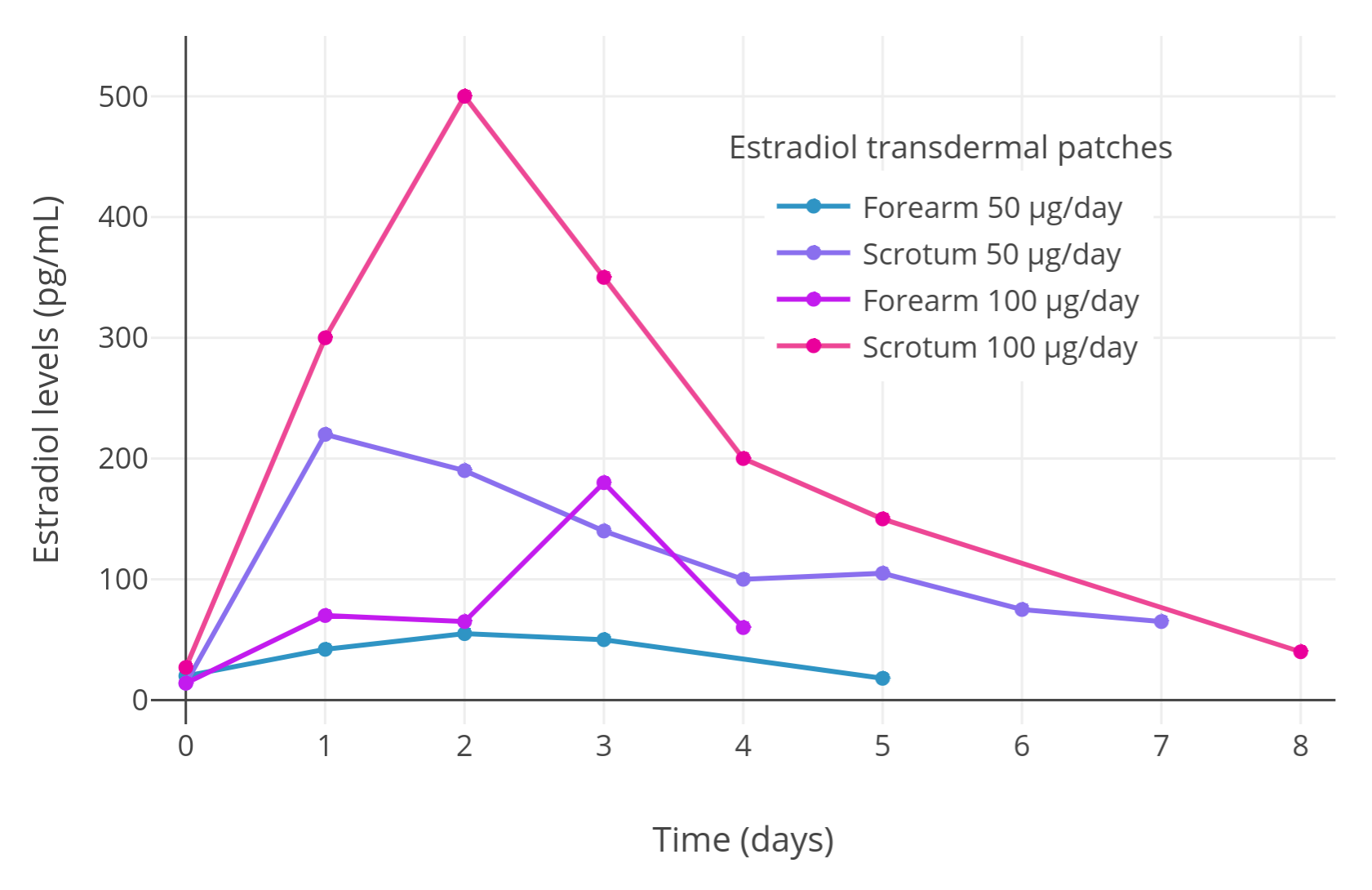
圖 1:
在交叉對照中,兩名男性前列腺癌患者以陰囊給予透皮雌二醇貼片所引起的雌二醇水平(Premoli et al., 2005)。
在本項初期預實驗之後,研究者對 35 名男性前列腺癌患者以陰囊持續給予 100 μg/天的雌二醇透皮貼片,其觀測到的平均雌二醇水平約為 500 pg/mL (Premoli et al., 2005)。
這項微型預實驗結束之後,Premoli 等人展開了完整的研究,其中包括 35 名前列腺癌患者;每位患者每天經陰囊給予一個 100 μg/天的雌二醇透皮貼片。與預實驗結果相似,所有受試者的平均雌二醇水平達 500 pg/ml 左右,範圍則在 125 - 1,200 pg/mL 左右。範圍幅度之大,恰與透皮途徑的雌二醇在個體間可產生雌二醇水平的巨大差異的認識相吻合(維基百科)。
如透過常規皮膚部位給藥,則單個 100 μg/天 的雌二醇貼片僅可產生平均約 100 pg/mL 的雌二醇水平(維基百科;圖表)。
此外,一項研究顯示,在使用 2-6 劑雌二醇貼片的情況下,平均雌二醇水平也只能達到 200 - 400 pg/mL(圖表;Ockrim, Lalani, & Abel, 2006)。
綜上,如將雌二醇透皮貼片用於陰囊,則其生物利用度應該有非陰囊部位的至少約 5 倍之大。此幅度與將口服雌二醇錠劑用於舌下含服對生物利用度之提升的幅度(約 2-5 倍)相近(維基百科)。
研究中觀察到的雌二醇平均水平(即 500 pg/mL)已知足以強烈抑制性腺睪酮的產生、進而抑制血清睪酮水平;已知不小於 200 pg/mL 的雌二醇水平可將睪酮水平平均抑制 ≥90% (Aly, 2018; 維基百科)。不過遺憾的是,Premoli 及其同行無法獲得大多數受試者的睪酮抑制資料;因為幾乎所有患者早已在研究開始前接受了常規的雄激素匱乏治療(如性腺切除術和 GnRH 調節劑),其初始睪酮水平已很低(平均 28 ng/dL,範圍 10-90 ng/dL)。
無論如何,據研究者所述,仍有兩名患者未事先接受常規的雄激素匱乏治療,其初始睪酮水平仍在男性範圍內;在其接受間歇性治療期間,以陰囊給予雌二醇貼片時的睪酮水平為 10 - 30 ng/dL,停藥時為 200 - 600 ng/dL。這與其它臨床研究預期的高雌二醇水平對睪酮水平的強烈抑制是一致的。
對女性傾向跨性別者的意義
Premoli 等人 (2005) 的發現很重要,因為他們提供的寶貴資訊為在女性化激素治療中提升雌二醇效力的一種新方法作了有力支援。如女性傾向跨性別者尚未接受陰道成形術,可考慮將雌二醇透皮貼片用於陰囊;對於術後人群,則可用於新陰唇。如果透過常規皮膚部位僅可達到很低的雌二醇水平,那麼這種方式應有助於提升雌二醇水平,從而降低貼片用量和成本;或者,用於高劑量雌二醇單藥治療等,以更高的雌二醇水平,起到抑制睪酮的作用。
而且,如將雌二醇水平的穩定性(或許還有使用的便利性)納入考慮,則這種方式應比舌下含服和直腸給藥等其它方案更具優勢。
除貼片之外,凝膠等其它雌二醇透皮製劑用於陰囊時也可大幅提升雌二醇水平。還需要指出,雌二醇凝膠應該無需大面積塗抹;因為根據一項研究的發現,雌二醇凝膠的塗抹面積越小,雌二醇水平就越高(Järvinen et al., 1997; 圖表)。不過,雌二醇凝膠用於陰囊或新陰唇是否更高效尚有待測試和證實;無論如何,如果屬實,其將具有相較於貼片的一項顯著優勢——其僅需每日塗抹一次,而無需時刻往身上貼貼片。
需要指出,有的 100 μg/天雌二醇貼片尺寸很大(表格)。陰囊睪酮貼片曾因尺寸過大、刺激性過強而被停用,因此雌二醇貼片的情況便顯而易見了。不過,低劑量雌二醇貼片(如 50 或 75 μg/天)的尺寸更小(表格),其用於陰囊時,不僅仍有可能引起高雌二醇水平,而且在實用性與耐受性上應優於高劑量貼片。
此外,還有個想法很有意思,即透皮孕酮也有潛在的醫療用途。使用孕酮透皮乳膏之後,可以觀察到非常低但仍然顯著的血清孕酮水平(~ 0.75 ng/mL)(維基百科)。目前尚無任何透皮孕酮製劑被批准用於醫學用途,因為其引起的孕酮水平很低,其臨床效果也不明確。
與雌二醇和睪酮類似,如將透皮孕酮用於陰囊,其可能也會更高效。不過,即使如此,其引起的血清孕酮水平仍將會過低;因此,雖然尚不清楚這是否會讓透皮孕酮具備實質療效,但這也許不大可能。
還有一個問題是:外生殖器皮膚富含 5α-還原酵素——即孕酮的主要代謝酵素。
無論如何,透皮孕酮用於陰囊的途徑仍然非常值得探索。
總而言之,Premoli 等人 (2005) 的研究表明,透皮雌二醇用於陰囊時引起的雌二醇水平,遠高於其它皮膚部位。睪酮在這方面已被證實,但對於雌二醇並無任何公開發表的資料佐證——直至此研究發表。
關於經外生殖器給予雌二醇的附加討論
貼片的大小和選擇
透皮雌二醇貼片的品牌眾多(例如 Climara、Vivelle、Vivelle-Dot 等),其尺寸、劑量(14 - 100 μg/天)和作用時間(每週一用或兩用)也各有不同(表格)。
其中,尺寸範圍從小於十美分硬幣(1.65 cm2)到幾乎接近於通常的咖啡杯底座(44 cm2)不等。差距竟有 25 倍之多!尺寸依劑量也有不同:50 μg/天的貼片有 3.3 - 22 cm2不等的尺寸,而 100 μg/天的貼劑尺寸為 6.6 - 44 cm2 不等。在陰囊上使用非常大的透皮雌二醇貼片顯然很困難,而且不舒適。
前文所載表格連結,可幫助確定適合個人情況的最佳品牌和劑量。當然,貼片本身也可切分。
貼片的切分和貼上
一部分(但並非所有)的雌二醇透皮貼片可以切成更小的尺寸。有的雌二醇貼片非常大,因此如用於外生殖器,切分貼片可能會很有用。詳情見以下文獻摘錄(Matthews et al., 2017; Klein et al., 2018; Norjavaara, Ankarberg-Lindgren, & Kriström, 2016; Rosenfield, Kiess, & Keizer-Schramad, 2006):
矩陣狀的貼片可自粘,每 24 小時釋放約 25 µg 的 17β-雌二醇。由於雌二醇均勻分佈於整個貼片,故可切分貼片以提供所需的劑量。在實際使用時,貼片大多被切成兩份或四份——其它更復雜的切割方式可能不夠精確,且不切實際。未使用的部分貼片可放回原包裝,並置於冰箱內至多一週。貼劑(或貼劑切片)應放置於清潔乾燥的臀部皮膚,如有必要,應使用 Opsite®(透明粘合膜)以確保良好的附著力。[…]
貼片切分後可能更難使用,因為它們可能會脫落,從而需要膠帶支撐。
目前,市售雌二醇貼片當中最低劑量規格為 14 μg/天,而使用最多的低劑量貼片規格為 25 μg/天。有一種方法可減少貼錠劑量,就是將其切為小片。矩陣狀的貼片易於切分,但具有儲層技術的貼片不應切分。切分貼片的缺點是:切片尺寸較小,可能很難使用,而且亦不為產品說明書所推薦。
不過,迄今已有切分貼片的臨床案例,尤其是在斯堪的納維亞——有一個小組在夜間使用貼劑切片(25 微克貼劑四等分後,約等於 6.2 微克甚至更少)來模擬正常的清晨血漿雌二醇峰值;然後撕去貼片,幾小時內即回落到基線。
可使用凝膠和貼片進行透皮給藥;滴定雌二醇血漿水平顯示,貼片切分後給藥更為可靠,並且如要模仿自發性青春期早期的生理節律,只需在早晨將貼劑取下即可停止給藥。 […]
我們目前的建議是,儘可能使用矩陣狀的雌二醇貼片。這種貼劑不僅穩定,而且雌二醇分佈均勻,可按個人需求切分。然而,即使劑量相同,不同品牌的矩陣狀貼劑的尺寸也各有別。貼片面積越大,按目標劑量切分越容易。相比之下,儲層式的貼劑則具有單獨的藥品層,這一層是包含藥品溶液或懸浮液的隔室,由粘合層隔開。切開後,隔室將被破壞並導致藥液洩漏。
目前尚不清楚如何將雌二醇劑量控制在低於 14 μg/天。歐洲生產的矩陣狀貼片可輕鬆切為四片以便夜間提供雌激素;但美國的製造商建議不要這樣做——以我們有限的經驗來看,其會導致血漿雌二醇水平不穩定,這表明這些貼片內的雌二醇並未均勻浸透。
目前幾乎所有市售雌二醇貼片,皆為矩陣狀。唯一的例外是 Estraderm——一種儲層狀貼片;其已停止在美國上市,但在英國尚可一用。
Tegaderm 是一種透明薄膜敷料,可幫助固定貼片(Reddit 帖子)。
陰莖給藥的情況
陰莖皮膚的吸收特性似乎與陰囊皮膚相似,也可提高透皮給藥的吸收率。因此,它可以作為陰囊給予透皮雌二醇的補充或替代方式。有關陰莖給藥的詳情,見以下文獻摘錄(Hairston, Becher, & McVary, 2006):
[…] 必須考慮到區域性陰莖治療所特有的解剖學和生理學問題。在陰莖皮膚和海綿體之間,有幾個解剖/筋膜層;其中,白膜有厚厚的膠原層,故被認為難以穿透。因此,區域性治療試驗主要以龜頭給藥,因為其與海綿體有直接的靜脈連通。
陰莖皮膚本身具有角質層,故相對不透水。角質層的角質細胞與非常緊密的細胞間矩陣狀脂質雙層結合,這使得藥品滲透很有難度。為克服這一障礙,研究者使用滲透促進劑滲透該層併到達皮下。可喜的是,在所有試驗過的解剖部位當中,陰莖和陰囊最為獨特:其角質層的可滲透性最強。有的測試藥物用於這些區域性區域時的吸收率幾乎可達 100%(依其分子結構而定);龜頭的角質層則更易於藥品“突破”。而其它皮膚部位(例如背部和手掌)尤其不透水。
另一個可能擾亂藥品輸送效果的因素是:真皮深層豐富的毛細血管,可能會將藥品“偷到”體迴圈中。
因此,如需要透過更大的皮膚面積使用雌二醇凝膠或貼片,則陰莖皮膚可能是一個很好的選擇。需要指出,大多數已接受陰道成形術(陰莖翻轉法)的女性傾向跨性別者的陰道給藥情況應也與此有關,因為其新陰道的內壁是陰莖皮瓣再造的。然而,尚未有研究表明經新陰道給藥的有效性。
雌二醇凝膠和乳膏用於外生殖器的情況
迄今已有兩項關於男性經陰囊使用睪酮凝膠和乳膏的臨床研究發表:
- Iyer, R., Mok, S. F., Savkovic, S., Turner, L., Fraser, G., Desai, R., Jayadev, V., Conway, A. J., & Handelsman, D. J. (2017). Pharmacokinetics of testosterone cream applied to scrotal skin. [睪酮乳劑用於陰囊皮膚時的藥代動力學] Andrology, 5(4), 725–731. [DOI:10.1111/andr.12357]
- Kuhnert, B., Byrne, M., Simoni, M., Kopcke, W., Gerss, J., Lemmnitz, G., & Nieschlag, E. (2005). Testosterone substitution with a new transdermal, hydroalcoholic gel applied to scrotal or non-scrotal skin: a multicentre trial. [多中心試驗:一種新的透皮水醇凝膠作為睪酮替代品用於陰囊、非陰囊皮膚] European Journal of Endocrinology, 153(2), 317–326. [DOI:10.1530/eje.1.01964]
第一篇論文的相關摘錄如下(其中也簡要描述了第二篇論文的發現):
陰囊皮膚薄、且甾體滲透性高,但關於睪酮用於陰囊皮膚途徑的藥代動力學尚未得到細緻研究。本研究旨在闡明睪酮(乳膏)用於陰囊皮膚時的藥代動力學。本研究是一項單中心、三階段、交叉對照的藥代動力學研究;具體為對性腺完好(eugonadal)的健康志願者先施用癸酸諾龍抑制內源性睪酮,再以隨機順序提供三種不同劑量(12.5、25、50 mg)的睪酮乳膏,每次用藥至少間隔 2 天。
睪酮用於陰囊皮膚時,其生物利用度顯著高於腹部皮膚。本研究使用同種睪酮乳膏,並以液相色譜-質譜聯用法(LC-MS)對甾體激素進行測定;發現經陰囊給藥時只需最低劑量(12.5 mg)即可提供高達 4.6 ng/mL(16.0 nmol/L)的血藥峰值濃度,而經腹部皮膚給藥時需要 100mg 的睪酮乳膏方可使血藥峰值濃度達到 4.7 ng/mL(16.3 nmol/L)。這表明睪酮用於陰囊時的生物利用度,比用於腹部皮膚高出約 8 倍。
一項早前的研究顯示,用於陰囊時,睪酮凝膠的藥代動力學與睪酮貼片相似;也與用於非陰囊部位、5 倍劑量的睪酮凝膠相似——這與透皮睪酮在陰囊的生物利用度高 5 倍相一致(Kuhnert et al., 2005)。
其它一些評估了非陰囊給藥的透皮睪酮的藥代動力學的研究,則觀測到峰值濃度時間 (Tmax)為 6-16 小時不等(Marbury et al., 2003; Miller et al., 2011; Olsson et al., 2014),但峰值濃度(Cmax)與經陰囊給藥時相似(Rolf et al., 2002; Bouloux, 2005; Olsson et al., 2014)。我們總結認為,相比於非陰囊部位,將睪酮乳膏用於陰囊可提高其生物利用度,提高血清睪酮濃度峰值(依劑量而定),而且劑量的大幅減少也提高了其耐受性。
從上述發現可知,睪酮凝膠或乳膏用於陰囊時的睪酮濃度峰值,相當於非陰囊部位的約 5 - 8 倍。此幅度與睪酮貼片用於陰囊後的水平比非陰囊部位高 5 倍的認識相吻合。
雌二醇在化學結構和性質(例如親脂性,可能也包括吸收特性)等方面與睪酮非常相似。因此,儘管目前尚無關於經陰囊/新陰唇使用雌二醇凝膠或乳膏、或者清楚表明其引起的雌二醇水平要高於常規透皮部位的研究;但是,我們可以從睪酮的現象來推斷,雌二醇也會有類似性質——在當陰囊給藥的透皮雌二醇貼片,被確認可引起遠高於非陰囊部位的雌二醇水平之後,我們愈發確信這點。
因此,與雌二醇貼片類似,經陰囊/新陰唇使用雌二醇凝膠很可能成為一種可提供高雌二醇水平的強力選項。使用雌二醇透皮製劑時,與常規皮膚部位相比,如改為經陰囊/新陰唇給藥,則應有更高的效力和明顯更低的成本。
此外,凝膠和乳膏每日只需給藥一次,乾燥得也非常迅速;如果換作貼片,其必須一直貼在身上,此時貼在陰囊/新陰唇就不及貼在常規部位來得舒適和便利了。而且,貼片需要先對陰囊/新陰唇進行脫毛方可使用,還會留下難以去除的粘合劑殘留物、並引起區域性皮膚反應;而凝膠和軟膏則不會有這種問題。
綜上,雌二醇凝膠或軟膏應是更適合用於陰囊/新陰唇的透皮製劑。
陰囊/新陰唇給藥時可能需要注意:透皮雌二醇凝膠由水醇凝膠製成(內含酒精),因而塗抹於外生殖器時,可能會刺激皮膚、引起刺痛或灼傷。為此,可以改用僅含少量或不含酒精的透皮藥品——例如乳膏(如複合非處方產品)和乳液(如 Estrasorb),而非水醇凝膠。此外,透皮雌二醇噴霧劑(品牌 Evamist)亦可作為替代方案。
總之,經陰囊給藥的透皮睪酮凝膠或乳膏,相比於常規部位不僅吸收更好,而且睪酮水平高出約 5 - 8 倍。考慮到雌二醇的結構與睪酮相似,且陰囊給藥的雌二醇貼片已被證明比常規部位明顯吸收得更好,可以認為,透皮雌二醇凝膠和乳膏也有類似的效果。
雌二醇用於外生殖器的安全性
已有人表達了對雌二醇用於外生殖器之安全性的關注。例如,有人詢問,雌二醇用於陰囊時是否會因其引起的區域性雌二醇水平較高,而提高睪丸癌或前列腺癌的風險。
現有的對正接受標準激素治療的女性傾向跨性別者進行的大型觀察性研究,並未發現睪丸癌(Bensley et al., 2021; de Nie et al., 2021)或前列腺癌(de Nie et al., 2020)的風險升高。事實上,這些女性傾向跨性別者的前列腺癌風險反而大幅降低了(de Nie et al., 2020)。
此外,對於順性別男性,雄激素匱乏可降低前列腺癌的風險或發展;而高劑量雌激素療法在很長時間內都用於治療前列腺癌,且卓有成效(Ockrim, Lalani, & Abel, 2006; Norman et al., 2008; Langley et al., 2021)。
因此,對於睪丸或前列腺內的區域性超高雌二醇濃度是否會提高患癌風險這個問題,儘管我們尚無相關資料可供回答,但現有的間接臨床證據並不予以支援,故大可放心。
參考文獻
- Atkinson, L. E., Chang, Y. L., & Snyder, P. J. (1998). Long-term experience with testosterone replacement through scrotal skin. In Nieschlag, E., & Behre, H. M. (Eds.). Testosterone: Action · Deficiency · Substitution, 2nd Edition (pp. 365–388). Berlin/Heidelberg: Springer. [DOI:10.1007/978-3-642-72185-4_13] [備用]
- Behre, H. M., & Nieschlag, E. (2012). Testosterone preparations for clinical use in males. In Nieschlag, E., Behre, H. M., & Nieschlag, S. (Eds.). Testosterone: Action · Deficiency · Substitution, 4th Edition (pp. 309–335). Cambridge/New York: Cambridge University Press. [DOI:10.1017/CBO9781139003353.016] [Google 閱讀]
- Bensley, J. G., Cheung, A. S., Grossmann, M., & Papa, N. (2022). Testicular Cancer in Trans People Using Feminising Hormone Therapy– A Brief Review. Urology, 160, 1–4. [DOI:10.1016/j.urology.2021.11.014]
- de Nie, I., de Blok, C., van der Sluis, T. M., Barbé, E., Pigot, G., Wiepjes, C. M., Nota, N. M., van Mello, N. M., Valkenburg, N. E., Huirne, J., Gooren, L., van Moorselaar, R., Dreijerink, K., & den Heijer, M. (2020). Prostate Cancer Incidence under Androgen Deprivation: Nationwide Cohort Study in Trans Women Receiving Hormone Treatment. The Journal of Clinical Endocrinology and Metabolism, 105(9), e3293–e3299. [DOI:10.1210/clinem/dgaa412]
- de Nie, I., Wiepjes, C. M., Blok, C. J., Moorselaar, R. J., Pigot, G. L., van der Sluis, T. M., Barbé, E., van der Voorn, P., van Mello, N. M., Huirne, J., & den Heijer, M. (2021). Incidence of testicular cancer in trans women using gender‐affirming hormonal treatment: a nationwide cohort study. BJU International, 129(4), 491–497. [DOI:10.1111/bju.15575]
- Feldmann, R. J., & Maibach, H. I. (1967). Regional variation in percutaneous penetration of 14C cortisol in man. The Journal of Investigative Dermatology, 48(2), 181–183. [DOI:10.1038/jid.1967.29]
- Hairston, J. C., Becher, E., & McVary, K. T. (2006). Topical and Intra-Urethral Therapy. In Mulcahy, J. J. (Ed.). Male Sexual Function: A Guide to Clinical Management, 2nd Edition (Current Clinical Urology) (pp. 303–321). Totowa: Humana Press. [DOI:10.1007/978-1-59745-155-0_14] [Google 閱讀]
- Iyer, R., Mok, S. F., Savkovic, S., Turner, L., Fraser, G., Desai, R., Jayadev, V., Conway, A. J., & Handelsman, D. J. (2017). Pharmacokinetics of testosterone cream applied to scrotal skin. Andrology, 5(4), 725–731. [DOI:10.1111/andr.12357]
- Järvinen, A., Granander, M., Nykänen, S., Laine, T., Geurts, P., & Viitanen, A. (1997). Steady-state pharmacokinetics of oestradiol gel in post-menopausal women: effects of application area and washing. British Journal of Obstetrics and Gynaecology, 104(Suppl 16), 14–18. [DOI:10.1111/j.1471-0528.1997.tb11562.x]
- Khera, M. (2013). Treatment Options for Testosterone Replacement Therapy. In Hellstrom, W. J. G. (Ed.). Androgen Deficiency and Testosterone Replacement: Current Controversies and Strategies (pp. 129–139). Totowa: Humana Press. [DOI:10.1007/978-1-62703-179-0_10]
- Klein, K. O., Rosenfield, R. L., Santen, R. J., Gawlik, A. M., Backeljauw, P. F., Gravholt, C. H., Sas, T., & Mauras, N. (2018). Estrogen replacement in Turner syndrome: literature review and practical considerations. The Journal of Clinical Endocrinology & Metabolism, 103(5), 1790–1803. [DOI:10.1210/jc.2017-02183]
- Kuhnert, B., Byrne, M., Simoni, M., Kopcke, W., Gerss, J., Lemmnitz, G., & Nieschlag, E. (2005). Testosterone substitution with a new transdermal, hydroalcoholic gel applied to scrotal or non-scrotal skin: a multicentre trial. European Journal of Endocrinology, 153(2), 317–326. [DOI:10.1530/eje.1.01964]
- Langley, R. E., Godsland, I. F., Kynaston, H., Clarke, N. W., Rosen, S. D., Morgan, R. C., Pollock, P., Kockelbergh, R., Lalani, e., Dearnaley, D., Parmar, M., & Abel, P. D. (2008). Early hormonal data from a multicentre phase II trial using transdermal oestrogen patches as first‐line hormonal therapy in patients with locally advanced or metastatic prostate cancer. BJU International, 102(4), 442–445. [DOI:10.1111/j.1464-410X.2008.07583.x]
- Langley, R. E., Gilbert, D. C., Duong, T., Clarke, N. W., Nankivell, M., Rosen, S. D., Mangar, S., Macnair, A., Sundaram, S. K., Laniado, M. E., Dixit, S., Madaan, S., Manetta, C., Pope, A., Scrase, C. D., Mckay, S., Muazzam, I. A., Collins, G. N., Worlding, J., Williams, S. T., … & Parmar, M. (2021). Transdermal oestradiol for androgen suppression in prostate cancer: long-term cardiovascular outcomes from the randomised Prostate Adenocarcinoma Transcutaneous Hormone (PATCH) trial programme. The Lancet, 397(10274), 581–591. [DOI:10.1016/S0140-6736(21)00100-8]
- Matthews, D., Bath, L., Högler, W., Mason, A., Smyth, A., & Skae, M. (2017). Hormone supplementation for pubertal induction in girls. Archives of Disease in Childhood, 102(10), 975–980. [DOI:10.1136/archdischild-2016-311372]
- Mazer, N. A., Heiber, W. E., Moellmer, J. F., Meikle, A. W., Stringham, J. D., Sanders, S. W., Tolman, K. G., & Odell, W. D. (1992). Enhanced transdermal delivery of testosterone: a new physiological approach for androgen replacement in hypogonadal men. Journal of Controlled Release, 19(1–3), 347–361. [DOI:10.1016/0168-3659(92)90089-A]
- Norjavaara, E., Ankarberg-Lindgren, C., & Kriström, B. (2016). Sex steroid replacement therapy in female hypogonadism from childhood to young adulthood. In Bourguignon J.-P., Parent A.-S. (Eds.). Puberty from Bench to Clinic. Lessons for Clinical Management of Pubertal Disorders (Endocrine Development, Volume 29) (pp. 198–213). Basel: Karger. [DOI:10.1159/000438892]
- Norman, G., Dean, M. E., Langley, R. E., Hodges, Z. C., Ritchie, G., Parmar, M. K., Sydes, M. R., Abel, P., & Eastwood, A. J. (2008). Parenteral oestrogen in the treatment of prostate cancer: a systematic review. British Journal of Cancer, 98(4), 697–707. [DOI:10.1038/sj.bjc.6604230]
- Ockrim, J., Lalani, E. N., & Abel, P. (2006). Therapy insight: parenteral estrogen treatment for prostate cancer—a new dawn for an old therapy. Nature clinical practice Oncology, 3(10), 552–563. [DOI:10.1038/ncponc0602]
- Place, V. A., Atkinson, L., Prather, D. A., Trunnell, N., & Yates, F. E. (1990). Transdermal testosterone replacement through genital skin. In Nieschlag, E., & Behre, H. M. (Eds.). Testosterone: Action · Deficiency · Substitution, 1st Edition (pp. 165–181). Berlin/Heidelberg: Springer. [DOI:10.1007/978-3-662-00814-0_9]
- Premoli, F., Re, I., Asenjo, G., Maximino, G., & Micheletti, L. (2005). Tratamiento del Cáncer de Próstata Avanzado con Estrógenos Transdérmicos Escrotales (ETE). [Transdermal Scrotal Estrogen Patches (TSEP) in the Treatment of Advanced Prostate Cancer.] Revista Argentina de Urología, 70(4), 231–241. [Google 學術] [URL] [PDF] [英譯本]
- Rosenfield, R. L., Kiess, W., & de Muinck Keizer-Schrama, S. (2006). Physiologic induction of puberty in Turner syndrome with very low-dose estradiol. International Congress Series, 1298, 71–79. [DOI:10.1016/j.ics.2006.07.003]
譯文修訂歷史
| 時間 | 備註 |
|---|---|
| 2021 年 10 月 23 日 | 首次翻譯。 |
| 2022 年 11 月 14 日 | 第一次修訂,梳理全文敘述,增補“用藥安全性”一節,整理外鏈。 |
| 2023 年 3 月 30 日 | 更新“參考文獻”和部分連結。 |