译者按
- ⚠免责声明:本文不构成任何医疗、处方建议。如有医疗需要,应于专业医师指导下进行。
- 本文旨在对与女性化激素治疗(FHT)有关的各方面进行全方面介绍及科普,形式上与诸权威医学机构发表的跨性别健康照护指南相似,因此全文篇幅很长(译文共计约 2.7 万个汉字),需耐心阅读。 简略说明可见 MtF.wiki 主站。
摘要
性激素由性腺产生,包括雌激素、睾酮和孕酮。性激素影响第二性征的发展;其中,睾酮引起男性化,而雌二醇引起女性化和乳房发育。男性有大量的睾酮,而女性有少量的睾酮和大量的雌二醇;这些激素差异造成了男女间身体上的不同。
女性倾向跨性别者使用性激素和其他激素类药物,将激素状况从男性典型转变成女性典型;这可引起女性化、去男性化并缓解性别焦虑。女性化激素治疗引起改变的时间从数月到数年不等。
有许多不同类型的激素药物,其可以通过不同的途径进行给药;例如,口服的丸/片剂、外用的贴片和凝胶、及注射剂等。不同的激素药物、途径和剂量具有不同的疗效、副作用、风险、开销及便利性。激素治疗时应定期通过血检进行监测,以确保疗效和安全,并在需要时作出调整。
性激素介绍
性激素种类和效果
人类性激素由雌激素(E)、孕激素(P)和雄激素构成。一个人的激素状况取决于其出生时所携带的性腺;出生时男性有睾丸,女性则有卵巢。睾丸产生大量雄激素和少量雌激素,而卵巢则产生大量雌激素、孕酮与少量雄激素。
人体内的主要雌激素是雌二醇(E2),主要孕激素是孕酮(P4),主要雄激素是睾酮(T)和双氢睾酮(DHT)。性激素引起并决定第二性征。它们通过作为激动剂(激活剂)作用于细胞内的受体而发挥作用;这些受体包括雄激素受体(AR)、雌激素受体(ER)和孕酮受体(PR);受体被激活后可调节基因表达以影响细胞和组织。
各激素的作用如下:
- 雌激素引起女性化:包括 乳房发育、皮肤软化、脂肪分布女性化(集中于乳房、髋部、大腿与臀部)、臀部变宽(在仍处于青春期的人群中),以及其它物理改变(维基百科)。
- 孕激素在女性化或青春期乳房发育过程中基本上没有已知的作用。孕激素虽不作为女性化的媒介,但却在女性生殖系统中具有重要作用,也是妊娠期间必不可少的激素(维基百科)。孕激素也会阻断雌激素在身体某些部位中的作用,如子宫、阴道和乳房(维基百科)。
- 雄激素导致男性化:这包括阴茎增长、肩膀变宽、肋骨扩张、肌肉增长、声音变沉、脂肪分布男性化(集中在腹部和腰部)、其它软组织的男性化改变,以及面部、身体毛发的生长(维基百科)。雄激素还引起各种普遍不受欢迎的皮肤和头发影响,如油性皮肤、痤疮、皮脂溢、头皮脱发和体味。此外,雄激素还阻止乳房发育,也可能阻止其它由雌激素介导的女性化改变。
除了对身体的影响外,性激素也作用于大脑,影响认知、情绪和行为。例如,雄激素在男性中产生明显的性欲和性唤醒(包括自发勃起),而雌激素是引起女性性欲的主要激素(Cappelletti & Wallen, 2016)。再如,已知睾酮水平与人的随和性呈负相关,而雌激素水平与之呈正相关(Treleaven et al., 2013)。性激素对健康也有重要影响,既有积极一面,也有消极一面;例如,雌激素可以保持骨骼强度,并可能防止顺性别女性患心脏病(北美绝经学会, NAMS, 2022),但也会增加乳腺癌风险(Aly, 2020),还可能增加血栓风险(Aly, 2020)。
雌激素、孕激素和雄激素还有抗促性腺激素的作用——其可抑制促性腺激素释放激素(GnRH)诱导的促性腺激素[即促黄体激素(LH)和促卵泡激素(FSH)]从脑垂体中的分泌。促性腺激素向性腺发出信号,使其制造性激素并提供生育所需的精子和卵细胞。因此,促性腺激素水平的降低将导致性腺性激素分泌的减少和生育力的降低。如果促性腺激素水平被充分抑制,性腺将不再产生性激素,生育力将停止。
体内绝大部分的雌二醇、睾酮和孕酮是由性腺产生的。其余少量的这些激素大部分由肾脏的肾上腺产生。
正常激素水平
对于顺性别女性,其性激素在童年期很少;到童年晚期和青春期时,性激素产量逐渐上升;到成年期则按周期规律变化;绝经之后,产量大幅下滑。
在成年绝经前女性的正常月经周期当中,诸激素水平虽变化很大,但遵循可预测的规律。一个月经周期平均持续约 28 天,包括以下阶段:
月经周期中的激素水平如下图所示:
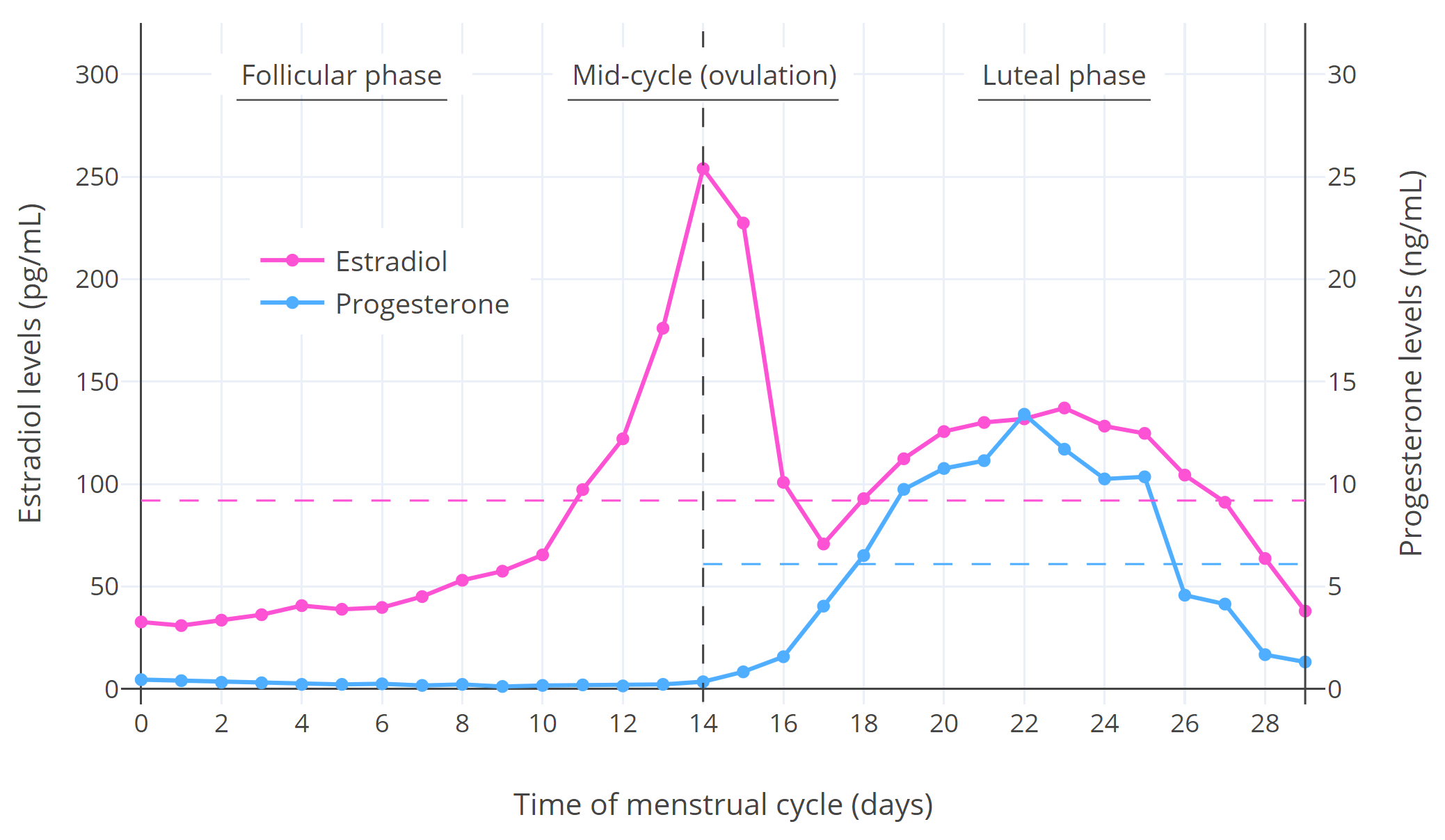
【图一】 绝经前女性整个月经周期的雌二醇和孕酮中位数水平 (Stricker et al., 2006; Abbott, 2009)。横向虚线为相应时段内的平均水平。个体之间的差别可见于他处(图表1; 图表2; 图表3)。
如上图所示,在卵泡期,雌二醇水平相对较低,孕激素水平则非常低;在周期中段,雌二醇水平短暂激增至非常高的水平并触发排卵 ,孕酮则维持不变;在黄体期,雌二醇和孕酮水平都经历一次波动,同时相对较高(尽管雌二醇没有周期中段高峰时那么高)。
下表显示了(顺性别)女性和男性的雌二醇、孕酮和睾酮的血清水平和生产率,可供对比。
【表一】 主要性激素的循环水平(1)和生产速率估计值的区间(2):
| 激素 | 群体 | 时间 | 水平(单位体积质量)(3) | 水平(摩尔浓度)(3) | 生产速率 |
|---|---|---|---|---|---|
| 雌二醇 | 女性(4) | 卵泡期 | 5–180 pg/mL | 20–660 pmol/L | 30–170 μg/天(5) |
| 周期中段 | 45–750 pg/mL | 170–2,750 pmol/L | 320–950 μg/天(5) | ||
| 黄体期 | 20–300 pg/mL | 73–1100 pmol/L | 250–300 μg/天(5) | ||
| 男性 | – | 8–35 pg/mL | 30–130 pmol/L | 10–60 μg/天 | |
| 孕酮 | 女性(4) | 卵泡期 | ≤0.3 ng/mL | ≤1.0 nmol/L | 0.75–5 mg/天 |
| 周期中段 | 0.1–1.5 ng/mL | 0.3–4.8 nmol/L | 4 mg/天 | ||
| 黄体期 | 3.5–38 ng/mL | 11–120 nmol/L | 15–50 mg/天(6) | ||
| 男性 | – | ≤0.5 ng/mL | ≤1.6 nmol/L | 0.75–3 mg/天 | |
| 睾酮 | 女性(4) | 整个月经周期 | 5–55 ng/dL | 0.2–1.9 nmol/L | 190–260 μg/天 |
| 男性 | – | 250–1100 ng/dL | 8.7–38 nmol/L | 5–7 mg/天 |
(1) 激素水平数据来源(Zhang & Stanczyk, 2013; Nakamoto, 2016; Styne, 2016; LabCorp, 2020)。
(2) 生产率数据来源(Aufrère & Benson, 1976; Powers et al., 1985; Lauritzen, 1988; Carr, 1993; O’Connell, 1995; Kuhl, 2003; Norman & Henry, 2015a; Norman & Henry, 2015b; Strauss & FitzGerald, 2019)。
(3) 使用液相色谱–质谱联用法(LC–MS;标杆性的验血方法)。
(4) 在绝经前成人的月经周期中 (年龄约 18–50 岁)。
(5) 整个月经周期的雌二醇平均生产率约为 200 μg/天 或 6 mg/月 (Rosenfield, Cooke, & Radovich, 2021)。
(6) 黄体期孕酮的生产率平均约 25 mg/天 (Carr, 1993)。
绝经前女性的平均雌二醇水平约为 100 pg/mL(合 367 pmol/L),男性则为 25 pg/mL(合 92 pmol/L);女性平均雌二醇水平的 95% 分布范围是 50–250 pg/mL(180–918 pmol/L)(例如 Abbott, 2009, 图表; Verdonk et al., 2019, 图表)。而绝经前女性整个月经周期(即一个月)内由卵巢分泌的雌二醇平均约有 6 mg(Rosenfield et al., 2008);这相当于约 200 μg/天的平均产出速率。女性在正常经历青春期时,雌二醇水平会缓慢上升,同时发生乳房发育与女性化过程。在青春期不同阶段,平均雌二醇水平都相当之低——直至后期也仍低于 50–60 pg/mL(180–220 pmol/L)左右(Aly, 2020)。
而当女性绝经后,其卵巢不再分泌大量雌激素,此时雌二醇水平一般低于 10–20 pg/mL(37–73 pmol/L)(Nakamoto, 2016)。成人围绝经期症状与低于 50 pg/mL(184 pmol/L)的雌二醇水平相关,且浓度决定症状轻重;这些症状包括潮热、抑郁情绪、去女性化(如乳房萎缩,脂肪分布女性化程度降低等)、皮肤老化加速、以及骨质流失(增加骨折风险)等。
至于睾酮水平,绝经前女性平均约为 30 ng/dL(1.0 nmol/L),男性则为 600 ng/dL(21 nmol/L)。由此可见,男性的睾酮水平平均比女性高约 20 倍。男性在接受性腺切除术(去势或摘除睾丸)之后,睾酮水平与女性相似 (<50 ng/dL,合 1.7 nmol/L)(Nishiyama, 2014; Itty & Getzenberg, 2020)。
依据多项研究,对于患有多囊卵巢综合症(PCOS)的女性,其睾酮水平平均值或中位数位于 41–75 ng/dL(1.4–2.6 nmol/L)之间,此时会出现由雄激素过多引起的一系列显著临床症状(如面部/身体毛发过度生长)(Balen et al., 1995; Steinberger et al., 1998; Legro et al., 2010; Loh et al., 2020)。这表明,即使是稍高于女性正常值的睾酮水平也会产生不良的雄激素效应。
需要注意,对激素水平的测定值会受到测定方法带来的局限;由于化验准确性有别,不同测定方法、不同实验室所测出的激素水平差异显著(Shackleton, 2010; Stanczyk & Clarke, 2010; Deutsch, 2016; Carmina, Stanczyk, & Lobo, 2019)。目前,在准确性与可靠性上,基于质谱(MS)的测定方法(如液相色谱–质谱联用法,LC-MS),被认为要优于放射免疫法(RIA)、酶联免疫吸附法(ELISA)等基于免疫测定法(IA)的方式(Stanczyk & Clarke, 2010; Carmina, Stanczyk, & Lobo, 2019)。因此,质谱法正逐渐成为实验室测定性激素水平的标准手段。
然而,即使都使用 LC-MS,不同实验室之间测定的激素水平也有差别——例如对 LC-MS 仪器的校准参数不同(Carmina, Stanczyk, & Lobo, 2019)。
对于顺性别女性的睾酮水平,其准确范围可由 RIA 或 LC-MS 等测出为 20–50 ng/dL(0.69–1.7 nmol/L);但如采用 ELISA 等直接免疫测定法,则会测得其正常上限为 70–80 ng/dL(2.4–2.8 nmol/L)(Carmina, Stanczyk, & Lobo, 2019)。当解读验血结果时,需要留意将其与同一实验室的参考范围进行比较(Deutsch, 2016)。
激素治疗概述
女性倾向跨性别者的激素治疗,又名女性化激素疗法 (FHT) 或——早年更为常见的——男跨女 (MtF) 激素替代疗法 (HRT) ,旨在促进身体女性化、去男性化,并缓解性别焦虑。用于实现这些变化的是性激素类药物,包括雌激素、孕激素和抗雄激素制剂(AA);其可取代由性腺分泌的性激素,并将激素状况从男性典型转向女性典型。
女性化激素治疗旨在使雌二醇和睾酮水平达到正常女性范围。文献中普遍推荐的雌二醇水平范围是 100–200 pg/mL(367–734 pmol/L),睾酮水平则要低于 50 ng/dL(1.7 nmol/L)(表格)。不过,高于 200 pg/mL(734 pmol/L)的雌二醇水平也有助于抑制睾酮水平。对于正处于青春期的女性倾向跨性别者,推荐维持稍低的雌二醇水平(≤50–60 pg/mL,或 ≤180–220 pmol/L),因其更符合青春期特点。
血液中的性激素水平可通过验血来测量——即通过静脉采血,并送至实验室测定。这对女性倾向跨性别者很有用:其可确保激素状况已经按照治疗目标——即控制激素水平在女性范围——作出了满意的改变。
对性腺的抑制作用
在足够高的暴露量下,雌激素和雄激素能够完全抑制性腺性激素的分泌;而孕激素本身能够部分但大幅度抑制之。具体而言,根据一些有关顺性别男性与女性倾向跨性别者的研究结果,雌二醇水平在 200 pg/mL(734 pmol/L)左右时一般能抑制睾酮水平约 90%(至大约 50 ng/dL,或 1.7 nmol/L);而雌二醇水平在 500 pg/mL(1,840 pmol/L)左右时,平均可抑制睾酮水平约 95% (至大约 20–30 ng/dL,或 0.7–1.0 nmol/L) (Gooren et al., 1984 [图表]; Herndon et al., 2023 [相关讨论]; 维基百科; 图表)。低于 200 pg/mL 的雌二醇水平也可抑制睾酮水平,不过程度有所降低 (Aly, 2019; Krishnamurthy et al., 2023; Slack et al., 2023)。
一项针对女性倾向跨性别者的大型研究发现,当雌二醇水平处于 100 pg/mL(367 pmol/L)以下、100–200 pg/mL(367–734 pmol/L)和 200 pg/mL(734 pmol/L)以上时,睾酮水平被充分抑制(即 <50 ng/dL 或 <1.7 nmol/L)的比例分别为 24%、58% 和 77%(Krishnamurthy et al., 2023)。
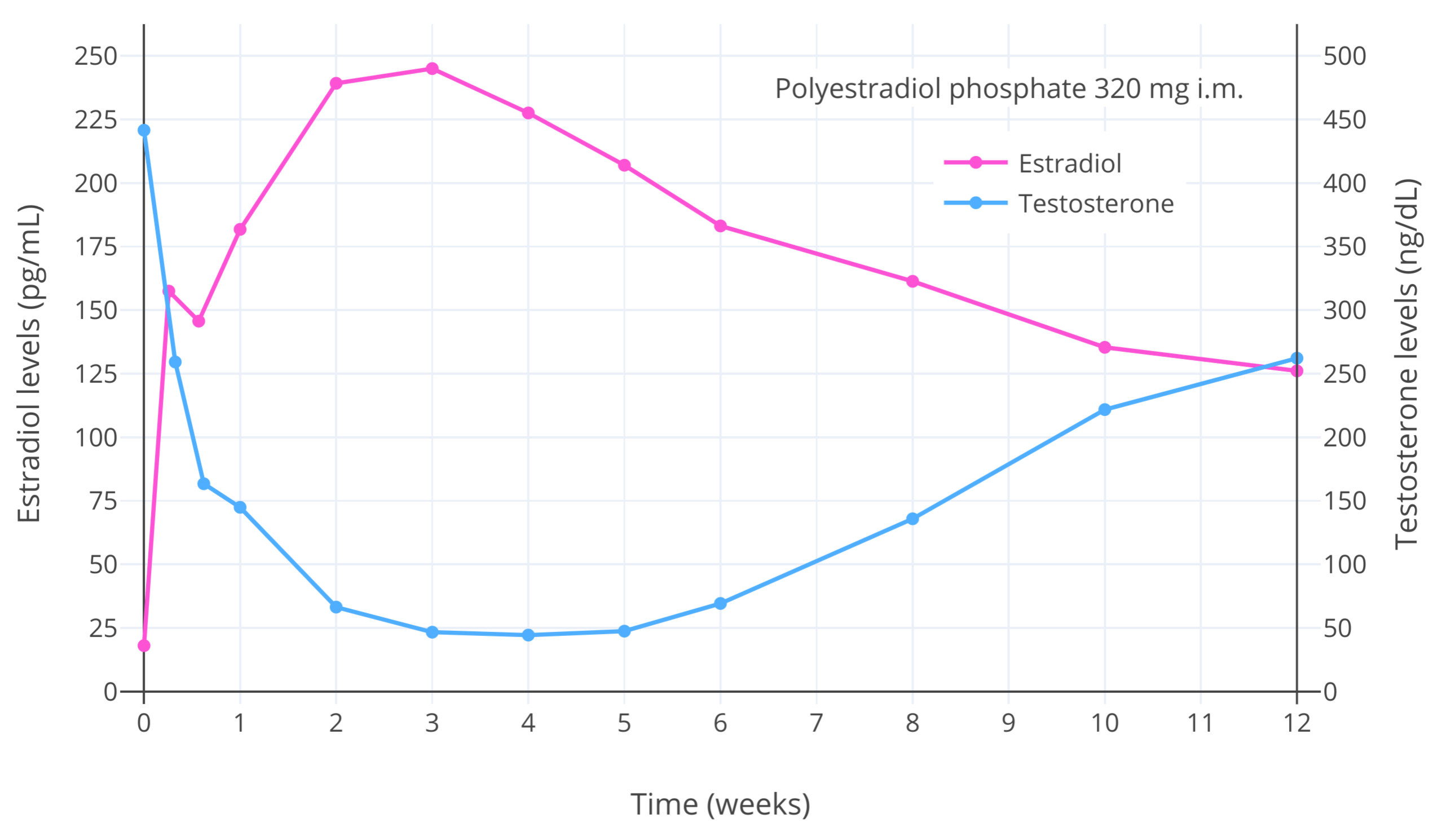
【图二】 患有前列腺癌的男性给予单次注射 320 mg 聚磷酸雌二醇(PEP;一种长效雌二醇前体)之后的雌二醇和睾酮水平变化 (Stege et al., 1996)。当雌二醇水平高于 200 pg/mL(734 pmol/L)时,睾酮水平降幅最大,约为 90%(至大约 50 ng/dL,或 1.7 nmol/L)。本图显示了在受试人群当中,雌二醇浓度及其抑制性腺分泌睾酮、抑制血液睾酮水平的能力之间的关系,抑制强度和其浓度相关。
孕激素单药最多可抑制约 50–70% 的睾酮水平 (至大约平均 150–300 ng/dL,或 5.2–10.4 nmol/L) (Aly, 2019; 维基百科)。然而,在与少量雌激素合用时,二者的抗促性腺激素作用存在协同效应:最大有效剂量的孕激素对睾酮水平的抑制作用达到完全,抑制约 95% (至大约 20–30 ng/dL,或 0.7–1.0 nmol/L) (Aly, 2019)。因此,与雌激素或孕激素单药相比,二者合用可以用较低的剂量将对睾酮的抑制作用最大化。
雌激素和孕激素用于女性化激素治疗时,利用其抗促性腺激素作用,可抑制性腺睾酮的产生,并使睾酮水平更接近于顺性别女性水平。应当指出,上述睾酮抑制率仅为平均值;在抑制睾酮效果上,个体之间有很大差异。换言之,有些人可能需要更多或更少的激素剂量来实现同样的睾酮水平降幅。
女性化效果和发生的时间线
在男性和女性的正常青春期,性激素暴露量在数年内缓慢增加(Aly, 2020),性成熟随之发生。对于不再处于青春期的跨性别者,其一般会立即使用相当于成年状态(乃至更高)的剂量的激素,这可能导致第二性征的改变发生得更快。女性化激素治疗的效果大多于治疗初期 1–6 个月内出现,后于 1–3 年内完成。
下表为诸效果发生时间的表格,文献中多有引用,此处转载之并略有改动 (表格)。其综合了口头临床经验、专家意见和现有的有关女性化激素治疗的临床研究之观点。由于当下与女性化激素疗法之效果相关的研究还很有限,故该表内容可能不大准确。
【表二】 常见剂量的激素治疗在成年女性倾向跨性别者的效果 (维基百科):
| 效果 | 开始时间(1) | 完成时间(1) | 永久性 |
|---|---|---|---|
| 乳房发育 | 2–6 个月 | 2–3 年 | 永久 |
| 毛发减少与生长减缓 | 3–12 个月 | >3 年(2) | 可逆 |
| 头皮脱发减少与逆转 | 1–3 个月 | 1–2 年 | 可逆 |
| 皮肤软化,出油与痤疮减少 | 3–6 个月 | 不明 | 可逆 |
| 女性化脂肪再分布 | 3–6 个月 | 2–5 年 | 可逆 |
| 肌肉重量与强度减少 | 3–6 个月 | 1–2 年(3) | 可逆 |
| 骨盆变宽和变圆(4) | 不明 | 不明 | 永久 |
| 情绪、情感和行为的变化 | 立即发生 | 不明 | 可逆 |
| 性欲和自发性勃起减少 | 1–3 月 | 3–6 月 | 可逆 |
| 勃起功能障碍和射精量减少 | 1–3 月 | 各异 | 可逆 |
| 精子产量减少和不育 | 不明 | >3 年 | 不定(5) |
| 睾丸体积缩小 | 3–6 月 | 2–3 年 | 不明 |
| 声音变化 (例如,音调/共鸣下降) | 无(6) | N/A | N/A |
(1) 由于遗传、饮食/营养、激素水平等因素,个体之间可能有很大差异。
(2) 激素治疗对女性倾向跨性别者的面部毛发密度的影响通常不大。彻底去除面部和身体毛发可通过以下方法实现:激光脱毛和电击脱毛。临时除毛可以使用刮毛、拔毛、蜜蜡脱毛等方式。
(3) 可能因体育锻炼量的不同而有很大差异。
(4) 只发生在生长板尚未完全闭合的年轻人身上(对于已结束青春期的人可能完全不会发生)。
(5) 只有雌激素,特别是大剂量的雌激素,似乎有可能导致长期或不可逆的不育;由抗雄激素制剂引起的生育力受损通常在停药后容易恢复。
(6) 嗓音训练是实现声音女性化的一种有效方式。
关于乳房发育
在女性化激素治疗的诸多效果中,讨论最多的一种是乳房发育(Masumori et al., 2021; Grock et al., 2024)。这关系到乳房作为女性特征、性吸引构成要素、性和性别标志的核心所在。女性倾向跨性别者的乳房发育通常于 1–6 个月内开始,后于 1–3 年内完成(例如 de Blok et al., 2021)。发育完成的乳房从尺寸和外形上看差异很大,这与原生女性的情况一致(de Blok et al., 2021)。基于现有高质量临床研究的结果,女性倾向跨性别者的乳房往往远小于原生女性的平均水平,且该现象与激素治疗方案和引入激素治疗时的年龄均无关(例如 de Blok et al., 2021; Boogers et al., 2025)。其原因尚不明确,但从动物现象来看,有一种比较大的可能:即胎儿期的雄激素暴露限制了后续的乳房增长潜力。尽管乳房发育往往有限,但不少女性倾向跨性别者仍对总体的发育情况表示满意(de Blok et al., 2021; Boogers et al., 2025)。
目前能够永久性促进或改善乳房发育的已知或经证实的手段,除了确保睾酮抑制充分、维持雌二醇水平于某个下限以上之外,再无他法。但有研究表明,避免服用过高剂量的雌二醇或孕激素或许有所裨益。另外,已知较高的雌二醇、孕酮和/或泌乳素水平可通过促进局部液体潴留、小泡/小叶成熟等方式,引起短暂、可逆的乳房紧张感和乳房增大,类似于正常月经周期和妊娠期间的改变(Aly, 2020);然而,这种改变较为轻微,且高激素水平伴随着健康风险(Aly, 2020)。如对乳房尺寸不满意,可以考虑隆胸手术。某些女性倾向跨性别者可能希望避免乳房增长或使之最小化,例如非二元性别人士;对此也有其它可行的治疗选项(Aly, 2019)。
本站于他处也回顾了女性倾向跨性别者的乳房发育情况(例如 Aly, 2020; Aly, 2020)。如对监测乳房增长过程感兴趣,则有多种测量和跟踪乳房增长的方法可用(维基百科)。可在社交网站 Reddit 上的 r/TransTimelines 和 r/TransBreastTimelines 等主题查阅到女性化激素疗法引起的乳房发育与女性化的照片和时间线。
有关激素类药物的详情
用于女性化激素治疗的药物包括雌激素、孕激素和抗雄激素制剂。其中,雌激素产生女性化并抑制睾酮水平;而孕激素和抗雄制剂虽不会促进女性化,但可帮助进一步抑制和/或阻断睾酮。对睾酮的抑制会引起去男性化、并去除对雌激素介导的女性化效果之抑制作用。
雄激素有时候也以低剂量用于睾酮水平低的女性倾向跨性别者,不过其并非必要,其益处也不清楚。
有多种激素类药物可用于女性化激素治疗,各自有不同收益与风险。
雌激素、孕激素和抗雄制剂有不同的剂型,并可通过不同的给药途径使用。给药途径可影响激素在体内的吸收、分布、代谢和消除,在生物利用度、血液和特定组织中的激素水平以及代谢物的模式等方面产生明显差异。这些差异会明显影响治疗效果。
【表三】 女性倾向跨性别者激素治疗的主要给药途径:
| 途径 | 简称 | 描述 | 典型形式 |
|---|---|---|---|
| 口服给药 | 口服/ PO | 吞服 | 片剂、胶囊 |
| 舌下给药 | 舌下/ SL | 舌下含服并吸收 | 片剂 |
| 颊部给药 | 颊部/ BUC | 在脸颊或嘴唇下方放置并吸收 | 片剂 |
| 透皮给药 | 透皮/ TD | 涂抹在皮肤上并通过皮肤吸收 | 贴剂、凝胶、乳膏 |
| 直肠给药 | 直肠/ REC | 置入直肠并被直肠吸收 | 栓剂 |
| 肌肉注射 | 肌注/ IM | 注射到肌肉中(如臀部、大腿、手臂) | 溶液 (小瓶或安瓿瓶) |
| 皮下注射 | 皮注/ SC | 注射到皮下脂肪中 | 溶液 (小瓶或安瓿瓶) |
| 皮下植入 | 植入/ SCi | 通过手术切口植入皮下脂肪 | 微球 |
阴道给药是顺性别女性使用激素类药物的主要途径之一。对于女性倾向跨性别者,虽然不可能通过原生阴道给药,但在接受阴道成形术之后可以通过新阴道给药。然而,新阴道的内壁并非原生的 阴道上皮 ,而通常是皮瓣或肠壁——这取决于手术的类型(阴茎翻转术或乙状结肠移植术)。因此,如通过新阴道给药,其在性质上可能与透皮或直肠途径(取决于新阴道的类型)相似,而与原生阴道给药不同。不过需要指出,激素类药物在阴道及直肠途径上的特性被认为很相似(Goletiani, Keith, & Gorsky, 2007; 维基百科)。此外,根据一项研究,通过以腹膜(腹部内膜;使用者较少)再造的新阴道吸收雌二醇的情况与顺性别女性阴道给药的情况相似(Willemsen et al., 1985)。
因此,新阴道给药可作为部分女性倾向跨性别者的另一种给药选项(依情形而定)。不过,该途径尚需得到更充分的文献描述。
激素药物服用者常提出的一个问题是:在一天中是否存在一个最适合用药的时间点(Colonnello et al., 2025)。至今为止,这方面的研究还很稀少,问题的答案基本上尚不明确(Colonnello et al., 2025)。无论如何,目前没有任何证据或靠谱的理论基础支持这么一个时间点的存在(Colonnello et al., 2025);这极有可能不会造成明显的、乃至任何的差异。
雌激素介绍
雌二醇是人体内主要的具有生物同质性的雌激素,也是女性化激素治疗主要使用的雌激素。雌二醇半水合物(EH)与雌二醇基本同质,并可与雌二醇互换。
雌二醇酯也时常代替雌二醇使用;其作为雌二醇的前体,在体内可转换为雌二醇,故其生物活性与雌二醇基本相同。不过,其作为注射剂使用时,从注射位点吸收的速率较慢,从而具有较长的作用时间;因此给药频率可以少些。主要使用的雌二醇酯包括:戊酸雌二醇(EV;品牌有Progynova/“补佳乐”、Progynon Depot、Delestrogen),以及环戊丙酸雌二醇(EC;品牌 Depo-Estradiol)。聚磷酸雌二醇(PEP;Estradurin)是一种聚合物形式(即雌二醇分子链)的雌二醇前体注射剂;它的代谢缓慢,作用时间很长。
诸如炔雌醇(EE;用于避孕药)、结合雌激素(CEE;Premarin/“倍美力”;用于更年期激素治疗)与己烯雌酚(DES;曾广泛使用,现已弃用)等非生物同质性雌激素,因难以被肝脏代谢,故其对由雌激素调节的肝脏合成过程的影响与雌二醇等生物同质性激素相比是畸高的(Aly, 2020)。因此,其具有更大的血栓与心血管问题等健康风险(Aly, 2020)。结合上述理由,以及可能需要较高剂量雌激素来充分抑制睾酮水平这一事实,最好不要将非生物同质性雌激素用于女性化激素治疗。
在有睾丸的人群中,雌二醇对睾酮水平有抑制作用,强度和剂量相关。对于尚未切除性腺的女性倾向跨性别者,生理性的、诸医学指南所推荐的雌二醇水平(<200 pg/mL 或 <734 pmol/L)往往不足以将睾酮水平抑制到女性范围内(例如 Liang et al., 2018; Krishnamurthy et al., 2023; Slack et al., 2023)。因此,在女性化激素治疗中一般在雌二醇之外加用一种抗雄制剂或孕激素(Hembree et al., 2017; Coleman et al., 2022; Rose et al., 2023);这里,雌二醇抑制一部分睾酮水平,加用的抗雄制剂或孕激素则抑制或阻断剩余的睾酮。这种联合治疗虽具备完全抑制或阻断睾酮的有效性(例如 Aly, 2019; Aly, 2020),但如采用某些类型的抗雄制剂或孕激素,仍可能造成睾酮抑制效果不充分(例如 Aly, 2018; Jain, Kwan, & Forcier, 2019)。
和生理性水平相反的是,如雌二醇单药用于女性倾向跨性别者时引起了超生理的雌二醇水平,其可一致、完全地将睾酮水平抑制到女性正常范围内(例如 Gooren et al., 1984 [图表]; Igo & Visram, 2021; Herndon et al., 2023 [相关讨论])。这种通常被称作“高剂量雌激素单药治疗”的替代方案的优点是,其可避免由抗雄制剂和孕激素引起的副作用、风险和开销;但缺点是,其会导致身体暴露于超生理的、超出诸医学指南推荐范围的雌二醇水平,健康风险也可能更高。
医师指导下,女性倾向跨性别者的治疗方案以包含生理性雌二醇剂量的联合治疗居多;而自行安排用药(DIY)的激素治疗方案则以高剂量雌二醇单药治疗居多。
在没有雄激素的情况下,雌激素的女性化作用在低剂量下也可达到最大。目前,除了睾酮抑制作用更强之外,没有查明较高剂量和超生理水平的雌二醇具备可促进女性倾向跨性别者女性化的任何作用(Deutsch, 2016; Nolan & Cheung, 2021)。事实上,有迹象表明,如在治疗早期引入更高的雌激素剂量,则可能会导致乳房发育效果欠妥。因此,女性化激素治疗的临床目标更倾向于对睾酮的抑制,而非让雌二醇水平达到某个值——至少是某个区间的下限以上。
更高剂量的雌激素(包括雌二醇)也有更大的不良健康影响的风险,如血栓和心血管问题 (Aly, 2020);因此,对女性倾向跨性别者而言,最好使用生理性剂量的雌二醇。不过与此同时,在睾酮抑制不充分的情况下,增加雌激素剂量是有用的;而且非口服形式的雌二醇所带来的绝对风险很低——这对于有特定风险因素的人群尤为重要。这些风险因素包括:年龄大、缺乏运动、肥胖、孕激素的合并使用、吸烟、手术和罕见的血栓指标异常等。而对于没有雌激素相关疾病风险因素的人群(例如某些健康的年轻人),为充分抑制睾酮而使用的、略微超生理剂量的非口服雌二醇可能有更理想的收益—风险比(Aly, 2020)。
在女性化激素治疗当中,雌二醇与雌二醇酯通常以口服、舌下含服、透皮、注射(肌肉或皮下注射)或植入的形式使用(维基百科)。
口服雌二醇
口服雌二醇以雌二醇片剂的形式使用(维基百科; 图表)。另外在部分国家(例如在许多欧洲国家),会使用戊酸雌二醇片。此二者的唯一真正区别在于:同等质量下,戊酸雌二醇因多出一个戊酸基团,故雌二醇含量较少(约 76%),从而需要稍高的剂量(约 1.3 倍)以达到同等雌二醇水平(维基百科; 图表)。
口服雌二醇的作用时间较长,适合每日服一次。口服雌二醇不仅非常便利,开销也较少,从而成为女性倾向跨性别者最欢迎、最常用的雌二醇形式。
口服雌二醇的生物利用度较低(约 5%),同等剂量下所达到的雌二醇水平在个体之间也有较大差异。因此,某些女性倾向跨性别者使用口服雌二醇时,可能仅产生很低的雌二醇水平;对睾酮的抑制作用亦可能不充分(取决于抗雄制剂)。
口服雌二醇有一项重大缺点:因肝脏的首过效应,其在肝脏内引起的雌二醇水平畸高,从而对由雌激素调节的肝脏合成机制产生不相称的影响(Aly, 2020)。这还会增强凝血,增加血栓与心血管疾病等相关健康问题的风险(Aly, 2020)。如换用适中剂量的非口服雌二醇,则上述健康隐患会大大减轻。因此,透皮等非口服形式的雌二醇尽管不及口服便利,开销往往也更大,但却是更适合用于女性化激素治疗的。已有建议提出,考虑到血栓与心血管问题的风险随年龄增长的缘故,所有 40–45 岁以上的女性倾向跨性别者应采用非口服途径(Aly, 2020; Coleman et al., 2022)。
口服雌二醇并不适合女性倾向跨性别者用于高剂量单雌二醇疗法,因为(其难以达到)所需要的高雌二醇水平,其风险亦高于非口服途径;除了其对肝脏不相称的影响之外,其还会产生非生理水平的雌酮、硫酸雌酮等雌二醇代谢物。其临床意义(如有)尚不清楚。
无论如何,从现有研究可知,口服与非口服雌二醇在女性倾向跨性别者的乳房发育和女性化等方面具备同等有效性(Sam, 2020)。
舌下含服雌二醇
口服雌二醇片剂可改为舌下含服。舌下含服雌二醇片剂有数倍于口服的生物利用度,从而可引起远高于口服的总雌二醇水平(Sam, 2021; 维基百科; 图表)。如有需要,可以利用舌下含服雌二醇片剂,来减少剂量(同时减少开销)或者产生更高雌二醇水平以期更好地抑制睾酮。
不过,舌下含服雌二醇引起的雌二醇水平曲线比口服尖锐得多,维持较高雌二醇水平的时间也较短。因此,宜建议使用舌下含服雌二醇时要全天分多次服用,以保持较稳定的雌二醇水平。
舌下含服雌二醇所引起的尖锐曲线对女性倾向跨性别者的临床意义,例如睾酮抑制作用与健康风险等,因尚未得到充分研究,故基本不明。无论如何,已观察到作为一种高剂量雌二醇单药疗法,全天分多次服用的情况下,其引起了较强、但尚不完全的睾酮抑制作用(Yaish et al., 2023)。
与雌二醇类似,口服戊酸雌二醇片剂亦可用于舌下含服,且同样高效(Aly, 2019; 维基百科)。
雌二醇片剂经舌下含服的过程中可能会有一部分被吞服,因此其事实上可能混合了舌下含服与口服的情形,从而具有一部分类似于口服雌二醇的健康风险(维基百科)。
面颊含服雌二醇基本上具有和舌下含服一致的特性,不过其相关研究更少,在女性倾向跨性别者当中的使用亦较少(维基百科)。
透皮雌二醇
透皮雌二醇包含贴片、凝胶、乳膏和喷雾剂等形式(维基百科)。它们通常被贴附于皮肤部位,如手臂、腹部和臀部。凝胶、乳膏与喷雾剂在使用后会很快变干,而贴片可在一段时间内持续附着于皮肤。由于皮肤的吸收速率有限,透皮雌二醇会像水库一样,在较长时间里持续释放雌二醇,从而维持非常稳定的雌二醇水平。因此,雌二醇凝胶、乳膏与喷剂皆适合每日一次使用;而贴片附着后可在 3–4 日或 7 日内(取决于品牌 *)持续释放雌二醇(表格)。
透皮雌二醇的开销要高于口服。凝胶、乳膏与喷剂的使用并不及口服方便;但贴片方便很多,因为其用药频率更低。然而,贴片有时会引起附着位点的不适,例如红肿、瘙痒等;而且偶尔会因粘力不足而过早脱落。类似于口服,透皮雌二醇引起的雌二醇水平也在个体间有较大差异;一些女性倾向跨性别者对其的吸收能力很差,雌二醇水平也很低、不足以抑制睾酮。
已知形如 Lenzetto 的雌二醇喷剂仅可达到很低的雌二醇水平,其在女性化激素治疗当中的疗效可能不足(Aly, 2020; 图表)。
* 译者注: 某些贴片的使用时间短于 3 日,例如日本久光 Estrana Tapes仅可贴附两天。
由于健康风险低于口服,透皮雌二醇是 40 岁以上的女性倾向跨性别者最常用的一种雌二醇形式。
透皮雌二醇凝胶并不适合用于高剂量雌二醇单药疗法,因为其难以产生可充分抑制睾酮的高雌二醇水平(Aly, 2019)。而另一方面,透皮雌二醇贴片可以用于该疗法:这需要同时运用多个 100 μg/天的贴片,但如此一来开销也会更昂贵(维基百科)。
不同皮肤部位对透皮雌二醇的吸收程度不同(维基百科)。如在生殖器部位(特别在阴囊或新阴唇)使用透皮雌二醇,其吸收率尤其高于常规皮肤位点,引起的雌二醇水平也远高于常规(Aly, 2019)。这一点很实用,其在需要时(例如在高剂量雌二醇单药疗法下)可用更少剂量和更少的药费来达到更高的雌二醇水平、并更好地抑制睾酮。
透皮雌二醇不应用于乳房;因为这种方式并未被查明可促进乳房发育,其对健康的潜在影响(如对乳腺癌风险的影响)亦未可知。
注射用雌二醇
雌二醇注射剂可通过肌肉或皮下注射给药(维基百科; 维基百科; 图表)。雌二醇酯在注射之后,可贮存于注射位点并被缓慢吸收,从而具有较长作用时间;根据酯的类型,作用时间从数日到数个月不等。目前常用的注射用雌二醇酯包括:戊酸雌二醇(EV)、环戊丙酸雌二醇(EC)、庚酸雌二醇(EEn)与苯甲酸雌二醇(EB);其作用时间较短或适中。而更长效的雌二醇酯,如十一酸雌二醇(EU)与聚磷酸雌二醇(PEP),皆已不再生产及上市。
肌肉注射(简称肌注)常用的部位包括上臂三角肌、大腿的股外侧肌与股直肌、以及臀部侧肌。而皮下注射尽管不大常用,但在药代动力学特性上与肌注相似,而且比肌注更易于操作、痛感更小、也更便捷(维基百科)。然而,在确保安全与舒适的前提下,皮下注射允许的最大容积(1.5–3 mL)要小于肌注(2–5 mL)(Hopkins, & Arias, 2013; Usach et al., 2019)。
注射用雌二醇的开销普遍较小,但由于需要定期注射,其相比其它途径显得不大方便;而且长期使用时会有在体内不断积累疤痕组织的风险。
注射用雌二醇已在全球许多地区(如在欧洲大部分地区)下市,故其可用地域有限。近年来,许多女性倾向跨性别者转而从黑市购买小作坊自制的雌二醇注射剂使用。
雌二醇注射剂的剂量往往高于其它形式的雌二醇,并可产生相当高的雌二醇水平。这有助于抑制睾酮,因此其可能是最适合女性倾向跨性别者用于高剂量雌二醇单药疗法的选项。不过,如此高的剂量也很容易导致摄入过量,并增加不必要的风险(例如 Aly, 2020)。为引导女性倾向跨性别者选择合适的雌二醇酯剂量与注射间隔,本站已有相关资料提供,包括对各类注射剂引起的雌二醇水平的模拟器与非正式的荟萃分析(Aly, 2021; Aly, 2021);还有一份表格提供了各注射用雌二醇酯与其它雌二醇途径、形式之间大致等效的剂量数据(Aly, 2020)。
需要指出,遗憾的是,现有跨性别照护指南所推荐的注射用雌二醇酯剂量基本上高度过量、注射间隔也过长(例如每两周 10–40 mg 戊酸雌二醇),从而不宜用于治疗(Aly, 2021)。
笔者于下方(表四)列出为高剂量雌二醇单药疗法所推荐的注射用雌二醇酯剂量与间隔——目标是维持平均雌二醇水平在 300 pg/mL(合 1,100 pmol/L)左右。
【表四】 用于高剂量雌二醇单药治疗的注射用雌二醇酯的推荐剂量与注射间隔(旨在使雌二醇水平处于 300 pg/mL,或 1,100 pmol/L 左右)
| 雌二醇酯 | 短间隔 | 中等间隔 | 长间隔 | 模拟血药曲线 |
|---|---|---|---|---|
| 苯甲酸雌二醇 | 0.67 mg/日 | 1.33 mg/两日 | 2 mg/三日 | 图表 |
| 戊酸雌二醇 | 2 mg/三日 | 3.5 mg/五日 | 5 mg/周 | 图表 |
| 环戊丙酸雌二醇(油溶液) | 5 mg/周 | 7 mg/十日 | 10 mg/两周 | 图表 |
| 环戊丙酸雌二醇(悬浮液) | 2 mg/三日 | 3.5 mg/五日 | 5 mg/周 | 图表 |
| 庚酸雌二醇 | 5 mg/周 | 7 mg/十日 | 10 mg/两周 | 图表 |
| 十一酸雌二醇(1) | 10 mg/两周 | 20 mg/四周 | 30 mg/六周 | 图表 |
| 聚磷酸雌二醇 | 160 mg/月 | 240 mg/四十五天 | 320 mg/两个月 | 图表 |
(1) 十一酸雌二醇的推荐剂量与间隔为推测和假设而来(Aly, 2021)。
上述剂量与注射间隔应作为治疗的起点,且应根据验血结果按需进行微调。注射间隔越短,雌二醇水平越稳定,但所需注射频率越多。如果雌二醇水平过低、睾酮抑制不够充分,可适当增加剂量;但如果雌二醇水平过高,在保持睾酮抑制作用充分的情况下,可适当减少剂量。如与抗雄制剂或孕激素合用,因其会抑制睾酮,应减少注射剂量,使雌二醇平均水平维持于 100–200 pg/mL(367–734 pmol/L)。
类似地,接受性腺切除术之后,便不再需要抑制睾酮,此时应减少剂量。
雌二醇微球
雌二醇植入体是一种小球状的纯激素晶体,可由医师经手术植入皮下脂肪(维基百科)。其植入之后被缓慢吸收,每隔 4–6 个月需再次植入。由于需要进行小型手术,且开销较大、可用地域有限,故雌二醇植入体的使用不及其它途径那样普遍。还需指出,雌二醇植入体在全球范围内几乎均已退市,剩余的品种几乎仅以复合药剂的一部分存在。对其剂量进行调整的难度也高于其它雌二醇途径。
不过,尽管有种种实际限制,但雌二醇植入体可维持非常稳定的雌二醇水平,其超长作用时间所带来的便利也是在现有雌二醇形式当中最独特的。
补充说明
【表五】 可用于成年(1)女性倾向跨性别者的雌二醇形式和推荐剂量:
| 药品 | 途径 | 形式 | 剂量 |
|---|---|---|---|
| 雌二醇 | 口服 | 片剂 | 2–8 mg/天 |
| 舌下或颊部含服 | 片剂 | 0.5–6 mg/天(2) | |
| 透皮 | 贴片 | 50–400 μg/天 | |
| 透皮 | 凝胶 | 1.5–6 mg/天 | |
| 透皮 | 喷剂 | 不推荐(3) | |
| 皮下植入 | 微球 | 25–150 mg/六个月 | |
| 戊酸雌二醇 | 口服 | 片剂 | 3–10 mg/天(4) |
| 舌下或颊部含服 | 片剂 | 1–8 mg/天(2)(4) | |
| 肌肉或皮下注射 | 油溶液 | 0.75–4 mg/五天; 或 1–6 mg/周; 或 1.5–9 mg/十天 | |
| 环戊丙酸雌二醇 | 肌肉或皮下注射 | 油溶液 | 1–6 mg/周; 或 1.5–9 mg/十天; 或 2–12 mg/两周 |
| 肌肉或皮下注射 | 水悬浮液 | 0.75–4 mg/五天; 或 1–6 mg/周; 或 1.5–9 mg/十天 | |
| 庚酸雌二醇 | 肌肉或皮下注射 | 油溶液 | 1–6 mg/周; 或 1.5–9 mg/十天; 或 2–12 mg/两周 |
| 苯甲酸雌二醇 | 肌肉或皮下注射 | 油溶液 | 0.15–0.75 mg/天; 或 0.3–1.5 mg/两天; 或 0.45–2.25 mg/三天 |
| 十一酸雌二醇(5) | 肌肉或皮下注射 | 油溶液 | 2–12 mg/两周; 或 4–24 mg/四周; 或 6–36 mg/六周 |
| 聚磷酸雌二醇 | 肌肉注射 | 水溶液 | 40–160 mg/月(6) |
(1) 处于青春期的女性倾向跨性别者应使用更低剂量雌二醇,以模拟女性正常青春期之间的雌二醇暴露量(Aly, 2020)。
(2) 建议每日分 2–4 次(即每隔 6–12 小时)分量含服,而非每日一次(Sam, 2021)。
(3) 喷剂形式在通常剂量下仅可产生非常低的雌二醇水平,并不适合用于女性化激素治疗(Aly, 2020; 图表)。
(4) 戊酸雌二醇的雌二醇含量约为 75%,故其剂量需增至约 1.3 倍,以达到同等雌二醇水平(Aly, 2019; Sam, 2021)。
(5) 十一酸雌二醇的推荐剂量与间隔为推测和假设而来(Aly, 2021)。
(6) 可于最初 1–2 次注射中使用稍高的起始负荷剂量(如 240–320 mg),以使雌二醇水平更快达到稳态;不过,聚磷酸雌二醇已于近期退市,显然也不再能获取。
另可于他处查阅不同形式、途径与剂量的雌二醇所产生的雌二醇水平(维基百科; 表格),以及其大致等效的剂量数据(Aly, 2020)。
在雌二醇治疗过程中,个体之间达到的雌二醇水平有很大差异。也就是说,使用相同剂量的雌二醇治疗时,个体之间的雌二醇水平可能差别很大。这种差异性在口服和透皮途径中最为明显,但即使是雌二醇注射剂及其它形式,也会产生一定差异。因此,雌二醇剂量的推荐值并非放之四海而皆准;应以验血结果为指引,结合每个人的情况实现“一人一方”。
还需说明,某些特定途径所产生的雌二醇水平波动很大,从而使得其每次测定的结果差别会很明显。这里要特别提到舌下含服和注射用雌二醇:其在雌二醇水平上的波动是可预见的,在解读验血结果时也必须清楚这一点。验血结果上的差异可通过选择有人指导的、一致的时机进行采血而降至最小。
女性倾向跨性别者在切除性腺后,便不再需要抑制睾酮了;因此,如此前使用较高或超生理剂量的雌二醇,可适当降低剂量,使其接近于顺性别女性的正常生理水平。
孕激素介绍
孕激素包含天然孕酮和人工孕激素制剂。其中,人工孕激素是人工合成的孕激素,由孕酮或睾酮分子修饰而来;其种类繁多,依其结构类型而产生不同特性(表格)。这些结构类型及其主要成员包括:
- 17α-羟孕酮衍生物,如醋酸甲羟孕酮(MPA; 品牌有 Provera、Depo-Provera);
- 19-去甲睾酮衍生物,如炔诺酮 (NET; 品牌较多);
- 逆孕酮衍生物,如地屈孕酮[Duphaston (达芙通)];
- 17α-螺内酯衍生物,如屈螺酮[Slynd, Yasmin (优思明)]。
人工孕激素的开发得益于其作为药物使用时在体内的性状比孕酮更佳。迄今仅有几种人工孕激素已被临床用于女性化激素治疗;不过,大多数孕激素都有相同的孕激素作用(少部分除外),因此理论上几乎任何孕激素皆可一用。
孕激素通过其孕激素活性与对脑垂体分泌促性腺激素的抑制作用(与剂量相关),实现抗促性腺激素作用;这使得促性腺激素对性腺的刺激作用减弱,从而减少性激素分泌量、降低生育力。迄今已有多项临床研究描述了不同孕激素在顺性别男性、女性倾向跨性别者身上产生的与剂量相关的睾酮抑制作用(Nieschlag, Zitzmann, & Kamischke, 2003; Nieschlag, 2010; Nieschlag & Behre, 2012; Zitzmann et al., 2017; Aly, 2019)。这些研究的对象包括:
- 醋酸环丙孕酮(CPA)(Aly, 2019; 维基百科);
- 醋酸甲羟孕酮(MPA)(维基百科);
- 炔诺酮(NET)(维基百科)及其酯化物醋酸炔诺酮(NETA)(维基百科);
- 左炔诺孕酮(LNG)(Zitzmann et al., 2017; 维基百科);
- 去氧孕烯(DSG)(Wu et al., 1999; 维基百科);
- 地诺孕素(DNG)(Meriggiola et al., 2002; 维基百科);
- (天然)孕酮(维基百科);
- 等等。
高剂量下,孕激素单药对睾酮水平的平均抑制率最大可达 50–70% 左右(Aly, 2019; Zitzmann et al., 2017 (图表));而当与雌激素合用时,抑制率提升至约 95%,此时睾酮水平落入到女性正常范围(Aly, 2019)。在顺性别女性当中,孕激素似乎往往能以相当于抑制排卵所需的约 5–10 倍的剂量,最大限度地发挥睾酮抑制能力(Aly, 2019)。
在诸多孕激素当中,口服孕酮与地诺孕素属于例外:因为其效力较弱、性状也不寻常,对促性腺激素的拮抗效应不明显,无法很好地抑制睾酮水平(Aly, 2018; 维基百科; 维基百科)。
对于女性倾向跨性别者,孕激素除了增强对睾酮的抑制作用之外,在女性化及乳房发育等方面并无任何明确或已知的助益。尽管有女性倾向跨性别者传言称,其使用孕激素后促进了乳房发育;但孕激素在乳房尺寸或形状上有多少促进作用的问题尚存在争议,目前也尚无任何理论或证据予以支持(维基百科; Aly, 2020)。事实上,过早地引入孕激素,尤其是高剂量下,有可能会对乳房发育产生负面影响(Aly, 2020)。
此外,有女性倾向跨性别者也传言,孕激素对其性欲有促进作用;不过,笔者在一篇文献综述里指出,无论孕酮还是人工孕激素皆不会增加人的性欲(Aly, 2020)。相反,现有证据表明孕激素对性欲无影响或起负面作用——其中负面作用或仅在高剂量下产生(Aly, 2020)。
还有人声称,孕酮也会改善女性倾向跨性别者的情绪;但目前此观点也尚未得到临床证据支持(Coleman et al., 2022; Nolan et al., 2022)。需要指出,有约 30% 的顺性别女性进入黄体期后,由于高孕酮水平所带来的代谢产物:神经甾体(如别孕烷醇酮)的作用,其情绪事实上反而会变差;更有约 2–10% 的女性会因其产生明显不良反应,表现为经期前综合征(PMS)与经前焦虑(PMDD)(Bäckström et al., 2011; Edler Schiller, Schmidt, & Rubinow, 2014; Sundström-Poromaa et al., 2020)。
尚需更多研究来评估孕激素对女性倾向跨性别者的可能益处。
大多数临床应用的孕激素存在脱靶效应(除孕激素活性之外);这些效应可能有益,也可能有害,取决于其在哪方面起作用(Kuhl, 2005; Stanczyk et al., 2013; 维基百科; 表格)。
对于孕酮,其具有神经甾体等各种其它效应,可对中枢神经系统产生影响——人工孕激素并不具备此特性。
对于 MPA、NET 及其衍生物,其具有较弱雄激素效力——这在女性化激素治疗中是不利的。
对于 NET 和某些类似的人工孕激素,其在高剂量下会产生炔雌醇等代谢物,从而产生类似于炔雌醇的雌激素作用——包括血栓和心血管问题的风险。
孕激素的其它脱靶效应包括抗雄激素、糖皮质激素与抗盐皮质激素活性。这些作用具有不同的治疗有效性(如抑制或阻断雄激素)、副作用和健康风险。
值得一提的是,一些人工孕激素并不产生任何有害脱靶效应(即雄激素或糖皮质激素效力);包括 CPA(低剂量下)、屈螺酮(DRSP)、地诺孕素、醋酸诺美孕酮(NOMAC)、地屈孕酮和己酸羟孕酮(OHPC)等。不过,其中只有 CPA 在女性倾向跨性别者当中的使用与研究较多。
在雌激素疗法中加入孕激素,会带来许多不良健康影响,其中包括血栓(维基百科; Aly, 2020)、冠心病(维基百科)与乳腺癌(维基百科; Aly, 2020)等风险的增加。高剂量孕激素也与某些良性脑瘤的风险增加有关,包括脑膜瘤和泌乳素瘤(维基百科; Aly, 2020)。
冠心病风险可能是由于由某些孕激素的弱雄激素活性引起的血脂改变;至于上文提及的其它风险,则可能是由其孕激素活性引起的(Stanczyk et al., 2013; Jiang & Tian, 2017)。
除了健康风险外,孕激素还与不良情绪变化有关;不过,除孕酮及其神经甾体代谢物之外,其它孕激素是否有此影响尚存在争议,缺乏有力证据支持(维基百科; 维基百科)。
除去上述影响后,则孕激素大多具有较好耐受性,副作用也被认为极少。
与人工孕激素不同,天然孕酮无任何不利的脱靶效应;其不具备雄激素效力,不会对血脂有任何不良影响,从而被认为不会引起冠心病风险的增长。在雌激素疗法当中加入口服孕酮,并不会增加血栓风险(维基百科)。
此外,相较于人工孕激素,口服孕酮在短期治疗中有更低的乳腺癌风险;但需要指出,在长期暴露的情况下其风险也不低(维基百科; Aly, 2020)。因此,有学者认为,出于尚未完全阐明的原因,孕酮可能比人工孕激素更为安全;并且其应作为顺性别女性、女性倾向跨性别者的激素治疗当中首选的孕激素。
然而,已有一些理论观点予以反驳。例如,通常剂量下的口服孕酮已知仅可产生很低的孕酮水平,孕激素效力也较弱(Aly, 2018; 维基百科);口服孕酮看似更好的安全性,可能只是由其较低的孕酮水平及孕激素作用剂量所产生的一种假象。
对于足以产生生理、完全孕激素效力的剂量下的非口服形式孕酮,其健康影响迄今尚未被准确评估;其风险应与人工孕激素相似(Aly, 2018; 维基百科)。
由于孕激素对女性化和乳房发育没有确切影响,以及其有已知或潜在的不良反应和风险,目前其在女性化激素治疗中并不常用。当下主流的跨性别健康指南在提及孕激素用于女性倾向跨性别者的情况时指出,现有证据尚较有限;不同指南对此的态度也有分歧:
- 有的明确反对(Coleman et al., 2022—WPATH SOC8);
- 有的持中立意见(Hembree et al., 2017—美国内分泌学会《指南》);
- 有的则持开放态度(Deutsch, 2016—加州大学旧金山分校《指南》)。
然而,有一个非常重要的例外,那就是醋酸环丙孕酮(CPA);作为抗雄制剂,其已广泛用于女性化激素治疗以抑制睾酮分泌,同时在女性倾向跨性别者常用的剂量下也是一种强效孕激素。CPA 将会在下文“抗雄制剂”一章加以讨论。
虽然孕激素有种种健康风险,但顺性别女性体内天然地有孕酮,而其绝对风险在健康的年轻人中非常低。像乳腺癌这样的风险也跟暴露量相关,需要很多年才能形成。而且,孕激素对睾酮的抑制作用对于女性倾向跨性别者应大有裨益;CPA 也因为这点而被广泛使用。考虑到以上因素,如将孕激素治疗时长控制到一定范围(例如在几年内用以抑制睾酮水平,直至切除性腺),对女性倾向跨性别者来说应该足可接受。
女性倾向跨性别者可通过口服、舌下含服、直肠、肌肉/皮下注射等途径使用孕酮(维基百科);而人工孕激素通常用于口服,不过其中某些也以注射剂的形式提供(维基百科)。
口服孕酮
孕酮最常用的途径是口服。口服所用的是一种充满油的胶囊,内含 100 或 200 mg 微粉化孕酮;其品牌包括 Prometrium、Utrogestan 与 Microgest,使用广泛(维基百科)。不过,其引起的孕酮水平已知非常低(100 mg/天剂量下仅有不足 2 ng/mL,或不足 6.4 nmol/L;以标杆性测量方法 LC-MS 检测),不足以在各方面产生满意的孕激素作用(Aly, 2018; 维基百科)。相应地,在顺性别男性当中,口服孕酮即使在高剂量下(400 mg/天)亦未显现抗促性腺激素效力、或对睾酮的抑制作用(Aly, 2018; 维基百科)。这与非口服途径的孕酮、以及人工孕激素形成鲜明对比——它们皆可实实在在地产生与剂量相关的睾酮抑制作用(Aly, 2019; 维基百科)。
除较低孕激素效力以外,口服孕酮还会被过多地代谢成为别孕烷醇酮、孕烷醇酮等神经甾体;这些代谢物作为强效的 γ-氨基丁酸 A 型(GABA-A)受体异构正向调节剂,会产生类似于酒精的不良副作用——包括镇静,认知、记忆与运动障碍,以及情绪变化等(维基百科; 维基百科)。
因此,非口服途径虽有所不便,但却是远优于口服的选项。
舌下含服孕酮
目前,孕酮的舌下含服片剂尚有存世,其以 Luteina 的品牌名上市;但仅于波兰和乌克兰有售(维基百科)。口服孕酮理论上亦可用于舌下含服,与口服雌二醇类似;然而,要含服口服孕酮胶囊里面的油,会很有难度,也不大舒适。
颊部含服的孕酮具有和舌下含服相似的特性,早年曾有相关药物,但如今已然退市(维基百科)。
直肠给药的孕酮
孕酮被批准以栓剂的形式用于直肠给药;其品牌有 Cyclogest(维基百科)。不过,直肠栓剂仅在英国等少数国家上市(维基百科)。
口服孕酮胶囊亦可用于直肠给药(尽管未被正式批准),由于绕过了肝脏首过效应,这样可使得孕酮水平远高于口服。目前这种用法尚未得到正式研究;但是,已有顺性别女性将口服孕酮胶囊用于阴道并取得成功的报道(Miles et al., 1994; Wang et al., 2019);据称直肠给药的药代动力学和阴道给药基本相似(Goletiani, Keith, & Gorsky, 2007; 维基百科)。因此,有充足理论依据表明,口服孕酮胶囊用于直肠会很有效。口服所引起的孕酮水平非常低,相比之下,直肠给药可轻松达到和(女性)正常黄体期相当的孕酮水平(维基百科)。
直肠给药尽管有所不便,但总体看可能是最适合女性倾向跨性别者的孕酮给药途径。已有一小批女性倾向跨性别者以直肠给予孕酮的方式使用孕激素的报道(Chang et al., 2024)。
注射用孕酮
注射用孕酮有以下形式:油溶液(用于肌注;品牌有 Proluton、Progestaject 与 Gestone 等)(维基百科)和水溶液(用于皮下注射;品牌 Prolutex)(维基百科)等。其中孕酮油溶液注射剂在全球范围广泛上市,而水溶液注射剂仅在部分欧洲国家可用(维基百科)。
注射用孕酮(无论何种途径)的作用时间相对较短,每 1–3 天就须注射一次(维基百科; 维基百科);这对大多数人而言过于不便。不同于雌二醇,由于孕酮本身并无任何可供酯化的羟基团,故其无法合成孕酮酯——其本应在注射后具有更长的作用时间(维基百科)。
注射用微晶孕酮水悬浮液曾在早年上市一段时间,其具有 1–2 周的作用时间;但其和注射位点的疼痛相关,最终被停产(Aly, 2019; 维基百科)。
其它给药途径的孕酮
诸如透皮孕酮与皮下植入用的孕酮微球等其它途径也有记载,但未被批量生产,医学上也鲜少使用(维基百科)。这是因为这些途径的孕酮效力较低、很难达到治疗所需的孕酮水平(维基百科; 维基百科)。此外,孕酮微球往往会有相当一部分被挤压出去(维基百科)。无论如何,某些配药房会制作供此类途径使用的孕酮剂型。
口服与注射用人工孕激素
绝大多数人工孕激素制剂以固体片剂的形式供口服(维基百科)。不同于孕酮,这些人工合成物对肝肠的代谢作用有较强抗性,故其口服的生物利用度较高;不仅如此,其几乎——或者完全——不会在肝脏内的孕酮受体表达,也没有任何已知的由孕激素活性对肝脏合成机制产生影响的首过效应,这点与雌激素受体不同(Lax, 1987; Stanczyk, Mathews, & Cortessis, 2017)。因此,口服途径的人工孕激素仅表达孕激素活性,没有任何明显疑点。
不过,有的人工孕激素会于肝脏产生脱靶效应,例如雄激素、雌激素、和/或抗糖皮质激素活性;其会引起非预期的脂质改变与促凝作用等不良反应——其有可能经口服之后的首过效应而加强。
有一批人工孕激素以注射剂的形式提供,用于肌肉或皮下注射(维基百科)。其中包括:醋酸甲羟孕酮(MPA)、庚酸炔诺酮(NETE)、己酸羟孕酮(OHPC)与苯甲孕酮(DHPA)等(维基百科)。除单独使用外,人工孕激素还以注射用复方避孕药的形式与雌二醇酯合用(维基百科)。这些注射剂多被拉丁美洲的女性倾向跨性别者用于激素治疗。
与孕酮仅有数日的作用时间不同,注射用人工孕激素的作用时间可达数周至数个月不等;其注射频次也远小于孕酮(表格)。
补充说明
表 6:可用于女性倾向跨性别者的孕激素形式和推荐剂量
| 药品 | 途径 | 形式 | 剂量 |
|---|---|---|---|
| 孕酮 | 口服 | 充油胶囊 | 100–300 mg 1–2次/天 |
| 直肠给药 | 栓剂; 油剂胶囊 | 100–200 mg 1–2次/天 | |
| 肌肉注射 | 油剂溶液 | 25–75 mg/1–3 天 | |
| 皮下注射 | 水溶液 | 25 mg/天 | |
| 人工孕激素 | 口服; 肌肉或皮下注射 | 片剂; 油溶液; 水溶液 | 各异 |
另可于他处的表格与图表查阅不同形式、途径和剂量的孕酮所引起的孕酮水平[对于口服孕酮仅含 LC-MS 或经层析分离的免疫测定法(IA + CS)的结果]。
与雌二醇一样,孕酮水平在个体间有很大差异。相反,人工孕激素在个体之间产生的差异相对较小。
在切除性腺后,可将孕激素的剂量降低,或调整至接近于女性的正常生理暴露量;亦可完全停用。
抗雄激素制剂介绍
除了雌激素和孕激素外,还有一类用于女性化激素治疗的激素类药物,即抗雄激素制剂 (AA)。这些药物可通过减少雄激素合成、降低雄激素水平,或通过直接阻断雄激素活动,来减少体内雄激素的效力。其作用机制各异,可分为雄激素受体拮抗剂、抗促性腺激素制剂与雄激素合成抑制剂。
雄激素受体拮抗剂可作用于阻断睾酮、双氢睾酮(DHT)等雄激素的生物靶点,直接阻断其作用。它们与雄激素受体结合而不激活,从而阻止雄激素与受体结合。由于其作为雄激素的竞争性阻断剂的机制,其抗雄效力与剂量及睾酮水平高度相关。其并不通过降低睾酮水平来发挥作用——尽管其中某些会有额外的抗雄激素活性、从而使睾酮水平降低。因此,与可降低睾酮水平的抗雄制剂不同,当使用它们时,血检的参考价值可能不大。
雄激素受体拮抗剂种类包括甾体抗雄制剂(SAA),如螺内酯(品牌 Aldactone)和醋酸环丙孕酮(CPA;品牌 Androcur);以及非甾体抗雄制剂(NSAA),如比卡鲁胺(品牌 Casodex/“康士得”)。
抗促性腺激素制剂可通过抑制脑垂体中 GnRH 介导的促性腺激素的分泌,来抑制雄激素的性腺分泌。雌激素和孕激素包含其中。此外,GnRH 激动剂(如亮丙瑞林,品牌 Lupron)和 GnRH 拮抗剂(如恶拉戈利,品牌 Orilissa)的作用与此类似,亦可视为抗促性腺激素制剂。
雄激素合成抑制剂可抑制经酶介导的雄激素合成。它们包括 5α-还原酶抑制剂(5α-RI),如非那雄胺(品牌 Propecia/“保法止”)和度他雄胺(品牌 Avodart/“安福达”);以及 17α-羟化酶/17,20-还原酶抑制剂,如酮康唑(品牌 Nizoral)和醋酸阿比特龙(品牌 Zytiga)。然而,这些药物各有其局限性 (如毒性、高成本、缺少使用经验等),因而未被用于女性化激素治疗。
尽管抗促性腺激素制剂和雄激素合成抑制剂具有继发于雄激素水平下降的抗雄激素作用,但它们通常不被称为“抗雄制剂”;相反,这一称呼基本仅指代雄激素受体拮抗剂。不过这并不妨碍它们也归到抗雄制剂一类。
抗雄制剂可以在性腺切除后停用。但如果在来自性腺的睾酮分泌被完全抑制或去除的情况下,仍出现了痤疮、脂溢性皮炎和脱发等与雄激素相关的症状,则可继续以低剂量雄激素受体拮抗剂(如 100–200 mg/天的螺内酯,或 12.5–25 mg/天的比卡鲁胺)进行治疗。
【表七】 可为女性倾向跨性别者所用的抗雄激素之形式和推荐剂量:
| 药品 | 类型 | 途径 | 形式 | 剂量 |
|---|---|---|---|---|
| 醋酸环丙孕酮 | 孕激素;雄激素受体拮抗剂 | 口服 | 片剂 | 2.5–12.5 mg/天(1) |
| 螺内酯 | 雄激素受体拮抗剂; 弱雄激素合成抑制剂 | 口服 | 片剂 | 100–400 mg/天(2)(3) |
| 比卡鲁胺 | 雄激素受体拮抗剂 | 口服 | 片剂 | 12.5–50 mg/天(2) |
(1) 具体而言,CPA 的剂量范围相当于服四分之一片到一片 10 mg 片剂的量(2.5–10 mg/天);或者每 1–3 日服四分之一片 50 mg 片剂的量(4.2–12.5 mg/天)。其中,5–10 mg/天或 6.25–12.5 mg/天的剂量可确保睾酮抑制效力达到最大;更低剂量下的效力可能稍弱(Aly, 2019)。
(2) 螺内酯与比卡鲁胺的剂量是基于睾酮水平已被大幅抑制(≤200 ng/dL,或 <6.9 nmol/L)的前提下而定;如睾酮水平仍大于该范围,则可能需更大剂量。
(3) 螺内酯及其代谢物的半衰期相对较短,建议每日分两次分量服用(如每日两次 100–200 mg)。\
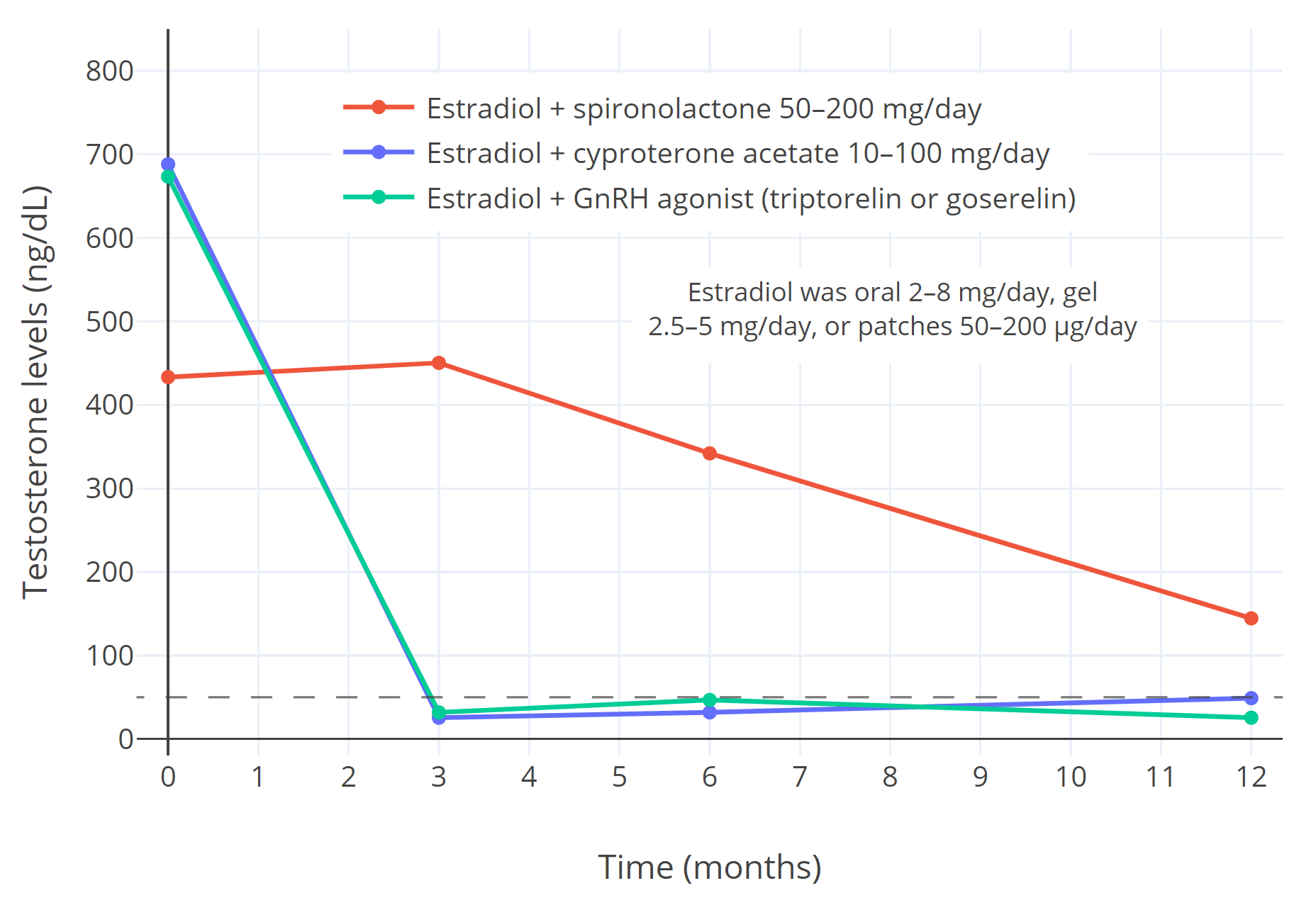
【图三】 在女性倾向跨性别者一年的激素治疗中,使用雌二醇合并不同抗雄制剂时对性腺分泌睾酮的抑制以及总循环睾酮水平(ng/dL)(Sofer et al., 2020)。其中,所用雌二醇包括 2–8 mg/天的口服片剂、2.5–5 mg/天的透皮凝胶与 50–200 μg/天的透皮贴片;所用抗雄制剂包括 50–200 mg/天的螺内酯(红线,n=16)、醋酸环丙孕酮(蓝线,n=41)与 GnRH 激动剂(绿线,n=10;具体为每月注射 3.75 mg 曲普瑞林、或 3.6 mg 戈舍瑞林)(Sofer et al., 2020)。
应当指出,低剂量 CPA(10–12.5 mg/天)的睾酮抑制作用与高剂量(25–100 mg/天)一致,因此不应再使用高剂量(Aly, 2019)。
横向虚线代表女性睾酮水平正常范围的上限。
醋酸环丙孕酮
醋酸环丙孕酮(CPA;品牌 Androcur)是一种孕激素与抗雄制剂。在顺性别女性当中,其作为孕激素广泛用于激素避孕、围绝经期激素疗法等用途。CPA 还作为抗雄制剂用于顺性别女性、顺性别男性改善对雄激素敏感的状况:其可治疗顺性别女性的痤疮、多毛症(面部/身体毛发过度生长)、头皮脱发、由多囊卵巢综合征(PCOS)引起的高雄激素血症等症状;而对于顺性别男性,其可治疗前列腺癌,降低性冲动以控制性欲倒错、性欲亢进、性侵犯等性健康问题。
除顺性别人群之外,CPA 还作为抗雄制剂,广泛用于女性倾向跨性别者的激素治疗。在美国 CPA 尚未上市,使用最多的是螺内酯;不过在美国以外,CPA 的覆盖范围很广;其在欧洲(甚至可能是全球范围内)成了女性倾向跨性别者使用最多的抗雄制剂(T’Sjoen et al., 2019; Glintborg et al., 2021; Coleman et al., 2022)。
CPA 作为抗雄制剂,通过孕激素活性(也起到抗促性腺激素活性)与雄激素受体拮抗效应等两重机制来发挥抑制睾酮水平的作用;不过,CPA 的孕激素效力远高于其雄激素受体拮抗效力(Aly, 2019)。当 CPA 作为孕激素用于顺性别女性时,其剂量约为 2 mg/天;这可产生与黄体期孕酮的生理水平相当的孕激素效力,用途包括抑制促性腺激素的分泌、抑制排卵、转化并保护子宫内膜等(Aly, 2019)。而与此相反,用于改善雄激素相关状况的剂量通常高达 50–300 mg/天;如此高的剂量会导致孕激素摄入高度过量,相关副作用与风险也会变大(Aly, 2019)。
在早年,为女性倾向跨性别者所用的 CPA 剂量为 50–150 mg/天(Aly, 2019);然而,近年来 CPA 剂量已大幅下降,如今已有建议指出其剂量不宜高于 10–12.5 mg/天(Aly, 2019; Coleman et al., 2022—WPATH SOC8)。如此低的 CPA 剂量仍可产生较强孕激素效力,当结合雌二醇使用时,其抑制睾酮水平的有效性与高剂量下一致(Aly, 2019; Meyer et al., 2020; Even Zohar et al., 2021; Kuijpers et al., 2021; Coleman et al., 2022)。甚至以更低的剂量(如 5–6.25 mg/天)也依旧会(在这方面)保持完全效力,目前这方面正受到研究(Aly, 2019)。
未合用雌激素时,CPA 单药在受试者中对睾酮的抑制率通常约可达 50–70%,睾酮水平降至约 150–300 ng/dL(合 5.2–10.4 nmol/L)(Meriggiola et al., 2002; Toorians et al., 2003; Giltay et al., 2004; T’Sjoen et al., 2005; Tack et al., 2017; Zitzmann et al., 2017; Aly, 2019)。而低剂量 CPA 单药(如 10 mg/天)的睾酮抑制率与高剂量单药(如 50–100 mg/天)的一致;这表明,在相对较低的临床剂量下,CPA 足可完全发挥抗促性腺激素效力(Aly, 2019)。此剂量是顺性别女性用以抑制排卵的剂量的 5–10 倍左右——这种与剂量有关的反应在其它孕激素上也同样观测得到(Aly, 2019)。
根据上文,无论何种剂量下,CPA 单药皆无法将睾酮水平抑制到女性正常范围(<50 ng/dL, 或 <1.7 nmol/L);但当与雌二醇合用时,即使雌二醇剂量很低,也可一致地将睾酮水平抑制到女性正常范围内(Aly, 2019; Angus et al., 2019; Gava et al., 2020; Sofer et al., 2020; Collet et al., 2022)。不过,这似乎需要雌二醇水平达到某个最小值(估计平均约为 60 pg/mL,或 220 pmol/L)来实现;如果女性倾向跨性别者使用 CPA 时合并的雌二醇剂量过小,从而使其雌二醇水平偶尔低于上述阈值,那么其睾酮抑制效力有可能达不到完全(Aly, 2019)。
除睾酮抑制作用之外,CPA 还可阻断雄激素受体,强度和剂量相关(Aly, 2019)。不过,要达到明显的雄激素受体拮抗效应,还需要很高的剂量(如 50–300 mg/天);而较低剂量(如 ≤12.5 mg/天)可能无法产生任何有意义的拮抗作用(Aly, 2019)。因此,低剂量 CPA 可认为基本仅有孕激素效力,而其雄激素受体拮抗效力极低以至不显现。从这方面而言,将低剂量 CPA 归为“抗雄制剂”——而非“孕激素”——可能会被认为名不副实。
至于高剂量 CPA(>12.5 mg/天),因其会造成孕激素摄入高度过量,而被认为不再安全,因此不应再用于女性倾向跨性别者。而且,当合用雌二醇与 CPA 时通常足可将睾酮水平抑制到女性正常范围,因此女性倾向跨性别者实际上并不需要其阻断雄激素受体的能力(Aly, 2019)。
CPA 已知会产生多种副作用;其中包括:
- 疲乏与一定程度的体重增长(Belisle & Love, 1986; Hammerstein, 1990; Martinez-Martin et al., 2022);
- 可能一定程度上引起性功能障碍(如性欲降低),甚至大于睾酮抑制的程度(维基百科; Aly, 2019);
- 较小的抑郁风险(维基百科);
- 在女性倾向跨性别者当中,可引起类似妊娠的乳房变化(即乳腺 小叶/小泡的发育)(Kanhai et al., 2000);
- 还有人担忧,过早地引入孕激素——尤其是高剂量 CPA——可能会对乳房发育造成负面影响(Aly, 2020)。但是目前基本没有关于人类的数据证实这点。
CPA 的副作用被认为与剂量相关;为将副作用降至最小,应尽量使用最小有效剂量。
CPA 作为孕激素时,与如下风险有关(即便以极低剂量,如 2 mg/天):
- 乳腺癌风险(Fournier, Berrino, & Clavel-Chapelon, 2008; CGHFBC, 2019; de Blok et al., 2019; Aly, 2020; 维基百科);以及
- 血栓风险(Seaman et al., 2007; Connors & Middeldorp, 2019; Aly, 2020; 维基百科)。
而高剂量 CPA 还会引起以下风险:
- 泌乳素水平升高(Sofer et al., 2020; Wilson et al., 2020; 维基百科);
- 特定的、通常良性的脑瘤,包括:
- 泌乳素瘤(McFarlane, Zajac, & Cheung, 2018; Nota et al., 2018; 维基百科);以及
- 脑膜瘤(McFarlane, Zajac, & Cheung, 2018; Nota et al., 2018; Millward et al., 2021; Weill et al., 2021; Aly, 2020; 维基百科)。
上述风险同样由其孕激素活性引起,且明显与剂量相关,可通过更少的剂量而控制到最小。
- 除孕激素活性以外,还在肝脏内表达很弱、但明显的雄激素效力,从而会对血脂产生不利影响——例如:
- 高密度脂蛋白(HDL;“良性”)胆固醇水平降低(Coleman et al., 2022; 维基百科);
- 长此以往,可能增加冠心病的风险。
- 以不明机理引起的其它潜在不良反应,包括:高血压与胰岛素抗性增强(Martinez-Martin et al., 2022);
还有,在女性倾向跨性别者所用 25–50 mg/天的剂量下,CPA 与肝功能指标异常(转氨酶水平升高)以及罕见的肝毒性相关(Heinemann et al., 1997; Bessone et al., 2016; Kumar et al., 2021; 维基百科; 表格)。如剂量低于 20 mg/天,则肝功能异常与肝毒性的可能性大幅下降(维基百科)。由 CPA 引起的明显肝毒性病例报告迄今已有一百例以上,但其中仅有两例使用 50 mg/天或以下的剂量(维基百科; 表格)。
如以 CPA 进行治疗,宜建议监测泌乳素水平与肝功能,以分别检测泌乳素瘤与肝毒性;同时,如剂量超过 10 mg/天,还建议定期进行核磁共振扫描(MRI)以监测脑膜瘤(Aly, 2020)。
CPA 通常以 10、50、100 mg 等片剂的形式供口服(维基百科)。其也有 300 mg 长效注射剂的形式,在部分国家以品牌 Androcur Depot 上市(维基百科)。不过后者在女性倾向跨性别者当中并不常用,其也会产生极高的 CPA 暴露量。
为使用更低剂量,可用切药器切分 CPA 片剂(如通过 50 mg 片剂实现 12.5 mg 剂量)。
CPA 具有较长的清除半衰期,约达 1.6–4.3 天(维基百科; Aly, 2019)。因此,其可每日一服,需要时还可隔日或每三日一服,来使剂量更小(Aly, 2019)。
如上文所述,CPA 是在正为女性倾向跨性别者所用的较低剂量(如 5–12.5 mg/天)之下也很强力的孕激素。因此,服用 CPA 时无需再加入另一种孕激素(如孕酮),也没有意义——至少如果需要的是孕激素效力的话。服用 CPA 的人常忽视这一点,从而导致更大的开销、副作用与不便,同时却无任何益处可言。
螺内酯
螺内酯是一种抗雄制剂与抗盐皮质激素制剂。在顺性别女性当中,其作为抗雄制剂广泛用于改善与雄激素相关的头发及皮肤状况——如痤疮、多毛症、脱发等,也控制由多囊卵巢综合征(PCOS)引起的高雄激素血症。其也被女性倾向跨性别者用于激素治疗;其在美国是该群体尤其使用最多的抗雄制剂。
螺内酯在医学上最初的主要用途,是作为抗盐皮质激素制剂用于治疗心衰、高血压、醛固酮(盐皮质激素)过多症、低钾血症,以及肾病综合征、腹水等体液潴留过多的状况,等等(维基百科)。
在抗雄激素活性上,螺内酯有较弱的雄激素受体拮抗效力与雄激素合成抑制效力(维基百科)。具体而言,对于后者,其通过对 17α-羟化酶与 17,20-裂解酶的抑制作用来发挥效力(维基百科)。
螺内酯并无明显的孕激素活性、直接雌激素活性,也不会抑制 5α-还原酶(维基百科)。不过,在足够高的剂量下,其抗雄效力可能会间接引起雌激素效力(如乳房发育、女性化等)(维基百科)。
在有关顺性别男性、顺性别女性与女性倾向跨性别者的临床研究中,螺内酯对睾酮水平仅表现出有限、且高度不一致的作用;其中大多数研究未发现睾酮水平的变化,有的发现其降低了,少数研究甚至发现其升高了(Aly, 2018)。尽管如此,上述研究普遍发现,螺内酯在未改变睾酮水平的情况下,仍可产生抗雄效力。因此,螺内酯的抗雄激素作用应主要源于其雄激素受体阻断作用。
有鉴于此,对于以螺内酯作为抗雄制剂使用的女性倾向跨性别者,其处方里可抑制睾酮分泌的可能主要或单纯是雌激素。这部分出自有关女性倾向跨性别者的一些研究,其中有的对比雌二醇单药与同时服用螺内酯的疗法(如 Leinung, 2014; Leinung, Feustel, & Joseph, 2018; Angus et al., 2019),有的对比不同剂量螺内酯下的睾酮水平(如 Liang et al., 2018; SoRelle et al., 2019; Allen et al., 2021)。
对于合用雌二醇与螺内酯的女性倾向跨性别者,由于螺内酯对睾酮分泌的影响甚微,故其睾酮水平往往不会被抑制到女性范围,而仍高于之(例如,其平均值达 50–450 ng/dL,合 1.7–15.6 nmol/L)(Leinung, 2014; Leinung, Feustel, & Joseph, 2018; Liang et al., 2018; Angus et al., 2019; Jain, Kwan, & Forcier, 2019; SoRelle et al., 2019; Sofer et al., 2020; Burinkul et al., 2021)。不过,使用此种处方确实能够让睾酮水平随治疗时间而逐渐下降(如 Liang et al., 2018; Sofer et al., 2020, 图表; Allen et al., 2021)。
螺内酯因其较弱的雄激素受体拮抗效力,故可能很适合阻断处于或略高于女性范围的睾酮水平(如 <100 ng/dL,合 <3.5 nmol/L)(Aly, 2018)。此观点来自两部分研究:一部分为不同剂量的螺内酯(多为 50–200 mg/天)用于健康的、和患有 PCOS 的顺性别女性之临床研究(Goodfellow et al., 1984; Lobo et al., 1985; Hammerstein, 1990; James, Jamerson, & Aguh, 2022);另一部分则将螺内酯与抗雄效力更强的氟他胺进行比较(Cusan et al., 1994; Erenus et al., 1994; Shaw, 1996)。
目前评价螺内酯对女性倾向跨性别者的临床抗雄效力的资料有限,故其不甚明了(Angus et al., 2021)。不管怎样,对于顺性别女性,其在改善与雄激素相关的毛发与皮肤状况上的抗雄效力是有目共睹的;因此只要睾酮水平不高,螺内酯就会很有效(Brown et al., 2009; van Zuuren & Fedorowicz, 2016; Layton et al., 2017; Barrionuevo et al., 2018; James, Jamerson, & Aguh, 2022)。
此外,对于女性倾向跨性别者,高剂量螺内酯(如 300–400 mg/天)可能更有助于阻断较高的睾酮水平;现有的跨性别照护指南也对此予以认可(Aly, 2020)。
对于许多女性倾向跨性别者,雌二醇合并螺内酯的处方并不足以抑制其睾酮,因为螺内酯对睾酮水平的影响有限且高度不稳定,其雄激素受体拮抗效力亦较弱。这样会导致她们的去男性化、女性化、乳房发育等效果不理想。这些效果如使用其它抗雄手段——诸如比卡鲁胺、CPA、GnRH 调节剂与高剂量雌二醇单药疗法等——则应该会更有效;因为这些手段要么可更高效地阻断雄激素,要么可稳定地将睾酮水平降低到女性范围。
如果合用雌二醇与螺内酯时发现睾酮水平依然过高,则应考虑以下选项:换用另一种抗雄制剂;加大雌二醇剂量;或者加入具有抗促性腺激素效力的孕激素(如非口服孕酮,或人工孕激素制剂)。
螺内酯是一种强效的抗盐皮质激素制剂;或者说,盐皮质激素受体拮抗剂(孕酮同样有抗盐皮质激素效力,但远不及螺内酯的高)。这种受体是醛固酮与 11-去氧皮质酮等盐皮质激素的作用靶点,可起到调节电解质与体液平衡等作用。螺内酯可适度降低血压;这可视为其抗盐皮质激素活性所带来的益处之一(Martinez-Martin et al., 2022)。
不过尽管螺内酯的耐受性很高,但其有时会因抗盐皮质激素效力而产生一系列副作用,包括:血压过低、头晕、疲乏、尿频、皮质醇水平升高,等等(Kellner & Wiedemann, 2008; Kim & Del Rosso, 2012; Zaenglein et al., 2016; Layton et al., 2017; James, Jamerson, & Aguh, 2022)。
在跨性别社群中有人表示,螺内酯可能会因为抗盐皮质激素活性与皮质醇水平的升高,而引起内脏脂肪含量的升高;然而,目前尚无证据支持这种假设(Aly, 2020)。现有数据亦不支持螺内酯会阻碍女性倾向跨性别者的乳房发育,或者产生严重的精神神经性副作用(如明显的抑郁情绪)。
螺内酯的最重大风险是高钾血症,这是由其抗盐皮质激素活性导致的(维基百科)。此并发症很罕见,基本仅见于有特定风险因素的人群;但症状严重,会导致住院以至死亡。这些风险因素包括:
- 高年龄(>45 岁);
- 肾功能减退;
- 与其它利钾药物合用——这些药物包括保钾利尿剂(如阿米洛利,品牌有 Midamor;氨苯蝶啶,品牌有 Dyrenium;以及其它抗盐皮质激素制剂),血管紧张素转化酶(ACE)抑制剂,血管紧张素 II 受体阻断剂,甲氧苄啶(一种抗生素;品牌 Bactrim),等等(Kim & Rosso, 2012; Salem et al., 2014);
- 钾补剂或含钾代用盐的服用等。
有一项例子可表明利钾药物的相互作用:在老年群体(>65 岁)当中,同时服用螺内酯与甲氧苄啶可引起严重高钾血症以及猝死(Antoniou et al., 2011; Antoniou et al., 2015)。
建议有上述风险因素的人群,在以螺内酯进行治疗时应监测血钾水平(对于非风险人群应无必要)(Plovanich, Weng, & Mostaghimi, 2015; Zaenglein et al., 2016; Layton et al., 2017; Millington, Liu, & Chan, 2019; Wang & Lipner, 2020; Gupta et al., 2022; Hayes et al., 2022)。
对于有高钾血症风险的人群,通常建议在饮食中限制富钾食品的摄入量(Roscioni et al., 2012; Cupisti et al., 2018)。这也常在跨性别健康话题当中提及,例如女性倾向跨性别者会被告诫“不要吃香蕉”,因为“香蕉富含钾”。然而,通过限制钾的摄入来预防螺内酯引起的高钾血症,仅有理论可能,未被循证医学支持;事实上,现有数据否定了此法的有效性(St-Jules, Goldfarb, & Sevick, 2016; St-Jules & Fouque, 2021; Babich, Kalantar-Zadeh, & Joshi, 2022; St-Jules & Fouque, 2022)。
因此,可能并无必要在服用螺内酯的同时限制钾的日常摄入。
除抗盐皮质激素活性之外,螺内酯被报道还会在患 PCOS 的女性中引起低密度脂蛋白(LDL;“不良”)胆固醇水平的升高,并使得高密度脂蛋白(HDL;“良性”)胆固醇水平降低(Nakhjavani et al., 2009)。然而,相关结果存在分歧,有的研究并未发现螺内酯对胆固醇水平有不利影响(Polyzos et al., 2011)。如这种不良反应持续存在,可能会导致冠心病风险增长。
螺内酯以 25、50、100 mg 等片剂的形式供口服(维基百科)。螺内酯是数种活性代谢物的前体,包括:7α-甲硫基螺内酯、6β-羟基-7α-甲硫基螺内酯、坎利酮(即 7α-脱硫乙酰基-δ6-螺内酯)等;螺内酯及上述三种代谢物的清除半衰期分别为 1.4 小时、13.8 小时、15.0 小时和 16.5 小时(维基百科)。
由于螺内酯及其代谢物维持较高血药水平的时间较短(图表),宜建议每日分两次分量服用,而非每日一次;这样疗效也会更佳(Reiter et al., 2010)。
比卡鲁胺
比卡鲁胺(品牌 Casodex/“康士得”)是一种具有强效、高选择性的雄激素受体拮抗作用的非甾体抗雄制剂(NSAA)(维基百科)。其主要用于治疗顺性别男性的前列腺癌;这种癌对雄激素敏感,因此抗雄制剂有助于减缓其发展;此用途占到了比卡鲁胺处方的绝大部分(维基百科)。 除前列腺癌之外,比卡鲁胺还用于治疗以下症状(尽管效力远不及之)(维基百科):
* 译者注:链接指向的是“家族性男性性早熟”,是外周性早熟的一种。
比卡鲁胺正被越来越多的女性倾向跨性别者用作抗雄制剂(Aly, 2020; 维基百科)。然而,其使用频率仍很有限,一些知名的跨性别照护指南亦未予以推荐(Deutsch, 2016—UCSF 指南; Coleman et al., 2022—WPATH SOC8)、或者仅慎重地允许使用(Thompson et al., 2021—芬威健康版指南);这是因为目前对于比卡鲁胺用于女性倾向跨性别者以及其潜在风险的研究还很稀缺。尽管如此,还是有一批医师正在(或打算)为女性倾向跨性别者开出比卡鲁胺;这批医师人数较少,但正日益增长,且大多在美国。
迄今已有一项小型临床研究评价了比卡鲁胺用于女性倾向跨性别者的状况;具体而言,是作为青春期阻断剂,用于被保险拒绝垫付 GnRH 激动剂费用的 13 名青年女性倾向跨性别者(Neyman, Fuqua, & Eugster, 2019)。(后记:此后陆续有多项评价比卡鲁胺用于女性倾向跨性别者的研究被发表,详见 Aly (2020)。)
比卡鲁胺的雄激素受体拮抗效力远高于螺内酯与 CPA(维基百科; Neyman, Fuqua, & Eugster, 2019)。女性倾向跨性别者通常以 25–50 mg/天的剂量服用——不过此剂量基于主观臆断,而非临床资料。尽管如此,此剂量下的雄激素受体拮抗作用依然较强,与雌二醇合用时亦可高效抑制睾酮,因此对许多女性倾向跨性别者而言是足可用于阻断睾酮的。
根据一些有关比卡鲁胺单药疗法用于患前列腺癌的顺性别男性的研究,在较高剂量下(>50 mg/天),比卡鲁胺可显著阻断处于男性范围的睾酮水平(>300 ng/dL,合 >10.4 nmol/L)(维基百科);这是螺内酯和 CPA 都做不到的。
比卡鲁胺对雄激素受体的选择性很强,其在女性当中未发生任何脱靶激素活性,也几乎不产生任何副作用(维基百科; Erem, 2013; Moretti et al., 2018);在一项严谨的有关比卡鲁胺用于顺性别女性治疗多毛症的临床试验中,其仅引起一项明显副作用,即总胆固醇、LDL(“不良”)胆固醇水平显著升高(Moretti et al., 2018)。因此,比卡鲁胺的耐受性应该是非常好的。其副作用相对较少,与螺内酯、CPA 等抗雄制剂形成鲜明对比——此二者会产生抗盐皮质激素活性、强孕激素活性等脱靶效应,以及相关的副作用与风险。
作为选择性雄激素受体拮抗剂,比卡鲁胺本身并不会使睾酮分泌量或水平降低,反而会使其升高;因为其会中断雄激素受体对促性腺激素分泌的负反馈调节,而(多出来的促性腺激素)会对性腺的睾酮分泌进行补偿性正调节(维基百科)。而比卡鲁胺仍可阻断多出来的这部分睾酮的效力;事实上,其基本不会让睾酮增至超过其阻断能力的水平(维基百科)。此外,如若将比卡鲁胺与一种适当剂量的抗促性腺激素制剂(如雌二醇)合用,则会抹去大部分、乃至全部的睾酮水平增幅(维基百科; 维基百科)。
由于人体内雌二醇由睾酮转化而来,故比卡鲁胺单药亦可维持或增加雌二醇的产量及水平。因此,尽管比卡鲁胺除抗雄效力以外,并无任何明显的固有激素活性,但即使未合用雌激素,其仍会间接产生一定的雌激素效力(包括女性化和乳房发育)(维基百科; 维基百科; Neyman, Fuqua, & Eugster, 2019)。
这点为比卡鲁胺作为青春期阻断剂用于青年女性倾向跨性别者的用途发出很明确的信号:不同于常规的青春期阻断剂(即 GnRH 激动剂),比卡鲁胺并未真正阻断青春期,而会将男性青春期转化为女性青春期(效力依剂量而定)(维基百科; Neyman, Fuqua, & Eugster, 2019)。
比卡鲁胺不易被接受并用于女性化激素治疗的主要原因之一,是其具有一定健康风险;例如,其有较小的肝毒性与肺毒性等风险(Aly, 2020; 维基百科; 维基百科)。
在早期前列腺癌临床试验(EPC)项目当中,跟踪三年后,正进行比卡鲁胺单药合并标准治疗的男性有约 3.4% 出现肝功能指标(LFT)异常,如肝酶及胆红素水平上升;而使用安慰剂(标准疗法)的男性则有约 1.9% 发生异常(维基百科)。
在诸临床试验中,有 0.3–1.5% 的男性因肝功能指标过高、且很可能已造成严重肝毒性,而被迫终止了比卡鲁胺治疗(维基百科)。
截至目前,已有约 10 例由比卡鲁胺引起严重肝毒性、以至死亡的病例被发表——这些病例均为患前列腺癌的男性(维基百科; 表格; Aly, 2020)。此外,还有数例未公开发表的、由比卡鲁胺引起严重肝毒性以至死亡的女性倾向跨性别者病例报告(Aly, 2020)。不过这些报告尚未被确认属实,可能不大可信。除此之外,在美国 FDA 不良反应报告系统(FAERS)的数据库中还记录了数百例服用比卡鲁胺时发生肝脏并发症的病例(维基百科; FDA)。
肝功能异常往往在以比卡鲁胺治疗的初期 3–6 个月里出现(Kolvenbag & Blackledge, 1996; FDA 登记的 Casodex 药品说明书 [译文]);所有由比卡鲁胺引起的肝毒性病例皆在治疗初期 6 个月里便出现相关体征(表格)。
尚未查明比卡鲁胺在临床使用的剂量范围下和肝毒性存在剂量相关性(维基百科);在顺性别女性当中,即使是很低的剂量(如 10–50 mg/天)亦足以引起肝功能异常(发生率 2.9–11.4%)(de Melo Carvalho, 2022)。
出于肝毒性风险的考虑,强烈建议在使用比卡鲁胺时,应定期监测肝功能——尤其是治疗初期 6 个月内。肝毒性的体征包括:恶心、呕吐、腹痛、疲乏、食欲不振、类似流感的症状、小便黄赤、黄疸(皮肤/眼球发黄)等等(维基百科)。
至于其肺毒性风险:比卡鲁胺已知与罕见的间质性肺炎相关,后者可导致肺纤维化、以至死亡;其还与更加罕见的嗜酸性肺炎有关(维基百科; 表格)。截至撰稿时,已有 15 例由比卡鲁胺引起的间质性肺炎、2 例由比卡鲁胺引起的嗜酸性肺炎病例报道;这些病例同样皆为患前列腺癌的男性(表格)。与肝毒性类似的是,还有数百例服用比卡鲁胺时发生间质性肺炎的病例登记于美国 FAERS 数据库(维基百科; FDA)。
据估计,使用比卡鲁胺引起的间质性肺炎发生率约为每万人 1 例;不过考虑到有病例漏报的可能,实际值可能还会更高(维基百科; Ahmad & Graham, 2003)。
对于亚洲人种,服用比卡鲁胺及其它 NSAA 时的肺毒性风险可能更高;已知上述症状的发生率在该人种内远超其他人种(Mahler et al., 1996; Wu et al., 2022)。
目前尚无任何实验室指标可供定期监测比卡鲁胺引起的肺脏改变。肺毒性的体征包括:气短(呼吸困难或局促)、咳嗽、咽喉炎(通常表现为咽痛)等(维基百科)。
除肝毒性及肺毒性之外,比卡鲁胺单药已知在患有前列腺癌的顺性别男性中会引起非前列腺癌原因的死亡风险增长(Iversen et al., 2004; Iversen et al., 2006; Wellington & Keam, 2006; Jia & Spratt, 2022; 维基百科)。这导致对比卡鲁胺用于治疗早期前列腺癌的上市许可被撤销,此后该用途被废弃(维基百科)。比卡鲁胺仍被批准用于晚期前列腺癌的治疗,因为在晚期阶段,比起对非癌症原因死亡的任何不良影响,其抗雄效力所带来的收益要更大。比卡鲁胺引起男性死亡风险增长背后的原理尚不清楚(维基百科)。
比卡鲁胺是否同样会引起女性倾向跨性别者的死亡风险增长,也尚不清楚。由于以下局限,上述研究的结果可能无法推广至女性倾向跨性别者:
- 以上试验中的男性年龄较大,且有基础疾病;
- 试验中使用较高剂量的比卡鲁胺(例如 150 mg/天),治疗时间长(例如 5 年);
- 死亡风险的增长是否与雄激素缺乏或比卡鲁胺的某些药物毒性有关,尚未有定论;
- (受试者)雌二醇水平较低——试验中使用比卡鲁胺单药的男性前列腺癌患者,仅有 30–50 pg/mL(110–184 pmol/L)左右(维基百科)。此水平尽管高于去势后范围,且足以引起相当程度的雌激素效力,但仍低于为女性倾向跨性别者所推荐的激素水平、或者性激素替代可能需要的水平(≥50 pg/mL,合 ≥184 pmol/L)。
无论如何,考虑到比卡鲁胺引起男性前列腺癌患者的死亡风险增长背后的具体原理尚不清楚,且尚无临床安全性资料表明该风险增长与其他人群无关,那么尚不能排除比卡鲁胺可能会引起女性倾向跨性别者的死亡风险增长这一可能性。
比卡鲁胺以 50、150 mg 等片剂的形式供口服(维基百科)。当口服剂量超过 150 mg/天左右时,胃肠道对比卡鲁胺的吸收能力开始饱和,生物利用度逐渐下降;到 300 mg/天以上时,血药水平不再随之上升(维基百科; 图表)。
比卡鲁胺的清除半衰期很长,约达 6–10 天(维基百科; 图表);因此,其无需每日一服,服药频率可放宽至每周两服、以至一服(如果这样更舒适或者有其它需要的话),单次剂量则随之适当加大。
另外,由于半衰期很长,比卡鲁胺需要 4–12 周左右方可完全达到血清水平的稳态;不过,要达到完全稳态水平的 50% 左右仅需不足一周,而达到稳态水平的 80–90% 左右则需 3–4 周(维基百科; 图表; 维基百科)。如果需要,可在开始服用比卡鲁胺时采用较大的负荷剂量,以更快达到稳态。
动物实验曾表明,比卡鲁胺不会突破血脑屏障(即不会阻断大脑中的雄激素受体),因而是选择性作用于外周的(维基百科)。然而,后续的临床研究发现其不适用于人类:比卡鲁胺明确作用于人类中枢神经系统以介导抗雄效力(维基百科)。
诸如氟他胺(品牌 Eulexin)和尼鲁米特(品牌 Anandron, Nilandron)等推出更早的 NSAA,具有远高于比卡鲁胺的风险,故不应为女性倾向跨性别者所用。其中,尼鲁米特在早年多项研究里是作为抗雄制剂用于女性倾向跨性别者的,但因其肺毒性发生率很高,且其它副作用明显,故此后不再沿用(Aly, 2020; 维基百科; 维基百科)。而氟他胺也曾作为抗雄制剂有限应用于女性倾向跨性别者;但因其引起肝毒性的风险远甚于比卡鲁胺,且有其它诸多副作用和不足,故如今不应再使用(Aly, 2020; 维基百科)。
近年推出的其它强效 NSAA,如恩杂鲁胺(品牌 Xtandi)、阿帕鲁胺(品牌 Erleada)与达洛鲁胺(品牌 Nubeqa)等,亦各具风险,且至今基本仅用于、或被研究用于前列腺癌。
5α-还原酶抑制剂
睾酮可在体内某些组织通过 5α-还原酶转化为二氢睾酮(DHT)(Swerdloff et al., 2017);DHT 是睾酮的一种代谢物,其雄激素活性比睾酮高出数倍。人体内有 5α-还原酶的组织有限,主要包括皮肤、毛囊和前列腺。虽然 DHT 的效力高于睾酮,但它鲜少进入到血液循环并发挥作用(Horton, 1992; Swerdloff et al., 2017);相反,睾酮是主要的循环雄激素,而 DHT 的作用被认为主要通过在特定组织内部由睾酮代谢并增强而来。
5α-还原酶抑制剂(5α-RI),如非那雄胺(品牌 Proscar, Propecia)、度他雄胺(品牌 Avodart)等可抑制 5α-还原酶,从而阻止睾酮转化为 DHT 的过程;这使得 DHT 的循环和组织内水平明显下降。由于 DHT 在组织内的作用是一种媒介、而非循环激素,因此 5α-RI 的抗雄激素效力有限。这体现在它们在顺性别男性中的耐受性很好,且未引起明显的去男性化作用(Hirshburg, 2016)。
5α-RI 的医学用途主要限于治疗脱发,以及女性的多毛症和男性的前列腺肥大。其也有可能治疗女性痤疮,但相关证据非常稀缺(维基百科)。出于以上特质,5α-RI 并不适合作为一般的抗雄制剂用于女性倾向跨性别者。
此外,对女性倾向跨性别者的激素治疗而言,在抑制睾酮分泌、使睾酮水平下降的同时,DHT 水平也会一并下降;如睾酮水平已处于女性范围,那么此时再服用 5α-RI,应当说用处不大,而且也无必要(Gooren et al., 2016; Irwig, 2020; Prince & Safer, 2020; Glintborg et al., 2021);不管怎样,如果有持续的体毛生长或脱发,那么 5α-RI 对其应该有用——这点已为顺性别女性所佐证(Barrionuevo et al., 2018; Prince & Safer, 2020)。然而,需要指出,有证据表明雄激素受体拮抗剂对这类情况的有效性更佳(van Zuuren et al., 2015);这点是显而易见的,因为雄激素受体拮抗剂可同时阻断睾酮和 DHT 作用,而 5α-RI 仅阻止睾酮到 DHT 的转化过程。因此,尽管 5α-RI 可大幅降低以至清除 DHT、从而仅发挥抗雄效力,但其并不会降低睾酮水平、反而会使其升高。
5α-还原酶有三种亚型。度他雄胺可抑制 5α-还原酶的所有三种亚型,而非那雄胺只抑制其中的两种。因此,度他雄胺是一种完全性高于非那雄胺的 5α-RI。
度他雄胺可使血液中的 DHT 水平降低 98%,而非那雄胺仅可降低约 65–70%。鉴于几乎所有循环 DHT 都来自外周组织的合成过程,这些降幅表明组织中 DHT 的产生也在减少(Horton, 1992)。已知度他雄胺治疗男性脱发的有效性高于非那雄胺,这于上述发现吻合(Zhou et al., 2018; Dhurat et al., 2020; 维基百科)。
出于上述原因,尽管非那雄胺和度他雄胺都很有效,但如要使用 5α-RI,应优先考虑度他雄胺 (Zhou et al., 2018; Dhurat et al., 2020)。
对于女性倾向跨性别者,5α-RI 有一项潜在不良影响:在睾酮分泌未被充分抑制的情况下,其可能会一定程度上增加循环睾酮水平(Leinung, Feustel, & Joseph, 2018; Aly, 2019; Traish et al., 2019; Irwig, 2020; Glintborg et al., 2021)。
在有睾丸、但睾酮水平低于男性正常范围的受试者当中,DHT 可明显增加对脑垂体促性腺激素分泌的负反馈作用(Traish et al., 2019)。这对女性倾向跨性别者的治疗意义(如有)尚不明确。
5α-RI 还有另一个潜在不良作用:其不仅抑制 DHT 的产生,还会抑制某些神经甾体的产生。神经甾体是作用于神经系统——特别是大脑——的一种甾体激素。被 5α-RI 抑制合成的神经甾体包括:别孕烷醇酮(由孕酮形成)与 3α-雄烯二酮(由睾酮和 DHT 衍生)。研究表明,这些神经甾体在情绪、焦虑、压力等认知/情感过程中具有重要的生物调控作用(King, 2013)。已知 5α-RI 与轻微的抑郁风险有关,这可能与上述吻合(Welk et al., 2018; Deng et al., 2020; Dyson, Cantrell, & Lund, 2020; Nguyen et al., 2020; 维基百科)。
此外还有一些说法,认为 5α-RI 有其它更显著、更持久的副作用,称为“非那雄胺戒断综合症”(PFS)(Traish, 2020);然而,其基于低质量报道而得,存在争议(Fertig et al., 2016; Rezende, Dias, & Trüeb, 2018)。
反安慰剂效应也可能导致了对 5α-RI 之副作用的看法恶化(Kuhl & Wiegratz, 2017; Maksym et al., 2019)。
临床剂量范围研究发现,即使以低于常规的剂量,非那雄胺和度他雄胺仍可相当程度或接近最大程度地抑制 5α-还原酶(Gormley et al., 1990; Vermeulen et al., 1991; Sudduth & Koronkowski, 1993; Drake et al., 1999; Roberts et al., 1999; Clark et al., 2004; Frye, 2006; Olsen et al., 2006; Harcha et al., 2014; Kuhl & Wiegratz, 2017)。
例如,在一项使用非那雄胺的研究中,(血清)DHT 水平在 0.05 mg/天、0.2 mg/天、1 mg/天和 5 mg/天的剂量下分别下降 49.5%、68.6%、71.4% 和 72.2%;在头皮内亦观测到了 DHT 水平的同步降低(Drake et al., 1999)。
在另一项使用度他雄胺的研究中,(血清)DHT 水平在 0.05 mg/天、0.5 mg/天、2.5 mg/天和 5 mg/天的剂量下分别下降 52.9%、94.7%、97.7% 和 98.4% (Clark et al., 2004)。
基于上述结果,如果需要,或许可在较低剂量下服用 5α-RI,以便节约药费。非那雄胺片剂可被切分来减小剂量。度他雄胺无法照做,因为其剂型是油胶囊;不过其半衰期很长,故可通过减少用药频率(如每几日一服)来减小剂量。
5α-还原酶抑制剂以片剂和胶囊的形式供口服。此外也有非那雄胺的外用 复合剂型;不过需要注意,这种剂型已知会导致摄入过量,且其对全身 DHT 的抑制作用与口服剂型相当(Marks et al., 2020)。另一方面,浓度更低的非那雄胺外用制剂可能会更多地选择性作用于局部(Marks et al., 2020)。
【表八】 可用于女性倾向跨性别者的 5α-还原酶抑制剂和推荐剂量:
| 药品 | 途径 | 形式 | 剂量 |
|---|---|---|---|
| 度他雄胺 | 口服 | 胶囊 | 0.05–2.5 mg/天 |
| 非那雄胺 | 口服 | 片剂 | 0.05–5 mg/天 |
GnRH 激动剂和拮抗剂
GnRH 激动剂和拮抗剂(GnRHa),又称 GnRH 受体激动剂/拮抗剂或 GnRH 调节剂,是抗雄制剂的一类;通过阻断 GnRH 在脑垂体的作用、从而抑制 LH 和 FSH 的分泌,来发挥抗雄效力。
通常来说,受体激动剂会激活受体,而受体拮抗剂阻断受体、使其无法被激活;不过 GnRH 激动剂与拮抗剂对脑垂体的作用竟完全一致。这是由一种生理怪象所致——即在通常生理条件下,GnRH 是间歇性分泌的,但当脑垂体中的 GnRH 受体被外源性激动剂非自然地持续激活时,其敏感度会大幅降低、以至不再被激活。因此,GnRH 激动剂与拮抗剂均可起到停止性激素从性腺的分泌之作用;在有睾酮的人群中,其皆可将睾酮水平降至去势或女性正常范围(<50 ng/dL 或 <1.7 nmol/L)。GnRHa 有些像是可逆的去势手段,因此有时也被称为“药物去势”。
GnRHa 在与雌激素合并服用以防止性激素不足时,基本上不存在任何已知副作用或风险;因此,GnRHa 是最适合女性倾向跨性别者使用的抗雄制剂。
GnRHa 广泛用于阻断青少年跨性别者的青春期。不过遗憾的是,其费用非常高昂(可达每年一万美元左右),而成年跨性别者往往会被医疗保险拒绝垫付其费用;因此 GnRHa 目前并不常为成年女性倾向跨性别者所用。
英国在这方面属于例外:在此所有的一种甾体激素成年跨性别者所用 GnRH 激动剂皆可得到英国全民医疗服务(NHS)的垫付。布舍瑞林亦属于例外:近年来,在部分东欧国家的网上药店已可用非常低廉的价格购得其鼻腔喷雾剂(品牌 Suprefact)(Aly, 2018)。
GnRH 激动剂在治疗开始时会引起睾酮水平的短暂暴涨,直至脑垂体的 GnRH 受体脱敏(维基百科)。在治疗头一周左右,睾酮水平会增加 1.5–2 倍,此后开始下降;一般在 2–4 周内可达到去势或女性范围(维基百科)。
和激动剂相反的是,GnRH 拮抗剂并不会引起睾酮水平的暴涨,后者自服药起便开始下降,数日内即达到去势范围(维基百科; 图表);这是因为,其不会在一开始激活 GnRH 受体,而会持续阻断,从而无需等待受体敏感度下降。
如需要防止或削弱开始服用 GnRH 激动剂时引起的睾酮水平暴涨,可使用抗促性腺激素制剂(如雌激素、孕激素),或者强效的雄激素受体拮抗剂(如比卡鲁胺)(维基百科)。
GnRH 激动剂与拮抗剂的种类及用法有:
- 布舍瑞林、戈舍瑞林、亮丙瑞林与曲普瑞林——必须每天,或每 1–6 个月经皮下或肌肉注射一次,取决于剂型;
- 组胺瑞林与亮丙瑞林——通过手术植入,每年一次;
- 布舍瑞林与那法瑞林——以鼻腔喷雾的形式使用,每日 2–3 次。
【表九】 可用于女性倾向跨性别者的 GnRH 激动剂和推荐剂量:
| 药品 | 品牌 | 途径 | 形式 | 剂量 |
|---|---|---|---|---|
| 布舍瑞林 | Suprefact 等 | 皮下注射 | 溶剂 | 200 μg/天(1) |
| 植入体 | 6.3 mg/两个月; 9.45 mg/三个月 | |||
| 鼻腔 | 喷雾 | 400 µg 3次/天(2)(3) | ||
| 戈舍瑞林 | Zoladex | 皮下注射 | 植入体 | 3.6 mg/月; 10.8 mg/三个月 |
| 组胺瑞林 | Supprelin LA, Vantas | 皮下植入 | 植入体 | 50 mg/年 |
| 亮丙瑞林 | Lupron 等 | 肌肉注射 | 溶液 | 1 mg/天 |
| Eligard、Lupron Depot 等 | 肌肉/皮下注射 | 悬浮液 | 3.75–7.5 mg/月; 11.25–22.5 mg/三个月; 30 mg/四个月; 45 mg/六个月 | |
| Viadur | 皮下植入 | 植入体 | 65 mg/年 | |
| 那法瑞林 | Synarel | 鼻腔 | 喷雾 | 400–600 μg 2–3次/天 |
| 曲普瑞林 | Decapeptyl, Trelstar Depot/LA | 肌肉注射 | 悬浮液 | 3.75 mg/月; 11.25 mg/三个月 |
(1) 第一周每日三次 500 μg,之后 200 μg/天。
(2) 第一周每日三次 800 μg,之后每日三次 400 μg。
(3) 可用每日两次 500 μg 替代,但效力更低;睾酮水平降低 70%(至约 180 ng/dL 或 6.2 nmol/L)而非 90%。数据引自有关布舍瑞林治疗前列腺癌的现有研究结果(Aly, 2018; 维基百科)。
【表十】 可用于女性倾向跨性别者的 GnRH 拮抗剂和推荐剂量:
| 药品 | 品牌 | 途径 | 形式 | 剂量 |
|---|---|---|---|---|
| 阿巴瑞克 (Abarelix) | Plenaxis | 肌肉注射 | 悬浮液 | 113 mg/月 |
| 地加瑞克 (Degarelix) | Firmagon | 皮下注射 | 溶液 | 80 mg/月(1) |
| 恶拉戈利 (Elagolix) | Orilissa | 口服 | 片剂 | 150–200 mg 1–2x/天(2) |
| 瑞卢戈利 (Relugolix) | Relumina | 口服 | 片剂 | 20–120 mg/天(3) |
(1) 第一个月使用 240 mg,此后每月 80 mg。
(2) 每日一次 150 mg 并不及每日两次 200 mg 有效(后者在顺性别女性中可最大程度地抑制性激素从性腺的分泌)(维基百科)。
(3) 在 80–120 mg/天的剂量下可最大程度地抑制性激素从性腺的分泌;而 20–40 mg/天的抑制作用较大、但不充分(MacLean et al., 2015; DailyMed)。
其它激素类药物
雄激素和蛋白同化激素
除了雌激素、孕激素和抗雄制剂外,雄激素/蛋白同化激素(AAS)有时也被用于女性化激素治疗中;这是当睾酮水平较低(例如低于女性平均水平 30 ng/dL,或 1.0 nmol/L),需要雄激素替代时所用。
有人提出,适当水平的睾酮可能会带来一些好处,如增加性欲、改善情绪和活力、对皮肤健康和皮下脂肪团产生积极影响(Avram, 2004),以及增加肌肉尺寸和力量等(Huang & Basaria, 2017)。然而,目前没有足够的临床证据支持上述益处;而且雄激素可在顺性别女性当中产生一系列不良效应,包括痤疮、多毛症、脱发与男性化等(维基百科)。
尽管如此,如女性倾向跨性别者需要采取雄激素替代治疗,那么可选用睾酮及睾酮酯、脱氢表雄酮(DHEA)、诺龙及诺龙酯(如癸酸诺龙,ND(Aly, 2020; 表格))等等。
治疗过程中的健康监测
接受激素治疗的女性倾向跨性别者应定期接受验血等方式,以评价治疗有效性、并监测治疗安全性。其中应监测的有:
- 血清雌二醇水平和总睾酮水平——评价治疗的有效性(即激素水平是否处于顺性别女性的正常范围),并确定是否需要调整用药。
可以监测的有:
- 游离睾酮、游离雌二醇、雌酮 (E1)、双氢睾酮 (DHT)、促黄体激素 (LH)、促卵泡激素 (FSH) 和 性激素结合球蛋白 (SHBG) 的血清水平——并非绝对必要,但可提供额外参考信息。
- 血清孕酮水平——如使用孕酮治疗,可以此观察到孕酮暴露量如何。
- 激素治疗引起的物理改变,如乳房发育及其它女性化状况(有不同物理手段和电子探测手段)(如 维基百科)。
另针对不同用药情况,还需定期监测的有:
- 血清肝功能指标,例如天冬氨酸转氨酶(AST)、谷丙转氨酶(ALT)水平等——在使用比卡鲁胺或高剂量 CPA(≥20 mg/天)时,用以监测肝毒性。
- 血钾水平——在服用螺内酯、且有高钾血症相关风险因素时需要(Plovanich, Weng, & Mostaghimi, 2015; Zaenglein et al., 2016; Layton et al., 2017; Millington, Liu, & Chan, 2019; Wang & Lipner, 2020; Gupta et al., 2022; Hayes et al., 2022)。
- 血清泌乳素水平——在服用高剂量雌激素或孕激素(尤其是 CPA)时,用以监测高泌乳素血症与泌乳素瘤(Callen-Lorde, 2018; Iwamoto et al., 2019)。
- 核磁共振扫描(MRI)——在服用高剂量 CPA(>12.5 mg/天)时,用以监测脑膜瘤的发展(Aly, 2020)。
如以上指标出现异常,应视其状况与严重性,降低用药剂量或者停用特定药物、以其它药物替代。
某些治疗状况可能导致验血结果不准确。例如,当使用口服孕酮时,以免疫法测定的孕酮水平会错误地偏高,因为此法会与孕酮的代谢物(如别孕烷醇酮)发生交叉反应;故其不宜采用,而应改用基于质谱的测定法(Aly, 2018; 维基百科)。不过,如使用非口服途径的孕酮,那么两种测定法皆适用于孕酮水平的测定。
此外,服用高剂量生物素(即维生素 B7)补剂会对免疫法测定激素水平的准确性造成干扰,使结果错误偏低或偏高(Samarasinghe et al., 2017; Avery, 2019; Bowen et al., 2019; FDA, 2019; Luong, Male, & Glennon, 2019)。
又如,透皮雌二醇剂型用于手臂时,可对自同一侧手臂采集的血液造成污染,并使得雌二醇水平测量值错误偏高(Vihtamäkia, Luukkaala, & Tuimala, 2004)。
某些癌症已知对激素敏感,其发生率也会受激素治疗影响。在此建议女性倾向跨性别者进行乳腺癌与前列腺癌的筛查(Sterling & Garcia, 2020; Iwamoto et al., 2021)。
其中,乳腺癌风险会随女性化激素治疗(可能尤其是孕激素的使用)而大幅上升;不过,此风险依然会低于顺性别女性(Aly, 2020)。
而前列腺癌的发生率会因女性倾向跨性别者的激素治疗引起雄激素缺少而显著下降,不过该风险未完全消除,仍有发生的可能(de Nie et al., 2020)。前列腺不会随阴道再造术而摘除,因此即使在术后也需对前列腺癌进行监测。
睾丸癌未被发现对激素敏感;在接受激素治疗的女性倾向跨性别者当中,其发生率并不会提高(Bensley et al., 2021; de Nie et al., 2021; Jacoby et al., 2021)。
参考文献
- Abbott Laboratories. (2009). Estradiol. Architect System. Abbott Park, Illinois/Wiesbaden, Germany: Abbott Laboratories. [PDF]
- Ahmad, S. R., & Graham, D. J. (2003). Pneumonitis with Antiandrogens. Annals of Internal Medicine, 139(6), 528–529. [DOI:10.7326/0003-4819-139-6-200309160-00023]
- Allen, A. N., Jiao, R., Day, P., Pagels, P., Gimpel, N., & SoRelle, J. A. (2020). Dynamic Impact of Hormone Therapy on Laboratory Values in Transgender Patients over Time. The Journal of Applied Laboratory Medicine, 6(1), 27–40. [DOI:10.1093/jalm/jfaa192]
- Angus, L., Leemaqz, S., Ooi, O., Cundill, P., Silberstein, N., Locke, P., Zajac, J. D., & Cheung, A. S. (2019). Cyproterone acetate or spironolactone in lowering testosterone concentrations for transgender individuals receiving oestradiol therapy. Endocrine Connections, 8(7), 935–940. [DOI:10.1530/ec-19-0272]
- Angus, L. M., Nolan, B. J., Zajac, J. D., & Cheung, A. S. (2020). A systematic review of antiandrogens and feminization in transgender women. Clinical Endocrinology, 94(5), 743–752. [DOI:10.1111/cen.14329]
- Antoniou, T., Gomes, T., Mamdani, M. M., Yao, Z., Hellings, C., Garg, A. X., Weir, M. A., & Juurlink, D. N. (2011). Trimethoprim-sulfamethoxazole induced hyperkalaemia in elderly patients receiving spironolactone: nested case-control study. BMJ, 343, d5228. [DOI:10.1136/bmj.d5228]
- Antoniou, T., Hollands, S., Macdonald, E. M., Gomes, T., Mamdani, M. M., & Juurlink, D. N. (2015). Trimethoprim–sulfamethoxazole and risk of sudden death among patients taking spironolactone. Canadian Medical Association Journal, 187(4), E138–E143. [DOI:10.1503/cmaj.140816]
- Aufrère, M. B., & Benson, H. (1976). Progesterone: An overview and recent advances. Journal of Pharmaceutical Sciences, 65(6), 783–800. [DOI:10.1002/jps.2600650602]
- Avery, G. (2019). Biotin interference in immunoassay: a review for the laboratory scientist. Annals of Clinical Biochemistry: International Journal of Laboratory Medicine, 56(4), 424–430. [DOI:10.1177/0004563219842231]
- Avram, M. M. (2004). Cellulite: a review of its physiology and treatment. Journal of Cosmetic and Laser Therapy, 6(4), 181–185. [DOI:10.1080/14764170410003057]
- Babich, J. S., Kalantar-Zadeh, K., & Joshi, S. (2022). Taking the Kale out of Hyperkalemia: Plant Foods and Serum Potassium in Patients With Kidney Disease. Journal of Renal Nutrition, 32(6), 641–649. [DOI:10.1053/j.jrn.2022.01.013]
- Bäckström, T., Haage, D., Löfgren, M., Johansson, I., Strömberg, J., Nyberg, S., Andréen, L., Ossewaarde, L., van Wingen, G., Turkmen, S., & Bengtsson, S. (2011). Paradoxical effects of GABA-A modulators may explain sex steroid induced negative mood symptoms in some persons. Neuroscience, 191, 46–54. [DOI:10.1016/j.neuroscience.2011.03.061]
- Barrionuevo, P., Nabhan, M., Altayar, O., Wang, Z., Erwin, P. J., Asi, N., Martin, K. A., & Murad, M. H. (2018). Treatment Options for Hirsutism: A Systematic Review and Network Meta-Analysis. The Journal of Clinical Endocrinology & Metabolism, 103(4), 1258–1264. [DOI:10.1210/jc.2017-02052]
- Bazarra-Castro, M. A. (2009). Etiological aspects, therapy regimes, side effects and treatment satisfaction of transsexual patients. (Doctoral dissertation, Ludwig Maximilian University of Munich.) [DOI:10.5282/edoc.9984] [URN:urn:nbn:de:bvb:19-99840] [PDF]
- Belisle, S., & Love, E. J. (1986). Clinical efficacy and safety of cyproterone acetate in severe hirsutism: results of a multicentered Canadian study. Fertility and Sterility, 46(6), 1015–1020. [DOI:10.1016/s0015-0282(16)49873-0]
- Ben Salem, C., Badreddine, A., Fathallah, N., Slim, R., & Hmouda, H. (2014). Drug-Induced Hyperkalemia. Drug Safety, 37(9), 677–692. [DOI:10.1007/s40264-014-0196-1]
- Bensley, J. G., Cheung, A. S., Grossmann, M., & Papa, N. (2022). Testicular Cancer in Trans People Using Feminising Hormone Therapy–A Brief Review. Urology, 160, 1–4. [DOI:10.1016/j.urology.2021.11.014]
- Bessone, F., Lucena, M., Roma, M. G., Stephens, C., Medina-Cáliz, I., Frider, B., Tsariktsian, G., Hernández, N., Bruguera, M., Gualano, G., Fassio, E., Montero, J., Reggiardo, M. V., Ferretti, S., Colombato, L., Tanno, F., Ferrer, J., Zeno, L., Tanno, H., & Andrade, R. J. (2015). Cyproterone acetate induces a wide spectrum of acute liver damage including corticosteroid-responsive hepatitis: report of 22 cases. Liver International, 36(2), 302–310. [DOI:10.1111/liv.12899]
- Boogers, L. S., Sardo Infirri, S. A., Bouchareb, A., Dijkman, B. A., Helder, D., de Blok, C. J., Liberton, N. P., den Heijer, M., van Trotsenburg, A. S., Dreijerink, K. M., Wiepjes, C. M., & Hannema, S. E. (2025). Variations in Volume: Breast Size in Trans Women in Relation to Timing of Testosterone Suppression. The Journal of Clinical Endocrinology & Metabolism, 110(5), e1404–e1410. [DOI:10.1210/clinem/dgae573]
- Bowen, R., Benavides, R., Colón-Franco, J. M., Katzman, B. M., Muthukumar, A., Sadrzadeh, H., Straseski, J., Klause, U., & Tran, N. (2019). Best practices in mitigating the risk of biotin interference with laboratory testing. Clinical Biochemistry, 74, 1–11. [DOI:10.1016/j.clinbiochem.2019.08.012]
- Brown, J., Farquhar, C., Lee, O., Toomath, R., & Jepson, R. G. (2009). Spironolactone versus placebo or in combination with steroids for hirsutism and/or acne. Cochrane Database of Systematic Reviews, 2009(2), CD000194. [DOI:10.1002/14651858.cd000194.pub2]
- Burinkul, S., Panyakhamlerd, K., Suwan, A., Tuntiviriyapun, P., & Wainipitapong, S. (2021). Anti-Androgenic Effects Comparison Between Cyproterone Acetate and Spironolactone in Transgender Women: A Randomized Controlled Trial. The Journal of Sexual Medicine, 18(7), 1299–1307. [DOI:10.1016/j.jsxm.2021.05.003]
- Callen-Lorde Community Health Center. (2018). Protocols for the Provision of Hormone Therapy. New York City: Callen-Lorde Community Health Center. [URL] [PDF]
- Cappelletti, M., & Wallen, K. (2016). Increasing women’s sexual desire: The comparative effectiveness of estrogens and androgens. Hormones and Behavior, 78, 178–193. [DOI:10.1016/j.yhbeh.2015.11.003]
- Carmina, E., Stanczyk, F. Z., & Lobo, R. A. (2019). Evaluation of Hormonal Status. In Strauss, J. F., & Barbieri, R. L. (Eds.). Yen and Jaffe’s Reproductive Endocrinology: Physiology, Pathophysiology, and Clinical Management, 8th Edition (pp. 887–915.e4). Philadelphia: Elsevier. [DOI:10.1016/b978-0-323-47912-7.00034-2]
- Carr, B. R. (1993). The Ovary. In Carr, B. R., & Blackwell, R. E. (Eds.). Textbook of Reproductive Medicine, 1st Edition (pp. 183–207). Norwalk, Connecticut: Appleton & Lange. [Google 学术] [Google 阅读] [OpenLibrary] [WorldCat] [Archive.org—2nd edition]
- Carvalho, R. d., Santos, L. D., Ramos, P. M., Machado, C. J., Acioly, P., Frattini, S. C., Barcaui, C. B., Donda, A. L., & Melo, D. F. (2022). Bicalutamide and the new perspectives for female pattern hair loss treatment: What dermatologists should know. Journal of Cosmetic Dermatology, 21(10), 4171–4175. [DOI:10.1111/jocd.14773]
- Chang, J. J., Tran, N. K., Flentje, A., Lubensky, M. E., Obedin-Maliver, J., Lunn, M. R., & Ariel, D. (2024). 12330 Progestogen Experience And Perception Among Transfeminine Adults - A National Survey. Journal of the Endocrine Society, 8(Suppl 1), bvae163.1657. [DOI:10.1210/jendso/bvae163.1657]
- Clark, R. V., Hermann, D. J., Cunningham, G. R., Wilson, T. H., Morrill, B. B., & Hobbs, S. (2004). Marked Suppression of Dihydrotestosterone in Men with Benign Prostatic Hyperplasia by Dutasteride, a Dual 5α-Reductase Inhibitor. The Journal of Clinical Endocrinology & Metabolism, 89(5), 2179–2184. [DOI:10.1210/jc.2003-030330]
- Coleman, E., Radix, A. E., Bouman, W. P., Brown, G. R., de Vries, A. L., Deutsch, M. B., Ettner, R., Fraser, L., Goodman, M., Green, J., Hancock, A. B., Johnson, T. W., Karasic, D. H., Knudson, G. A., Leibowitz, S. F., Meyer-Bahlburg, H. F., Monstrey, S. J., Motmans, J., Nahata, L., … & Arcelus, J. (2022). [World Professional Association for Transgender Health (WPATH)] Standards of Care for the Health of Transgender and Gender Diverse People, Version 8. International Journal of Transgender Health, 23(Suppl 1), S1–S259. [DOI:10.1080/26895269.2022.2100644] [URL] [PDF]
- Collaborative Group on Hormonal Factors in Breast Cancer. (2019). Type and timing of menopausal hormone therapy and breast cancer risk: individual participant meta-analysis of the worldwide epidemiological evidence. The Lancet, 394(10204), 1159–1168. [DOI:10.1016/s0140-6736(19)31709-x]
- Collet, S., Gieles, N. C., Wiepjes, C. M., Heijboer, A. C., Reyns, T., Fiers, T., Lapauw, B., den Heijer, M., & T’Sjoen, G. (2022). Changes in Serum Testosterone and Adrenal Androgen Levels in Transgender Women With and Without Gonadectomy. The Journal of Clinical Endocrinology & Metabolism, 108(2), 331–338. [DOI:10.1210/clinem/dgac576]
- Colonnello, E., Graziani, A., Rossetti, R., Voltan, G., Masi, D., Lubrano, C., Mariani, S., Watanabe, M., Isidori, A. M., Ferlin, A., & Gnessi, L. (2025). The Chronobiology of Hormone Administration: “Doctor, What Time Should I Take My Medication?”. Endocrine Reviews, bnaf013. [DOI:10.1210/endrev/bnaf013]
- Connors, J. M., & Middeldorp, S. (2019). Transgender patients and the role of the coagulation clinician. Journal of Thrombosis and Haemostasis, 17(11), 1790–1797. [DOI:10.1111/jth.14626]
- Cupisti, A., Kovesdy, C., D’Alessandro, C., & Kalantar-Zadeh, K. (2018). Dietary Approach to Recurrent or Chronic Hyperkalaemia in Patients with Decreased Kidney Function. Nutrients, 10(3), 261–261. [DOI:10.3390/nu10030261]
- Cusan, L., Dupont, A., Gomez, J., Tremblay, R. R., & Labrie, F. (1994). Comparison of flutamide and spironolactone in the treatment of hirsutism: a randomized controlled trial. Fertility and Sterility, 61(2), 281–287. [DOI:10.1016/s0015-0282(16)56518-2]
- de Blok, C. J., Wiepjes, C. M., Nota, N. M., van Engelen, K., Adank, M. A., Dreijerink, K. M., Barbé, E., Konings, I. R., & den Heijer, M. (2019). Breast cancer risk in transgender people receiving hormone treatment: nationwide cohort study in the Netherlands. BMJ, 365, l1652. [DOI:10.1136/bmj.l1652]
- de Blok, C. J., Dijkman, B. A., Wiepjes, C. M., Staphorsius, A. S., Timmermans, F. W., Smit, J. M., Dreijerink, K. M., & den Heijer, M. (2021). Sustained Breast Development and Breast Anthropometric Changes in 3 Years of Gender-Affirming Hormone Treatment. The Journal of Clinical Endocrinology & Metabolism, 106(2), e782–e790. [DOI:10.1210/clinem/dgaa841]
- de Nie, I., de Blok, C. J., van der Sluis, T. M., Barbé, E., Pigot, G. L., Wiepjes, C. M., Nota, N. M., van Mello, N. M., Valkenburg, N. E., Huirne, J., Gooren, L. J., van Moorselaar, R. J., Dreijerink, K. M., & den Heijer, M. (2020). Prostate Cancer Incidence under Androgen Deprivation: Nationwide Cohort Study in Trans Women Receiving Hormone Treatment. The Journal of Clinical Endocrinology & Metabolism, 105(9), e3293–e3299. [DOI:10.1210/clinem/dgaa412]
- Deng, T., Duan, X., He, Z., Zhao, Z., & Zeng, G. (2020). Association Between 5-Alpha Reductase Inhibitor Use and The Risk of Depression: A Meta-Analysis. Urology Journal, 18(2), 144–150. [DOI:10.22037/uj.v16i7.5866]
- Deutsch, M. B. (2016). Overview of feminizing hormone therapy. In Deutsch, M. B. (Ed.). Guidelines for the Primary and Gender-Affirming Care of Transgender and Gender Nonbinary People, 2nd Edition (pp. 26–48). San Francisco: University of California, San Francisco/UCSF Transgender Care. [URL] [PDF]
- Dhurat, R., Sharma, A., Rudnicka, L., Kroumpouzos, G., Kassir, M., Galadari, H., Wollina, U., Lotti, T., Golubovic, M., Binic, I., Grabbe, S., & Goldust, M. (2020). 5‐Alpha reductase inhibitors in androgenetic alopecia: Shifting paradigms, current concepts, comparative efficacy, and safety. Dermatologic Therapy, 33(3), e13379. [DOI:10.1111/dth.13379]
- Drake, L., Hordinsky, M., Fiedler, V., Swinehart, J., Unger, W. P., Cotterill, P. C., Thiboutot, D. M., Lowe, N., Jacobson, C., Whiting, D., Stieglitz, S., Kraus, S. J., Griffin, E. I., Weiss, D., Carrington, P., Gencheff, C., Cole, G. W., Pariser, D. M., Epstein, E. S., Tanaka, W., Dallob, A., Vandormael, K., Geissler, L., & Waldsteicher, J. (1999). The effects of finasteride on scalp skin and serum androgen levels in men with androgenetic alopecia. Journal of the American Academy of Dermatology, 41(4), 550–554. [DOI:10.1016/s0190-9622(99)80051-6]
- Dyson, T. E., Cantrell, M. A., & Lund, B. C. (2020). Lack of Association between 5α-Reductase Inhibitors and Depression. Journal of Urology, 204(4), 793–798. [DOI:10.1097/ju.0000000000001079]
- Erem, C. (2013). Update on idiopathic hirsutism: diagnosis and treatment. Acta Clinica Belgica, 68(4), 268–274. [DOI:10.2143/acb.3267]
- Erenus, M., Gürbüz, O., Durmuşoğlu, F., Demirçay, Z., & Pekin, S. (1994). Comparison of the efficacy of spironolactone versus flutamide in the treatment of hirsutism. Fertility and Sterility, 61(4), 613–616. [DOI:10.1016/s0015-0282(16)56634-5]
- Esoterix/LabCorp. (2020). Endocrinology Expected Values and S.I. Unit Conversion Tables. LabCorp/Endocrine Sciences. [PDF]
- Even Zohar, N., Sofer, Y., Yaish, I., Serebro, M., Tordjman, K., & Greenman, Y. (2021). Low-Dose Cyproterone Acetate Treatment for Transgender Women. The Journal of Sexual Medicine, 18(7), 1292–1298. [DOI:10.1016/j.jsxm.2021.04.008]
- Fertig, R., Shapiro, J., Bergfeld, W., & Tosti, A. (2016). Investigation of the Plausibility of 5-Alpha-Reductase Inhibitor Syndrome. Skin Appendage Disorders, 2(3–4), 120–129. [DOI:10.1159/000450617]
- Food and Drug Administration. (2019). UPDATE: The FDA Warns that Biotin May Interfere with Lab Tests: FDA Safety Communication. Food and Drug Administration. [URL]
- Fournier, A., Berrino, F., & Clavel-Chapelon, F. (2007). Unequal risks for breast cancer associated with different hormone replacement therapies: results from the E3N cohort study. Breast Cancer Research and Treatment, 107(1), 103–111. [DOI:10.1007/s10549-007-9523-x]
- Frye, S. (2006). Discovery and Clinical Development of Dutasteride, a Potent Dual 5α-Reductase Inhibitor. Current Topics in Medicinal Chemistry, 6(5), 405–421. [DOI:10.2174/156802606776743101]
- Gava, G., Mancini, I., Alvisi, S., Seracchioli, R., & Meriggiola, M. C. (2020). A comparison of 5-year administration of cyproterone acetate or leuprolide acetate in combination with estradiol in transwomen. European Journal of Endocrinology, 183(6), 561–569. [DOI:10.1530/eje-20-0370]
- Getzenberg, R., & Itty, S. (2020). How do we define “castration” in men on androgen deprivation therapy? Asian Journal of Andrology, 22(5), 441–446. [DOI:10.4103/aja.aja_139_19]
- Giltay, E. J., Gooren, L. J., Toorians, A. W., Katan, M. B., & Zock, P. L. (2004). Docosahexaenoic acid concentrations are higher in women than in men because of estrogenic effects. The American Journal of Clinical Nutrition, 80(5), 1167–1174. [DOI:10.1093/ajcn/80.5.1167]
- Glintborg, D., T’Sjoen, G., Ravn, P., & Andersen, M. S. (2021). MANAGEMENT OF ENDOCRINE DISEASE: Optimal feminizing hormone treatment in transgender people. European Journal of Endocrinology, 185(2), R49–R63. [DOI:10.1530/eje-21-0059]
- Goletiani, N. V., Keith, D. R., & Gorsky, S. J. (2007). Progesterone: Review of safety for clinical studies. Experimental and Clinical Psychopharmacology, 15(5), 427–444. [DOI:10.1037/1064-1297.15.5.427]
- Goodfellow, A., Alaghband-Zadeh, J., Carter, G., Cream, J., Holland, S., Scully, J., & Wise, P. (1984). Oral spironolactone improves acne vulgaris and reduces sebum excretion. British Journal of Dermatology, 111(2), 209–214. [DOI:10.1111/j.1365-2133.1984.tb04045.x]
- Gooren, L. J. (2016). The Endocrinology of Sexual Behavior and Gender Identity. In Jameson, J. L., & De Groot, L. J. (Eds.). Endocrinology: Adult and Pediatric, 7th Edition, Volume 2 (pp. 2163–2176.e4). Philadelphia: Saunders/Elsevier. [Google 阅读] [DOI:10.1016/B978-0-323-18907-1.00124-4]
- Gooren, L. J., Harmsen-Louman, W., & Kessel, H. (1985). Follow-up of prolactin levels in long-term oestrogen-treated male-to-female transsexuals with regard to prolactinoma induction. Clinical Endocrinology, 22(2), 201–207. [DOI:10.1111/j.1365-2265.1985.tb01081.x]
- Gooren, L., Rao, B., van Kessel, H., & Harmsen-Louman, W. (1984). Estrogen positive feedback on LH secretion in transsexuality. Psychoneuroendocrinology, 9(3), 249–259. [DOI:10.1016/0306-4530(84)90004-0]
- Gormley, G. J., Stoner, E., Rittmaster, R. S., Gregg, H., Thompson, D. L., Lasseter, K. C., Vlasses, P. H., & Stein, E. A. (1990). Effects of Finasteride (MK-906), a 5_α_-Reductase Inhibitor, on Circulating Androgens in Male Volunteers. The Journal of Clinical Endocrinology & Metabolism, 70(4), 1136–1141. [DOI:10.1210/jcem-70-4-1136]
- Grock, S., Weinreb, J., Williams, K. C., Weimer, A., Fadich, S., Patel, R., Geft, A., & Korenman, S. (2024). Priorities for efficacy trials of gender-affirming hormone therapy with estrogen: collaborative design and results of a community survey. Hormones, online ahead of print. [DOI:10.1007/s42000-024-00532-3]
- Gubelin Harcha, W., Barboza Martínez, J., Tsai, T., Katsuoka, K., Kawashima, M., Tsuboi, R., Barnes, A., Ferron-Brady, G., & Chetty, D. (2014). A randomized, active- and placebo-controlled study of the efficacy and safety of different doses of dutasteride versus placebo and finasteride in the treatment of male subjects with androgenetic alopecia. Journal of the American Academy of Dermatology, 70(3), 489–498.e3. [DOI:10.1016/j.jaad.2013.10.049]
- Gupta, P., Suppakitjanusant, P., Stevenson, M., Goodman, M., & Tangpricha, V. (2022). Potassium Concentrations in Transgender Women Using Spironolactone: A Retrospective Chart Review. Endocrine Practice, 28(11), 1113–1117. [DOI:10.1016/j.eprac.2022.08.007]
- Hammerstein, J. (1990). Antiandrogens: Clinical Aspects. In Orfanos, C. E., & Happle, R. (Eds.). Hair and Hair Diseases (pp. 827–886). Berlin/Heidelberg: Springer. [DOI:10.1007/978-3-642-74612-3_35]
- Hayes, H., Russell, R., Haugen, A., Nagavally, S., & Sarvaideo, J. (2022). The Utility of Monitoring Potassium in Transgender, Gender Diverse, and Nonbinary Individuals on Spironolactone. Journal of the Endocrine Society, 6(11), bvac133. [DOI:10.1210/jendso/bvac133]
- Heinemann, L. A., Will-Shahab, L., van Kesteren, P., Gooren, L. J., & (1997). Safety of Cyproterone Acetate: Report of Active Surveillance. Pharmacoepidemiology and Drug Safety, 6(3), 169–178. [DOI:10.1002/(sici)1099-1557(199705)6:3<169::aid-pds263>3.0.co;2-3]
- Hembree, W. C., Cohen-Kettenis, P. T., Gooren, L., Hannema, S. E., Meyer, W. J., Murad, M. H., Rosenthal, S. M., Safer, J. D., Tangpricha, V., & T’Sjoen, G. G. (2017). Endocrine Treatment of Gender-Dysphoric/Gender-Incongruent Persons: An Endocrine Society Clinical Practice Guideline. The Journal of Clinical Endocrinology and Metabolism, 102(11), 3869–3903. [DOI:10.1210/jc.2017-01658] [PDF]
- Herndon, J. S., Maheshwari, A. K., Nippoldt, T. B., Carlson, S. J., Davidge-Pitts, C. J., & Chang, A. Y. (2023). Comparison of the Subcutaneous and Intramuscular Estradiol Regimens as Part of Gender-Affirming Hormone Therapy. Endocrine Practice, 29(5), 356–361. [DOI:10.1016/j.eprac.2023.02.006]
- Hirshburg, J. M., Kelsey, P. A., Therrien, C. A., Gavino, A. C., & Reichenberg, J. S. (2016). Adverse Effects and Safety of 5-alpha Reductase Inhibitors (Finasteride, Dutasteride): A Systematic Review. The Journal of Clinical and Aesthetic Dermatology, 9(7), 56–62. [PubMed] [PubMed Central]
- Hopkins, U., & Arias, C. Y. (2013). Large-volume IM injections: a review of best practices. Oncology Nurse Advisor, 4(1), 32–37. [Google 学术] [URL] [PDF]
- Horton, R. (1992). Dihydrotestosterone Is a Peripheral Paracrine Hormone. Journal of Andrology, 13(1), 23–27. [DOI:10.1002/j.1939-4640.1992.tb01621.x]
- Huang, G., & Basaria, S. (2017). The Case for Androgens in Menopausal Women: When and How? In Pal, L., & Sayegh, R. A. (Eds.). Essentials of Menopause Management: A Case-Based Approach (pp. 173–196). Cham: Springer International Publishing. [DOI:10.1007/978-3-319-42451-4_10]
- Igo, J., & Visram, H. (2021). Testosterone Suppression With Injectable Estrogen Therapy Alone in Male to Female Transgender Patients. Canadian Journal of Diabetes, 45(7 Suppl), S40–S40 (abstract no. 114). [DOI:[10.1016/j.jcjd.2021.09.124][doi-c39b6ca1]] [URL]
- Irwig, M. S. (2020). Is there a role for 5α‐reductase inhibitors in transgender individuals? Andrology, 9(6), 1729–1731. [DOI:10.1111/andr.12881]
- Iversen, P., Johansson, J. E., Lodding, P., Lukkarinen, O., Lundmo, P., Klarskov, P., Tammela, T. L., Tasdemir, I., Morris, T., Carroll, K., & Scandinavian Prostatic Cancer Group. (2004). Bicalutamide (150 mg) versus placebo as immediate therapy alone or as adjuvant to therapy with curative intent for early nonmetastatic prostate cancer: 5.3-year median followup from the Scandinavian Prostate Cancer Group Study Number 6. The Journal of Urology, 172(5 Part 1), 1871–1876. [DOI:10.1097/01.ju.0000139719.99825.54]
- Iversen, P., Johansson, J., Lodding, P., Kylmälä, T., Lundmo, P., Klarskov, P., Tammela, T. L., Tasdemir, I., Morris, T., Armstrong, J., & (2006). Bicalutamide 150 mg in addition to standard care for patients with early non-metastatic prostate cancer Updated results from the Scandinavian Prostate Cancer Period Group-6 Study after a median follow-up period of 7.1 years. Scandinavian Journal of Urology and Nephrology, 40(6), 441–452. [DOI:10.1080/00365590601017329]
- Iwamoto, S. J., Defreyne, J., Rothman, M. S., Van Schuylenbergh, J., Van de Bruaene, L., Motmans, J., & T’Sjoen, G. (2019). Health considerations for transgender women and remaining unknowns: a narrative review. Therapeutic Advances in Endocrinology and Metabolism, 10, 204201881987116. [DOI:10.1177/2042018819871166]
- Iwamoto, S. J., Grimstad, F., Irwig, M. S., & Rothman, M. S. (2021). Routine Screening for Transgender and Gender Diverse Adults Taking Gender-Affirming Hormone Therapy: a Narrative Review. Journal of General Internal Medicine, 36(5), 1380–1389. [DOI:10.1007/s11606-021-06634-7]
- Jacoby, A., Rifkin, W., Zhao, L. C., & Bluebond-Langner, R. (2020). Incidence of Cancer and Premalignant Lesions in Surgical Specimens of Transgender Patients. Plastic & Reconstructive Surgery, 147(1), 194–198. [DOI:10.1097/prs.0000000000007452]
- Jain, J., Kwan, D., & Forcier, M. (2019). Medroxyprogesterone Acetate in Gender-Affirming Therapy for Transwomen: Results From a Retrospective Study. The Journal of Clinical Endocrinology & Metabolism, 104(11), 5148–5156. [DOI:10.1210/jc.2018-02253]
- James, J. F., Jamerson, T. A., & Aguh, C. (2022). Efficacy and safety profile of oral spironolactone use for androgenic alopecia: A systematic review. Journal of the American Academy of Dermatology, 86(2), 425–429. [DOI:10.1016/j.jaad.2021.07.048]
- Jia, A. Y., & Spratt, D. E. (2022). Bicalutamide Monotherapy With Radiation Therapy for Localized Prostate Cancer: A Non-Evidence-Based Alternative. International Journal of Radiation Oncology*Biology*Physics, 113(2), 316–319. [DOI:10.1016/j.ijrobp.2022.01.037]
- Jiang, Y., & Tian, W. (2017). The effects of progesterones on blood lipids in hormone replacement therapy. Lipids in Health and Disease, 16(1), 219. [DOI:10.1186/s12944-017-0612-5]
- Kanhai, R. C., Hage, J. J., van Diest, P. J., Bloemena, E., & Mulder, J. W. (2000). Short-Term and Long-Term Histologic Effects of Castration and Estrogen Treatment on Breast Tissue of 14 Male-to-Female Transsexuals in Comparison With Two Chemically Castrated Men. The American Journal of Surgical Pathology, 24(1), 74–80. [DOI:10.1097/00000478-200001000-00009]
- Kellner, M., & Wiedemann, K. (2008). Mineralocorticoid receptors in brain, in health and disease: Possibilities for new pharmacotherapy. European Journal of Pharmacology, 583(2–3), 372–378. [DOI:10.1016/j.ejphar.2007.07.072]
- Kim, G. K., & Del Rosso, J. Q. (2012). Oral Spironolactone in Post-teenage Female Patients with Acne Vulgaris: Practical Considerations for the Clinician Based on Current Data and Clinical Experience. The Journal of Clinical and Aesthetic Dermatology, 5(3), 37–50. [PubMed] [PubMed Central]
- King, S. R. (2012). Neurosteroids and the Nervous System. In King, S. R. Neurosteroids and the Nervous System (pp. 1–122). New York: Springer New York. [DOI:10.1007/978-1-4614-5559-2_1]
- Kolvenbag, G. J., & Blackledge, G. R. (1996). Worldwide activity and safety of bicalutamide: a summary review. Urology, 47(1), 70–79. [DOI:10.1016/s0090-4295(96)80012-4]
- Krishnamurthy, N., Slack, D., Kyweluk, M., Kirkley, J., Trakhtenberg, E., Contreras-Castro, F., & Safer, J. (2023). Not All Transfeminine Individuals on Estradiol Can Reach Both Target Testosterone and Target Estradiol Levels—Time to Revisit Treatment Guidelines? USPATH Scientific Symposium, November 1-5, 2023, The Westin Westminster, Westminster, Colorado, Abstract Submissions, 94–94 (abstract no. SAT-B2-T4). [研讨会日程] [PDF] [摘要全书]
- Kuhl, H. (2003). Östrogene für den Mann? [Estrogen for men?] Blickpunkt der Mann, 1(3), 6–12. [Google 学术] [URL] [PDF]
- Kuhl, H. (2005). Pharmacology of estrogens and progestogens: influence of different routes of administration. Climacteric, 8(Suppl 1), 3–63. [DOI:10.1080/13697130500148875] [PDF]
- Kuhl, H., & Wiegratz, I. (2017). Das Post-Finasterid-Syndrom. [Post Finasteride Syndrome.] Gynäkologische Endokrinologie, 15(2), 153–163. [DOI:10.1007/s10304-017-0126-2]
- Kuijpers, S. M., Wiepjes, C. M., Conemans, E. B., Fisher, A. D., T’Sjoen, G., & den Heijer, M. (2021). Toward a Lowest Effective Dose of Cyproterone Acetate in Trans Women: Results From the ENIGI Study. The Journal of Clinical Endocrinology & Metabolism, 106(10), e3936–e3945. [DOI:10.1210/clinem/dgab427]
- Kumar, P., Reddy, S., Kulkarni, A., Sharma, M., & Rao, P. N. (2021). Cyproterone Acetate–Induced Acute Liver Failure: A Case Report and Review of the Literature. Journal of Clinical and Experimental Hepatology, 11(6), 739–741. [DOI:10.1016/j.jceh.2021.01.003]
- Lauritzen, C. (1988). Natürliche und synthetische Sexualhormone – Biologische Grundlagen und Behandlungsprinzipien. [Natural and Synthetic Sexual Hormones – Biological Basis and Medical Treatment Principles.] In Lauritzen, C., Schneider, H. P. G., & Nieschlag, E. (Eds.). Grundlagen und Klinik der Menschlichen Fortpflanzung [Foundations and Clinic of Human Reproduction] (pp. 229–306). Berlin: de Gruyter. [Google 学术] [Google 阅读] [OpenLibrary] [WorldCat] [URL] [PDF] [英译文]
- Lax, E. (1987). Mechanisms of physiological and pharmacological sex hormone action on the mammalian liver. Journal of Steroid Biochemistry, 27(4–6), 1119–1128. [DOI:10.1016/0022-4731(87)90198-1]
- Layton, A. M., Eady, E. A., Whitehouse, H., Del Rosso, J. Q., Fedorowicz, Z., & van Zuuren, E. J. (2017). Oral Spironolactone for Acne Vulgaris in Adult Females: A Hybrid Systematic Review. American Journal of Clinical Dermatology, 18(2), 169–191. [DOI:10.1007/s40257-016-0245-x]
- Legro, R. S., Schlaff, W. D., Diamond, M. P., Coutifaris, C., Casson, P. R., Brzyski, R. G., Christman, G. M., Trussell, J. C., Krawetz, S. A., Snyder, P. J., Ohl, D., Carson, S. A., Steinkampf, M. P., Carr, B. R., McGovern, P. G., Cataldo, N. A., Gosman, G. G., Nestler, J. E., Myers, E. R., Santoro, N., Eisenberg, E., Zhang, M., & Zhang, H. (2010). Total Testosterone Assays in Women with Polycystic Ovary Syndrome: Precision and Correlation with Hirsutism. The Journal of Clinical Endocrinology & Metabolism, 95(12), 5305–5313. [DOI:10.1210/jc.2010-1123]
- Leinung, M. C. (2014). Variable Response to Oral Estradiol Therapy in Male to Female Transgender Patients. Endocrine Reviews, 35(Suppl 1) [Endocrine Society’s 96th Annual Meeting and Expo, June 21–24, 2014 – Chicago], ?–? (abstract no. OR42-1). [Google 学术] [DOI:10.1093/edrv/35.supp.1] [DOI:10.1210/endo-meetings.2014.RE.2.OR42-1] [URL] [MedPage Today]
- Leinung, M. C., Feustel, P. J., & Joseph, J. (2018). Hormonal Treatment of Transgender Women with Oral Estradiol. Transgender Health, 3(1), 74–81. [DOI:10.1089/trgh.2017.0035]
- Liang, J. J., Jolly, D., Chan, K. J., & Safer, J. D. (2018). Testosterone Levels Achieved by Medically Treated Transgender Women in a United States Endocrinology Clinic Cohort. Endocrine Practice, 24(2), 135–142. [DOI:10.4158/ep-2017-0116]
- Lobo, R. A., Shoupe, D., Serafini, P., Brinton, D., & Horton, R. (1985). The effects of two doses of spironolactone on serum androgens and anagen hair in hirsute women. Fertility and Sterility, 43(2), 200–205. [DOI:10.1016/s0015-0282(16)48373-1]
- Loh, H. H., Yee, A., Loh, H. S., Kanagasundram, S., Francis, B., & Lim, L. (2020). Sexual dysfunction in polycystic ovary syndrome: a systematic review and meta-analysis. Hormones, 19(3), 413–423. [DOI:10.1007/s42000-020-00210-0]
- Luong, J. H., Male, K. B., & Glennon, J. D. (2019). Biotin interference in immunoassays based on biotin-strept(avidin) chemistry: An emerging threat. Biotechnology Advances, 37(5), 634–641. [DOI:10.1016/j.biotechadv.2019.03.007]
- MacLean, D. B., Shi, H., Faessel, H. M., & Saad, F. (2015). Medical Castration Using the Investigational Oral GnRH Antagonist TAK-385 (Relugolix): Phase 1 Study in Healthy Males. The Journal of Clinical Endocrinology & Metabolism, 100(12), 4579–4587. [DOI:10.1210/jc.2015-2770]
- Mahler, C. (1996). A Review of the Clinical Studies with Nilutamide. In Denis, L. (Ed.). Antiandrogens in Prostate Cancer: A Key to Tailored Endocrine Treatment (ESO Monographs) (pp. 105–111). Berlin/Heidelberg: Springer Berlin Heidelberg. [DOI:10.1007/978-3-642-45745-6_10]
- Maksym, R. B., Kajdy, A., & Rabijewski, M. (2019). Post-finasteride syndrome – does it really exist? The Aging Male, 22(4), 250–259. [DOI:10.1080/13685538.2018.1548589]
- Marks, D. H., Prasad, S., De Souza, B., Burns, L. J., & Senna, M. M. (2019). Topical Antiandrogen Therapies for Androgenetic Alopecia and Acne Vulgaris. American Journal of Clinical Dermatology, 21(2), 245–254. [DOI:10.1007/s40257-019-00493-z]
- Martinez-Martin, F. J., Kuzior, A., Hernandez-Lazaro, A., de Leon-Durango, R. J., Rios-Gomez, C., Santana-Ojeda, B., Perez-Rivero, J. M., Fernandez-Trujillo-Comenge, P. M., Gonzalez-Diaz, P., Arnas-Leon, C., Acosta-Calero, C., Perdomo-Herrera, E., Tocino-Hernandez, A. L., del Sol Sanchez-Bacaicoa, M., & del Pino Perez-Garcia, M. (2022). Incidence of hypertension in young transgender people after a 5-year follow-up: association with gender-affirming hormonal therapy. Hypertension Research, 46(1), 219–225. [DOI:10.1038/s41440-022-01067-z]
- Masumori, N., Baba, T., Abe, T., & Niwa, K. (2021). What is the most anticipated change induced by treatment using gender‐affirming hormones in individuals with gender incongruence?. International Journal of Urology, 28(5), 526–529. [DOI:10.1111/iju.14499]
- McFarlane, T., Zajac, J. D., & Cheung, A. S. (2018). Gender-affirming hormone therapy and the risk of sex hormone-dependent tumours in transgender individuals—A systematic review. Clinical Endocrinology, 89(6), 700–711. [DOI:10.1111/cen.13835]
- Meriggiola, M. C., Bremner, W. J., Costantino, A., Bertaccini, A., Morselli-Labate, A. M., Huebler, D., Kaufmann, G., Oettel, M., & Flamigni, C. (2002). Twenty-One Day Administration of Dienogest Reversibly Suppresses Gonadotropins and Testosterone in Normal Men. The Journal of Clinical Endocrinology & Metabolism, 87(5), 2107–2113. [DOI:10.1210/jcem.87.5.8514]
- Meyer, G., Mayer, M., Mondorf, A., Flügel, A. K., Herrmann, E., & Bojunga, J. (2020). Safety and rapid efficacy of guideline-based gender-affirming hormone therapy: an analysis of 388 individuals diagnosed with gender dysphoria. European Journal of Endocrinology, 182(2), 149–156. [DOI:10.1530/eje-19-0463]
- Miles, R. A., Paulson, R. J., Lobo, R. A., Press, M. F., Dahmoush, L., & Sauer, M. V. (1994). Pharmacokinetics and endometrial tissue levels of progesterone after administration by intramuscular and vaginal routes: a comparative study. Fertility and Sterility, 62(3), 485–490. [DOI:10.1016/s0015-0282(16)56935-0]
- Millington, K., Liu, E., & Chan, Y. (2019). The Utility of Potassium Monitoring in Gender-Diverse Adolescents Taking Spironolactone. Journal of the Endocrine Society, 3(5), 1031–1038. [DOI:10.1210/js.2019-00030]
- Millward, C. P., Keshwara, S. M., Islim, A. I., Jenkinson, M. D., Alalade, A. F., & Gilkes, C. E. (2022). Development and Growth of Intracranial Meningiomas in Transgender Women Taking Cyproterone Acetate as Gender-Affirming Progestogen Therapy: A Systematic Review. Transgender Health, 7(6), 473–483. [DOI:10.1089/trgh.2021.0025]
- Moretti, C., Guccione, L., Di Giacinto, P., Simonelli, I., Exacoustos, C., Toscano, V., Motta, C., De Leo, V., Petraglia, F., & Lenzi, A. (2017). Combined Oral Contraception and Bicalutamide in Polycystic Ovary Syndrome and Severe Hirsutism: A Double-Blind Randomized Controlled Trial. The Journal of Clinical Endocrinology & Metabolism, 103(3), 824–838. [DOI:10.1210/jc.2017-01186]
- Nakamoto, J. (2016). Endocrine Testing. In Jameson, J. L., & De Groot, L. J. (Eds.). Endocrinology: Adult and Pediatric, 7th Edition (pp. 2655–2688.e1). Philadelphia: Saunders/Elsevier. [DOI:10.1016/B978-0-323-18907-1.00154-2]
- Nakhjavani, M., Hamidi, S., Esteghamati, A., Abbasi, M., Nosratian-Jahromi, S., & Pasalar, P. (2009). Short term effects of spironolactone on blood lipid profile: a 3-month study on a cohort of young women with hirsutism. British Journal of Clinical Pharmacology, 68(4), 634–637. [DOI:10.1111/j.1365-2125.2009.03483.x]
- Neyman, A., Fuqua, J. S., & Eugster, E. A. (2019). Bicalutamide as an Androgen Blocker With Secondary Effect of Promoting Feminization in Male-to-Female Transgender Adolescents. Journal of Adolescent Health, 64(4), 544–546. [DOI:10.1016/j.jadohealth.2018.10.296]
- Nguyen, D., Marchese, M., Cone, E. B., Paciotti, M., Basaria, S., Bhojani, N., & Trinh, Q. (2021). Investigation of Suicidality and Psychological Adverse Events in Patients Treated With Finasteride. JAMA Dermatology, 157(1), 35–42. [DOI:10.1001/jamadermatol.2020.3385]
- Nie, I., Wiepjes, C. M., Blok, C. J., Moorselaar, R. J., Pigot, G. L., Sluis, T. M., Barbé, E., Voorn, P., Mello, N. M., Huirne, J., & Heijer, M. (2021). Incidence of testicular cancer in trans women using gender‐affirming hormonal treatment: a nationwide cohort study. BJU International, 129(4), 491–497. [DOI:10.1111/bju.15575]
- Nieschlag, E., Zitzmann, M., & Kamischke, A. (2003). Use of progestins in male contraception. Steroids, 68(10–13), 965–972. [DOI:10.1016/s0039-128x(03)00135-1]
- Nieschlag, E. (2010). Clinical trials in male hormonal contraception. Contraception, 82(5), 457–470. [DOI:10.1016/j.contraception.2010.03.020]
- Nieschlag, E., & Behre, H. M. (2012). The essential role of testosterone in hormonal male contraception. In Nieschlag, E., Behre, H. M., & Nieschlag, S. (Eds.). Testosterone: Action · Deficiency · Substitution, 4th Edition (pp. 470–493). Cambridge/New York: Cambridge University Press. [DOI:10.1017/cbo9781139003353.023]
- Nishiyama, T. (2014). Serum testosterone levels after medical or surgical androgen deprivation: A comprehensive review of the literature. Urologic Oncology: Seminars and Original Investigations, 32(1), 38.e17–38.e28. [DOI:10.1016/j.urolonc.2013.03.007]
- Nolan, B. J., & Cheung, A. S. (2021). Relationship Between Serum Estradiol Concentrations and Clinical Outcomes in Transgender Individuals Undergoing Feminizing Hormone Therapy: A Narrative Review. Transgender Health, 6(3), 125–131. [DOI:10.1089/trgh.2020.0077]
- Nolan, B. J., Frydman, A. S., Leemaqz, S. Y., Carroll, M., Grossmann, M., Zajac, J. D., & Cheung, A. S. (2022). Effects of low-dose oral micronised progesterone on sleep, psychological distress, and breast development in transgender individuals undergoing feminising hormone therapy: a prospective controlled study. Endocrine Connections, 11(5), e220170. [DOI:10.1530/EC-22-0170]
- Norman, A. W., & Henry, H. L. (2015). Androgens. In Norman, A. W., & Henry, H. L. Hormones, 3rd Edition (pp. 255–273). London: Academic Press/Elsevier. [DOI:10.1016/b978-0-08-091906-5.00012-4]
- Norman, A. W., & Henry, H. L. (2015). Estrogens and Progestins. In Norman, A. W., & Henry, H. L. Hormones, 3rd Edition (pp. 275–296). London: Academic Press/Elsevier. [DOI:10.1016/b978-0-08-091906-5.00013-6]
- Nota, N. M., Wiepjes, C. M., de Blok, C. J., Gooren, L. J., Peerdeman, S. M., Kreukels, B. P., & den Heijer, M. (2018). The occurrence of benign brain tumours in transgender individuals during cross-sex hormone treatment. Brain, 141(7), 2047–2054. [DOI:10.1093/brain/awy108]
- North American Menopause Society. (2022). The 2022 hormone therapy position statement of The North American Menopause Society. Menopause, 29(7), 767–794. [DOI:10.1097/gme.0000000000002028]
- O’Connell, M. B. (1995). Pharmacokinetic and Pharmacologic Variation Between Different Estrogen Products. The Journal of Clinical Pharmacology, 35(9S), 18S–24S. [DOI:10.1002/j.1552-4604.1995.tb04143.x]
- Olsen, E. A., Hordinsky, M., Whiting, D., Stough, D., Hobbs, S., Ellis, M. L., Wilson, T., & Rittmaster, R. S. (2006). The importance of dual 5α-reductase inhibition in the treatment of male pattern hair loss: Results of a randomized placebo-controlled study of dutasteride versus finasteride. Journal of the American Academy of Dermatology, 55(6), 1014–1023. [DOI:10.1016/j.jaad.2006.05.007]
- Plovanich, M., Weng, Q. Y., & Mostaghimi, A. (2015). Low Usefulness of Potassium Monitoring Among Healthy Young Women Taking Spironolactone for Acne. JAMA Dermatology, 151(9), 941–944. [DOI:10.1001/jamadermatol.2015.34]
- Polyzos, S. A., Kountouras, J., Zavos, C., & Deretzi, G. (2011). Spironolactone Revisited. The Journal of Clinical Hypertension, 13(10), 783–784. [DOI:10.1111/j.1751-7176.2011.00484.x]
- Powers, M. S., Schenkel, L., Darley, P. E., Good, W. R., Balestra, J. C., & Place, V. A. (1985). Pharmacokinetics and pharmacodynamics of transdermal dosage forms of 17β-estradiol: Comparison with conventional oral estrogens used for hormone replacement. American Journal of Obstetrics and Gynecology, 152(8), 1099–1106. [DOI:10.1016/0002-9378(85)90569-1]
- Prince, J. C., & Safer, J. D. (2020). Endocrine treatment of transgender individuals: current guidelines and strategies. Expert Review of Endocrinology & Metabolism, 15(6), 395–403. [DOI:10.1080/17446651.2020.1825075]
- Reiter, E. O., Mauras, N., McCormick, K., Kulshreshtha, B., Amrhein, J., De Luca, F., O’Brien, S., Armstrong, J., & Melezinkova, H. (2010). Bicalutamide plus Anastrozole for the Treatment of Gonadotropin-Independent Precocious Puberty in Boys with Testotoxicosis: A Phase II, Open-Label Pilot Study (BATT). Journal of Pediatric Endocrinology and Metabolism, 23(10), 999–1009. [DOI:10.1515/jpem.2010.161]
- Rezende, H. D., Dias, M. F. R. G., & Trüeb, R. M. (2018). A Comment on the Post-Finasteride Syndrome. International Journal of Trichology, 10(6), 255–261. [PubMed] [PubMed Central] [DOI:10.4103/ijt.ijt_61_18]
- Roberts, J. L., Fiedler, V., Imperato-McGinley, J., Whiting, D., Olsen, E., Shupack, J., Stough, D., DeVillez, R., Rietschel, R., Savin, R., Bergfeld, W., Swinehart, J., Funicella, T., Hordinsky, M., Lowe, N., Katz, I., Lucky, A., Drake, L., Price, V. H., Weiss, D., Whitmore, E., Millikan, L., Muller, S., Gencheff, C., Carrington, P., Binkowitz, B., Kotey, P., He, W., Bruno, K., Jacobsen, C., Terranella, L., Gormley, G. J., & Kaufman, K. D. (1999). Clinical dose ranging studies with finasteride, a type 2 5α-reductase inhibitor, in men with male pattern hair loss. Journal of the American Academy of Dermatology, 41(4), 555–563. [DOI:10.1016/s0190-9622(99)80052-8]
- Roscioni, S. S., de Zeeuw, D., Bakker, S. J., & Lambers Heerspink, H. J. (2012). Management of hyperkalaemia consequent to mineralocorticoid-receptor antagonist therapy. Nature Reviews Nephrology, 8(12), 691–699. [DOI:10.1038/nrneph.2012.217]
- Rose, A. J., Hughto, J. M., Dunbar, M. S., Quinn, E. K., Deutsch, M., Feldman, J., Radix, A., Safer, J. D., Shipherd, J. C., Thompson, J., & Jasuja, G. K. (2023). Trends in Feminizing Hormone Therapy for Transgender Patients, 2006–2017. Transgender Health, 8(2), 188–194. [DOI:10.1089/trgh.2021.0041]
- Rosenfield, R. L., Cooke, D. W., & Radovick, S. (2008). Puberty and its disorders in the female. In Sperling, M. A. (Ed.). Pediatric Endocrinology, 3rd Edition (pp. 530–609). Philadelphia: Saunders. [Google 学术] [Google 阅读] [OpenLibrary] [WorldCat]
- Rosenfield, R. L., Cooke, D. W., & Radovick, S. (2021). Puberty in the Female and Its Disorders. In Sperling, M. A., Majzoub, J. A., Menon, R. K., & Stratakis, C. A. (Eds.). Sperling Pediatric Endocrinology, 5th Edition (pp. 528–626). Philadelphia: Elsevier. [DOI:10.1016/B978-0-323-62520-3.00016-6]
- Samarasinghe, S., Meah, F., Singh, V., Basit, A., Emanuele, N., Emanuele, M. A., Mazhari, A., & Holmes, E. W. (2017). Biotin Interference with Routine Clinical Immunoassays: Understand the Causes and Mitigate the Risks. Endocrine Practice, 23(8), 989–998. [DOI:10.4158/ep171761.ra]
- Schiller, C. E., Schmidt, P. J., & Rubinow, D. R. (2014). Allopregnanolone as a mediator of affective switching in reproductive mood disorders. Psychopharmacology, 231(17), 3557–3567. [DOI:10.1007/s00213-014-3599-x]
- Schlatterer, K., Yassouridis, A., Werder, K. V., Poland, D., Kemper, J., & Stalla, G. K. (1998). Archives of Sexual Behavior, 27(5), 475–492. [DOI:10.1023/a:1018704630036]
- Seaman, H. E., Langley, S. E., Farmer, R. D., & de Vries, C. S. (2007). Venous thromboembolism and cyproterone acetate in men with prostate cancer: a study using the General Practice Research Database. BJU International, 99(6), 1398–1403. [DOI:10.1111/j.1464-410x.2007.06859.x]
- Shackleton, C. (2010). Clinical steroid mass spectrometry: A 45-year history culminating in HPLC–MS/MS becoming an essential tool for patient diagnosis. The Journal of Steroid Biochemistry and Molecular Biology, 121(3–5), 481–490. [DOI:[10.1016/j.jsbmb.2010.02.017][doi-5a17c44e]]
- Shaw, J. C. (1996). Antiandrogen and hormonal treatment of acne. Dermatologic Clinics, 14(4), 803–811. [DOI:10.1016/s0733-8635(05)70405-8]
- Slack, D., Krishnamurthy, N., Contreras-Castro, F., & Safer, J. D. (2023). Achieving Both Target Testosterone And Target Estradiol Levels May Not Be Practical In All Trans Feminine Users Of Estradiol - Which To Prioritize? Journal of the Endocrine Society, 7(Suppl 1), A1102–A1102 (abstract no. SAT404/bvad114.2075). [DOI:10.1210/jendso/bvad114.2075] [PubMed Central]
- Sofer, Y., Yaish, I., Yaron, M., Bach, M. Y., Stern, N., & Greenman, Y. (2020). Differential Endocrine and Metabolic Effects of Testosterone Suppressive Agents in Transgender Women. Endocrine Practice, 26(8), 883–890. [DOI:10.4158/ep-2020-0032]
- SoRelle, J. A., Jiao, R., Gao, E., Veazey, J., Frame, I., Quinn, A. M., Day, P., Pagels, P., Gimpel, N., & Patel, K. (2019). Impact of Hormone Therapy on Laboratory Values in Transgender Patients. Clinical Chemistry, 65(1), 170–179. [DOI:10.1373/clinchem.2018.292730]
- St-Jules, D. E., Goldfarb, D. S., & Sevick, M. A. (2016). Nutrient Non-equivalence: Does Restricting High-Potassium Plant Foods Help to Prevent Hyperkalemia in Hemodialysis Patients? Journal of Renal Nutrition, 26(5), 282–287. [DOI:10.1053/j.jrn.2016.02.005]
- St-Jules, D. E., & Fouque, D. (2020). Is it time to abandon the nutrient-based renal diet model? Nephrology Dialysis Transplantation, 36(4), 574–577. [DOI:10.1093/ndt/gfaa257]
- St-Jules, D. E., & Fouque, D. (2022). Etiology-based dietary approach for managing hyperkalemia in people with chronic kidney disease. Nutrition Reviews, 80(11), 2198–2205. [DOI:10.1093/nutrit/nuac026]
- Stanczyk, F. Z., & Clarke, N. J. (2010). Advantages and challenges of mass spectrometry assays for steroid hormones. The Journal of Steroid Biochemistry and Molecular Biology, 121(3–5), 491–495. [DOI:10.1016/j.jsbmb.2010.05.001]
- Stanczyk, F. Z., Hapgood, J. P., Winer, S., & Mishell, D. R. (2012). Progestogens Used in Postmenopausal Hormone Therapy: Differences in Their Pharmacological Properties, Intracellular Actions, and Clinical Effects. Endocrine Reviews, 34(2), 171–208. [DOI:10.1210/er.2012-1008]
- Stanczyk, F. Z., Mathews, B. W., & Cortessis, V. K. (2017). Does the type of progestin influence the production of clotting factors? Contraception, 95(2), 113–116. [DOI:10.1016/j.contraception.2016.07.007]
- Stege, R., Gunnarsson, P. O., Johansson, C., Olsson, P., Pousette, Å., & Carlström, K. (1996). Pharmacokinetics and testosterone suppression of a single dose of polyestradiol phosphate (Estradurin®) in prostatic cancer patients. The Prostate, 28(5), 307–310. [DOI:10.1002/(sici)1097-0045(199605)28:5<307::aid-pros6>3.0.co;2-8]
- Steinberger, E., Ayala, C., Hsi, B., Smith, K. D., Rodriguez-Rigau, L. J., Weidman, E. R., & Reimondo, G. G. (1998). Utilization of Commercial Laboratory Results in Management of Hyperandrogenism in Women. Endocrine Practice, 4(1), 1–10. [DOI:10.4158/ep.4.1.1]
- Sterling, J., & Garcia, M. M. (2020). Cancer screening in the transgender population: a review of current guidelines, best practices, and a proposed care model. Translational Andrology and Urology, 9(6), 2771–2785. [DOI:10.21037/tau-20-954]
- Strauss, J. F., & FitzGerald, G. A. (2019). Steroid Hormones and Other Lipid Molecules Involved in Human Reproduction. In Strauss, J. F., & Barbieri, R. L. (Eds.). Yen and Jaffe’s Reproductive Endocrinology: Physiology, Pathophysiology, and Clinical Management, 8th Edition (pp. 75–114.e7). Philadelphia: Elsevier. [Google 阅读] [DOI:10.1016/b978-0-323-47912-7.00004-4]
- Stricker, R., Eberhart, R., Chevailler, M., Quinn, F. A., Bischof, P., & Stricker, R. (2006). Establishment of detailed reference values for luteinizing hormone, follicle stimulating hormone, estradiol, and progesterone during different phases of the menstrual cycle on the Abbott ARCHITECT® analyzer. Clinical Chemistry and Laboratory Medicine (CCLM), 44(7), 883–887. [DOI:10.1515/cclm.2006.160]
- Styne, D. M. (2016). Laboratory Values for Pediatric Endocrinology. In Styne, D. M. Pediatric Endocrinology: A Clinical Handbook (pp. 385–434). Cham: Springer International Publishing. [DOI:10.1007/978-3-319-18371-8_16]
- Sudduth, S. L., & Koronkowski, M. J. (1993). Finasteride: The First 5α-Reductase Inhibitor. Pharmacotherapy: The Journal of Human Pharmacology and Drug Therapy, 13(4), 309–329. [DOI:10.1002/j.1875-9114.1993.tb02739.x]
- Sundström-Poromaa, I., Comasco, E., Sumner, R., & Luders, E. (2020). Progesterone – Friend or foe? Frontiers in Neuroendocrinology, 59, 100856. [DOI:10.1016/j.yfrne.2020.100856]
- Swerdloff, R. S., Dudley, R. E., Page, S. T., Wang, C., & Salameh, W. A. (2017). Dihydrotestosterone: Biochemistry, Physiology, and Clinical Implications of Elevated Blood Levels. Endocrine Reviews, 38(3), 220–254. [DOI:10.1210/er.2016-1067]
- T’Sjoen, G. G., Beguin, Y., Feyen, E., Rubens, R., Kaufman, J., & Gooren, L. (2005). Influence of exogenous oestrogen or (anti-) androgen administration on soluble transferrin receptor in human plasma. Journal of Endocrinology, 186(1), 61–67. [DOI:10.1677/joe.1.06112]
- T’Sjoen, G., Arcelus, J., Gooren, L., Klink, D. T., & Tangpricha, V. (2018). Endocrinology of Transgender Medicine. Endocrine Reviews, 40(1), 97–117. [DOI:10.1210/er.2018-00011]
- Tack, L. J., Heyse, R., Craen, M., Dhondt, K., Bossche, H. V., Laridaen, J., & Cools, M. (2017). Consecutive Cyproterone Acetate and Estradiol Treatment in Late-Pubertal Transgender Female Adolescents. The Journal of Sexual Medicine, 14(5), 747–757. [DOI:10.1016/j.jsxm.2017.03.251]
- Thompson, J., Hopwood, R. A., deNormand, S., & Cavanaugh, T. (2021). Medical Care of Trans and Gender Diverse Adults. Boston: Fenway Health. [URL] [PDF]
- Toorians, A. W., Thomassen, M. C., Zweegman, S., Magdeleyns, E. J., Tans, G., Gooren, L. J., & Rosing, J. (2003). Venous Thrombosis and Changes of Hemostatic Variables during Cross-Sex Hormone Treatment in Transsexual People. The Journal of Clinical Endocrinology & Metabolism, 88(12), 5723–5729. [DOI:10.1210/jc.2003-030520]
- Traish, A. M., Krakowsky, Y., Doros, G., & Morgentaler, A. (2019). Do 5α-Reductase Inhibitors Raise Circulating Serum Testosterone Levels? A Comprehensive Review and Meta-Analysis to Explaining Paradoxical Results. Sexual Medicine Reviews, 7(1), 95–114. [DOI:10.1016/j.sxmr.2018.06.002]
- Traish, A. M. (2020). Post-finasteride syndrome: a surmountable challenge for clinicians. Fertility and Sterility, 113(1), 21–50. [DOI:10.1016/j.fertnstert.2019.11.030]
- Treleaven, M. M., Jackowich, R. A., Roberts, L., Wassersug, R. J., & Johnson, T. (2013). Castration and personality: Correlation of androgen deprivation and estrogen supplementation with the Big Five factor personality traits of adult males. Journal of Research in Personality, 47(4), 376–379. [DOI:10.1016/j.jrp.2013.03.005]
- Usach, I., Martinez, R., Festini, T., & Peris, J. (2019). Subcutaneous Injection of Drugs: Literature Review of Factors Influencing Pain Sensation at the Injection Site. Advances in Therapy, 36(11), 2986–2996. [DOI:10.1007/s12325-019-01101-6]
- van Zuuren, E. J., Fedorowicz, Z., Carter, B., & Pandis, N. (2015). Interventions for hirsutism (excluding laser and photoepilation therapy alone). Cochrane Database of Systematic Reviews, 2015, CD010334. [DOI:10.1002/14651858.cd010334.pub2]
- Verdonk, S. J., Vesper, H. W., Martens, F., Sluss, P. M., Hillebrand, J. J., & Heijboer, A. C. (2019). Estradiol reference intervals in women during the menstrual cycle, postmenopausal women and men using an LC-MS/MS method. Clinica Chimica Acta, 495, 198–204. [DOI:10.1016/j.cca.2019.04.062]
- Vermeulen, A., Giagulli, V., De Schepper, P., & Buntinx, A. (1991). Hormonal Effects of a 5α-Reductase Inhibitor (Finasteride) onHormonal Levels in Normal Men and in Patients withBenign Prostatic Hyperplasia. European Urology, 20(1), 82–86. [DOI:10.1159/000471752]
- Vihtamäki, T., Luukkaala, T., & Tuimala, R. (2004). Skin contamination by oestradiol gel—a remarkable source of error in plasma oestradiol measurements during percutaneous hormone replacement therapy. Maturitas, 48(4), 347–353. [DOI:10.1016/s0378-5122(03)00043-4]
- Wang, H., Liu, M., Fu, Q., & Deng, C. (2019). Pharmacokinetics of hard micronized progesterone capsules via vaginal or oral route compared with soft micronized capsules in healthy postmenopausal women: a randomized open-label clinical study. Drug Design, Development and Therapy, 13, 2475–2482. [DOI:10.2147/dddt.s204624]
- Wang, Y., & Lipner, S. R. (2020). Retrospective analysis of adverse events with spironolactone in females reported to the United States Food and Drug Administration. International Journal of Women’s Dermatology, 6(4), 272–276. [DOI:10.1016/j.ijwd.2020.05.002]
- Weill, A., Nguyen, P., Labidi, M., Cadier, B., Passeri, T., Duranteau, L., Bernat, A., Yoldjian, I., Fontanel, S., Froelich, S., & Coste, J. (2021). Use of High Dose Cyproterone Acetate and Risk of Intracranial Meningioma in Women: Cohort Study. BMJ, 372, n37. [DOI:10.1136/bmj.n37]
- Welk, B., McArthur, E., Ordon, M., Anderson, K. K., Hayward, J., & Dixon, S. (2017). Association of Suicidality and Depression With 5α-Reductase Inhibitors. JAMA Internal Medicine, 177(5), 683–691. [DOI:10.1001/jamainternmed.2017.0089]
- Wellington, K., & Keam, S. J. (2006). Bicalutamide 150mg: A Review of its Use in the Treatment of Locally Advanced Prostate Cancer. Drugs, 66(6), 837–850. [DOI:10.2165/00003495-200666060-00007]
- Willemsen, W. N., Mastboom, J. L., Thomas, C. M., & Rolland, R. (1985). Absorption of 17β-estradiol in a neovagina constructed from the peritoneum. European Journal of Obstetrics & Gynecology and Reproductive Biology, 19(4), 247–253. [DOI:10.1016/0028-2243(85)90036-x]
- Wilson, L. M., Baker, K. E., Sharma, R., Dukhanin, V., McArthur, K., & Robinson, K. A. (2020). Effects of antiandrogens on prolactin levels among transgender women on estrogen therapy: A systematic review. International Journal of Transgender Health, 21(4), 391–402. [DOI:10.1080/15532739.2020.1819505]
- Wu, B., Shen, P., Yin, X., Yu, L., Wu, F., Chen, C., Li, J., & Xu, T. (2022). Analysis of adverse event of interstitial lung disease in men with prostate cancer receiving hormone therapy using the Food and Drug Administration Adverse Event Reporting System. British Journal of Clinical Pharmacology, 89(2), 440–448. [DOI:10.1111/bcp.15336]
- Wu, F. C., Balasubramanian, R., Mulders, T. M., & Coelingh-Bennink, H. J. (1999). Oral Progestogen Combined with Testosterone as a Potential Male Contraceptive: Additive Effects between Desogestrel and Testosterone Enanthate in Suppression of Spermatogenesis, Pituitary-Testicular Axis, and Lipid Metabolism. The Journal of Clinical Endocrinology & Metabolism, 84(1), 112–122. [DOI:10.1210/jcem.84.1.5412]
- Yaish, I., Gindis, G., Greenman, Y., Moshe, Y., Arbiv, M., Buch, A., Sofer, Y., Shefer, G., & Tordjman, K. (2023). Sublingual Estradiol Offers No Apparent Advantage Over Combined Oral Estradiol and Cyproterone Acetate for Gender-Affirming Hormone Therapy of Treatment-Naive Trans Women: Results of a Prospective Pilot Study. Transgender Health, 8(6), 485–493. [DOI:10.1089/trgh.2023.0022]
- Zaenglein, A. L., Pathy, A. L., Schlosser, B. J., Alikhan, A., Baldwin, H. E., Berson, D. S., Bowe, W. P., Graber, E. M., Harper, J. C., Kang, S., Keri, J. E., Leyden, J. J., Reynolds, R. V., Silverberg, N. B., Stein Gold, L. F., Tollefson, M. M., Weiss, J. S., Dolan, N. C., Sagan, A. A., Stern, M., Boyer, K. M., & Bhushan, R. (2016). Guidelines of care for the management of acne vulgaris. Journal of the American Academy of Dermatology, 74(5), 945–973.e33. [DOI:10.1016/j.jaad.2015.12.037]
- Zhang, J., & Stanczyk, F. Z. (2013). LC-MS Bioanalysis of Steroids. In Li, W., Zhang, J., & Tse, F. L. S. (Eds.). Handbook of LC-MS Bioanalysis: Best Practices, Experimental Protocols, and Regulations (pp. 573–590). Hoboken, New Jersey: John Wiley & Sons. [DOI:10.1002/9781118671276.ch45]
- Zhou, Z., Song, S., Gao, Z., Wu, J., Ma, J., & Cui, Y. (2019). The efficacy and safety of dutasteride compared with finasteride in treating men with androgenetic alopecia: a systematic review and meta-analysis. Clinical Interventions in Aging, 14, 399–406. [DOI:10.2147/cia.s192435]
- Zitzmann, M., Rohayem, J., Raidt, J., Kliesch, S., Kumar, N., Sitruk-Ware, R., & Nieschlag, E. (2017). Impact of various progestins with or without transdermal testosterone on gonadotropin levels for non-invasive hormonal male contraception: a randomized clinical trial. Andrology, 5(3), 516–526. [DOI:10.1111/andr.12328]
- Zuuren, E., & Fedorowicz, Z. (2016). Interventions for hirsutism excluding laser and photoepilation therapy alone: abridged Cochrane systematic review including GRADE assessments. British Journal of Dermatology, 175(1), 45–61. [DOI:10.1111/bjd.14486]
译文修订历史
| 时间 | 备注 |
|---|---|
| 2021 年 6 月 23 日 | 初次翻译。 |
| 2022 年 11 月 3 日 | 第一次全面修订 增补大量新内容,尤其药物详解与健康监测; 尝试改善译文质量; 修复、调整、优化多处格式与排版; 更新多处数据; 整理外链; 等等。 |
| 2022 年 11 月 23 日 | 补足关于氟他胺和尼鲁米特的遗漏部分;继续整理外链。 |
| 2022 年 11 月 28 日 | 移除已删除的站内原文链接。 |
| 2023 年 3 月 18 日 | 第二次修订: 跟进原文更新,包括新的“表四”和螺内酯、比卡鲁胺副作用等; 补足链接,移除已撤下的原文链接; 更正 retroprogesterone(逆孕酮)的称谓; 修复格式。 |
| 2023 年 6 月 3 日 | 第三次修订: 增补参考文献;更正“sign”“progestin”译文;移除已下线原文链接。 |
| 2023 年 11 月 2 日 | 第四次修订: 跟进原文已修订内容; 依国家卫健委公开文件,修订 Relugolix 译名。 |
| 2025 年 6 月 21 日 | 第五次修订,跟进原文更新,修正多处不当叙述。 |