譯者按: 本文翻譯自法杏製藥(Besins Healthcare)旗下子公司:美國 Ascend Therapeutics 公司的雌二醇凝膠(EstroGel)説明書,原件已被美國 FDA 批准。原件地址:accessdata.fda.gov/drugsatfda_docs/label/2023/021166s018lbl.pdf
注意,該凝膠劑與中國大陸上市的“愛斯妥”同源,唯一不同在於包裝形式:本品系泵動定量給藥包裝。類似包裝還見於加拿大 Organon Estrogel、歐盟區 Gynokadin 等品牌。另,本文所示劑量不一定適用於性別肯定激素治療,應酌情調整。
首次核准日期:1975 年
修改日期:2023 年 12 月
翻譯日期:2024 年 4 月 2 日
請仔細閲讀説明書並在醫師指導下使用
目錄:
品名
EstroGel® 0.06%(雌二醇凝膠)外用藥 (以下簡稱“本品”)
處方説明書摘要
以下摘要內容不足以確保本品使用的安全性與有效性。請參見説明書詳情。
美國首次核准日期:1975 年
警告:子宮內膜癌、心血管疾病、疑似痴呆和乳腺癌風險
詳情參見説明書正文的置頂警告説明
雌激素單藥治療:
- 有子宮的婦女使用不受控雌激素,有更高的子宮內膜癌風險 (5.2)
- “婦女健康倡議”(WHI)雌激素單藥研究報告了卒中和深靜脈血栓(DVT)風險升高 (5.1)
- WHI 附屬認知研究(WHIMS)的雌激素單藥子研究報告了 65 歲以上絕經後婦女的疑似痴呆風險升高 (5.3)
- 雌激素單藥治療不得用於預防心血管疾病或痴呆 (5.1, 5.3)
雌激素—孕激素聯合治療:
- WHI 雌激素—孕激素複方研究報告了肺栓塞(PE)、DVT、卒中和心肌梗死(MI)風險升高 (5.1)
- WHI 雌激素—孕激素複方研究報告了浸潤性乳腺癌風險升高 (5.2)
- WHIMS 雌激素—孕激素複方子研究報告了 65 歲以上絕經後婦女的疑似痴呆風險升高 (5.3)
- 雌激素—孕激素聯合治療不得用於預防心血管疾病或痴呆 (5.1, 5.3)
最近一次主要更新
- 2023 年 12 月——警告和注意事項:惡性腫瘤 (5.2)
適應症
本品是一種雌激素製劑,用於:
用法用量
本品有定量擠壓泵:每日使用本品 1.25 g(按壓一泵),塗抹於手臂。(2.1, 2.2)
成分與定量
本品每泵可給予凝膠 1.25 g,其中含雌二醇 0.75 mg。(3)
禁忌症
- 未確診的陰道異常出血 (4, 5.2)
- 乳腺癌,或有既往史 (4, 5.2)
- 雌激素依賴性腫瘤 (4, 5.2)
- 現有 DVT、PE,或有既往史 (4, 5.1)
- 現有動脈血栓性疾病(如卒中或心肌梗死),或有既往史 (4, 5.1)
- 已知對本品有超敏反應或血管性水腫 (4)
- 肝功能不全或肝臟疾病 (4, 5.10)
- 現有 C 蛋白、S 蛋白或抗凝血酶不足,或有其它血栓性疾病 (4)
警告和注意事項
- 雌激素可增加膽囊疾病風險。 (5.4)
- 如出現重度高鈣血癥、失明、重度高甘油三酯血癥或膽汁鬱積性黃疸,停用雌激素。 (5.5, 5.6, 5.9, 5.10)
- 如婦女正接受甲狀腺素替代治療,監測甲狀腺功能。(5.11, 5.20)
不良反應
與本品相關的常見(≥5%)不良反應有:頭痛、脹氣、乳房疼痛。(6.1)
如需報告任何疑似不良反應,請撥打美國 ASCEND Therapeutics® 有限公司電話:1-877-204-1013,或致電美國 FDA:1-800-FDA-1088 或登錄 fda.gov/medwatch。
藥物相互作用
CYP3A4 誘導劑/抑制劑可能影響雌激素代謝,使其血漿濃度降低或升高。(7.1)
修訂日期:2023 年 12 月
處方説明書正文
警告:子宮內膜癌、心血管疾病、疑似痴呆和乳腺癌風險
雌激素單藥治療
子宮內膜癌風險
不受控的雌激素用於子宮完整的婦女,可提高其子宮內膜癌風險。已知在雌激素治療中加用一種孕激素製劑,可降低子宮內膜增生(可能是子宮內膜癌之前兆)的風險。
如絕經後婦女出現未確診的持續或反覆性異常陰道出血,應採取適當的診斷手段以排除惡性病變(包括酌情進行定向或隨機子宮內膜取樣)。
——參見“警告和注意事項”(5.2)
心血管疾病風險和疑似痴呆風險
據美國“婦女健康倡議”(WHI)雌激素單藥研究報告,絕經後婦女(50~79 歲)每日以口服結合雌激素(CE,0.625 mg/天)單藥治療,持續 7.1 年,其患卒中與深靜脈血栓(DVT)的風險增加。——參見“警告和注意事項”(5.1) 和“臨牀研究資料”(14.3)
WHI 附屬認知研究(WHIMS)中的雌激素單藥研究報告,絕經後婦女(65 歲或以上)以 CE(0.625 mg/天)單藥治療 5.2 年後,其發生疑似痴呆的風險較安慰劑組有所增長。尚不清楚該結果是否對較年輕的絕經後婦女適用。——參見“警告和注意事項”(5.3)、“特殊人羣用藥”(8.5)和“臨牀研究資料”(14.4)
雌激素單藥治療不得用於預防心血管疾病或痴呆。——參見“警告和注意事項”(5.1, 5.3) 和“臨牀研究資料”(14.3, 14.4)
WHI 雌激素單藥研究僅涉及 CE 0.625 mg/天。因此,尚不清楚 WHI 有關惡性心血管事件和痴呆的結果是否適用於低劑量 CE、其它用藥途徑或其它雌激素單方製劑。因缺乏相關資料,故不能排除其它製劑有同樣風險的可能,也不能判斷具體風險程度。應就患者個體的風險狀況,與患者討論雌激素單藥治療的收益和風險。
雌激素以及加用的孕激素均應按每名患者的情況,在確保療效、控制風險的前提下,以最小有效劑量、最短使用時長開出。
雌激素—孕激素聯合治療
心血管疾病和疑似痴呆風險
據 WHI 雌激素、孕激素複方研究報告,絕經後婦女(50~79 歲)接受口服 CE(0.625 mg/天)、醋酸甲羥孕酮(MPA,2.5 mg/天)聯合治療 5.6 年後,其 DVT、肺栓塞(PE)、卒中與心肌梗死(MI)患病風險較安慰劑組有所提高。——參見“警告和注意事項”(5.1) 和“臨牀研究資料”(14.3)
WHI 附屬的 WHIMS 雌激素、孕激素複方研究報告,絕經後婦女(65 歲或以上)接受 CE(0.625 mg/天)、MPA(2.5 mg)聯合治療 4 年後,其出現疑似痴呆的風險較安慰劑組有所增長。尚不清楚該結果是否對較年輕的絕經後婦女適用。——參見“警告和注意事項”(5.3)、“特殊人羣用藥”(8.5)和“臨牀研究資料”(14.4)
雌激素—孕激素聯合治療不得用於預防心血管疾病或痴呆。——參見“警告和注意事項”(5.1, 5.3) 和“臨牀研究資料”(14.3, 14.4)
乳腺癌風險
WHI 雌激素、孕激素複方研究還表明,浸潤性乳腺癌的患病風險有所增長。——參見“警告和注意事項”(5.2) 和“臨牀研究資料”(14.4)
WHI 雌激素—孕激素複方研究僅涉及口服 CE 0.625 mg/天和 MPA 2.5 mg/天。因此,尚不清楚 WHI 有關惡性心血管事件和痴呆的結果是否適用於低劑量 CE 和其它劑量下的 MPA、其它用藥途徑或其它雌激素/孕激素製劑。因缺乏相關資料,故不能排除其它製劑有同樣風險的可能,也不能判斷具體風險程度。應就患者個體的風險狀況,與患者討論雌激素—孕激素聯合治療的收益和風險。
雌激素以及加用的孕激素均應按每名患者的情況,在確保療效、控制風險的前提下,以最小有效劑量、最短使用時長開出。
一、適應症
- 更年期引起的中、重度血管舒縮性症狀。
- 更年期引起的中、重度外陰和陰道萎縮。
限制使用事項
如僅針對更年期引起的中、重度外陰和陰道萎縮進行處方,應優先考慮陰道外用製劑。
二、用法用量
對於有子宮的絕經後婦女,在開出雌激素時一般需考慮加用一種孕激素,以降低子宮內膜癌風險。對於無子宮的婦女,一般無需加用孕激素;但如有子宮內膜異位病史,可能仍需加用。——參見“警告和注意事項”(5.2, 5.14)
雌激素以及加用的孕激素均應按每名患者的情況,在確保療效、控制風險的前提下,以最小有效劑量、最短治療時長使用。應視臨牀狀況定期進行利弊權衡再評估,以判斷是否仍有必要繼續治療。
2.1 更年期引起的中、重度血管舒縮性症狀治療
本品用於更年期引起的中、重度血管舒縮性症狀的治療時,經批准的單次劑量為 1.25 g/天。尚不清楚本品對於該用途的最低有效劑量。
初次使用前,須先填充好泵頭;打開大瓶蓋,充分按壓泵頭 5 次,然後棄置未使用的凝膠(清洗乾淨,或扔進垃圾桶)。填充後即可開始使用。
建議通過手臂用藥。將本品塗抹於手腕至肩部之間的整個手臂,形成薄層,覆蓋於內、外側。
2.2 更年期引起的中、重度外陰和陰道萎縮治療
本品用於更年期引起的中、重度外陰和陰道萎縮的治療時,經批准的單次劑量為 1.25 g/天。尚不清楚本品對於該用途的最低有效劑量。如僅針對更年期引起的中、重度外陰和陰道萎縮進行處方,應優先考慮陰道外用製劑。
初次使用前,須先填充好泵頭;打開大瓶蓋,充分按壓泵頭 5 次,然後棄置未使用的凝膠(清洗乾淨,或扔進垃圾桶)。填充後即可開始使用。
建議通過手臂用藥。將本品塗抹於手腕至肩部之間的整個手臂,形成薄層,覆蓋於內、外側。
三、成分與定量
本品為雌二醇透皮凝膠劑。每泵給予凝膠 1.25 g,含雌二醇 0.75 mg。
四、禁忌症
有以下任意情況的婦女禁用本品:
- 未確診的陰道異常出血。 ——參見“警告和注意事項”(5.2)
- 乳腺癌,或有既往史。 ——參見“警告和注意事項”(5.2)
- 雌激素依賴性腫瘤。 ——參見“警告和注意事項”(5.2)
- 現有 DVT、PE,或有既往史。 ——參見“警告和注意事項”(5.1)
- 現有動脈血栓性疾病(如卒中或心肌梗死),或有既往史。 ——參見“警告和注意事項”(5.1)
- 已知對本品有超敏反應或血管性水腫。
- 肝功能不全或肝臟疾病。
- C 蛋白、S 蛋白或抗凝血酶不足,或有其它血栓形成性疾病。
五、警告和注意事項
5.1 心血管疾病
已有雌激素單藥治療引起卒中和深靜脈血栓(DVT)風險增加的報告。
已有雌激素—孕激素聯合治療引起肺栓塞(PE)、DVT、卒中和心肌梗死(MI)風險增加的報告。
如出現以上事件或有疑似徵兆,應立即停止雌激素或雌、孕激素治療。
對以下風險因素應對症處置:
- 動脈疾病風險因素,如高血壓、糖尿病、吸煙、高膽固醇水平和肥胖等
- 靜脈血栓栓塞(VTE)風險因素,如有 VTE 既往史或家族史、肥胖、系統性紅斑狼瘡等
卒中
據 WHI 雌激素單藥研究報告,50~79 歲婦女給予 CE(0.625 mg/天)單藥治療,其卒中風險相較同年齡安慰劑組有統計意義的增長:治療組每萬人·年 45 例,安慰劑組 33 例。風險增長在治療第一年顯現,此後增長持續。——參見“臨牀研究資料”(14.3)
如出現卒中或有疑似徵兆,應立即停止雌激素單藥治療。
分組分析表明,50~59 歲婦女給予 CE(0.625 mg/天)單藥治療,其卒中風險相較安慰劑組未見增長:治療組每萬人·年 18 例,安慰劑組 21 例。1
據 WHI 雌激素—孕激素複方研究報告,50~79 歲婦女給予 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療,其卒中風險相較同年齡安慰劑組有統計意義的增長:治療組每萬人·年 33 例,安慰劑組 25 例。風險增長在治療第一年顯現,此後增長持續。——參見“臨牀研究資料”(14.3)
如出現卒中或有疑似徵兆,應立即停止雌激素—孕激素聯合治療。
冠心病
據 WHI 雌激素單藥研究報告,婦女給予雌激素單藥治療後,CHD 事件(含非致命性心梗、靜息性心梗和 CHD 猝死)之風險率相較安慰劑組總體未受影響。2 ——參見“臨牀研究資料”(14.3)”
分組分析表明,50~59 歲婦女(圍絕經期開始不足 10 年)給予 CE(0.625 mg/天)單藥治療,其卒中風險相較安慰劑組有所降低,但無統計意義:治療組每萬人·年 8 例,安慰劑組 16 例。1
據 WHI 雌激素—孕激素複方研究報告,婦女給予 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療後,CHD 事件風險率相較安慰劑組有所增加,但無統計意義:治療組每萬人·年 41 例,安慰劑組 34 例。相對風險率在治療第一年可見增長,此後第 2~5 年有下降趨勢。——參見“臨牀研究資料”(14.3)
一項有關心血管疾病二線預防的臨牀對照試驗中(“心臟與雌激素/孕激素替代治療研究”;HERS),有心臟病史的絕經後婦女(2763 人,平均年齡 66.7 歲)給予 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療,該療法對心血管未見任何收益。平均跟蹤 4.1 年後,曾確診冠心病的絕經後婦女使用該療法,未降低 CHD 事件的總體發生率。治療第一年,治療組的 CHD 事件發生率高於安慰劑組;但此後發生率一致。
參與 HERS 的受試者中,有 2321 人同意參與另一項非盲延伸試驗,即 HERS II。該試驗的平均跟蹤期為 2.7 年,與 HERS 相加即為 6.8 年。治療組和安慰劑組的 CHD 事件發生率,在 HERS、HERS II 以及綜合二者來看均相當。
靜脈血栓栓塞
據 WHI 雌激素單藥研究報告,婦女給予 CE(0.625 mg/天)單藥治療後,其 VTE(含 DVT 及 PE)風險率相較安慰劑組有所增長:治療組每萬人·年 30 例,安慰劑組 22 例。但是,僅 DVT 風險的增長具備統計意義:治療組每萬人·年 23 例,安慰劑組 15 例。VTE 風險的增長在治療第一、二年顯現。3 ——參見“臨牀研究資料”(14.3)
如出現 VTE 或有疑似徵兆,應立即停止雌激素單藥治療。
據 WHI 雌激素—孕激素複方研究報告,婦女給予 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療後,VTE 風險率相較安慰劑組增長一倍,且有統計意義;而 DVT、PE 風險同樣有統計意義地增長:
- VTE:治療組每萬人·年 35 例,安慰劑組 17 例
- DVT:治療組每萬人·年 26 例,安慰劑組 13 例
- PE:治療組每萬人·年 18 例,安慰劑組 8 例
VTE 風險的增長在治療第一年顯現,此後增長持續。4 ——參見“臨牀研究資料”(14.3)
如出現 VTE 或有疑似徵兆,應立即停止雌激素—孕激素聯合治療。
如果可能,在接受可能引起血栓栓塞風險增加的手術之前,應提前 4~6 周以上停用雌激素;需長期固定時,也應停用雌激素。
5.2 惡性腫瘤
子宮內膜癌
已有子宮完整的婦女使用不受控雌激素治療導致子宮內膜癌風險增加的報告。報告中,使用不受控雌激素後,患者的子宮內膜癌風險增至未使用者的 2~12 倍;風險與治療時長和雌激素劑量有關。
多數研究表明,雌激素使用不足一年時,不會使該風險明顯增加。長期使用雌激素與更高的風險有關,其中用藥 5~10 年後,風險增至 15~24 倍;且停藥後至少 8~15 年內,風險仍會維持。
有必要對所有服用雌激素單藥或雌、孕激素複方的婦女進行臨牀監測。如絕經後婦女有未確診的持續、或反覆的陰道異常出血,應採取適當的診療手段(如酌情進行定向或隨機子宮內膜取樣),以排除惡性病變。
無證據表明天然雌激素在與人工雌激素等效的劑量下,導致的子宮內膜癌風險與人工雌激素不同。已證實在雌激素治療中加用一種孕激素,可降低子宮內膜增生(可能是子宮內膜癌之前兆)的風險。
乳腺癌
WHI 雌激素單藥研究(CE 0.625 mg/天)提供了有關雌激素單藥與乳腺癌之關係的資料。據研究報告,平均跟蹤 7.1 年後,CE 單藥治療組的浸潤性乳腺癌風險未見增長(相對風險率:0.80)。5 ——參見“臨牀研究資料”(14.3)
據 WHI 雌激素—孕激素複方研究(CE 0.625 mg/天 + MPA 2.5 mg/天)報告,平均跟蹤 5.6 年後,CE—MPA 聯合治療組的浸潤性乳腺癌風險相較安慰劑組有所提高。其中,有 26% 的婦女報告早前曾使用雌激素單藥或雌激素—人工孕激素複方治療。相對安慰劑組,CE—MPA 聯合治療組的浸潤性乳腺癌風險比率為 1.24,絕對風險率為每萬人·年 41 例(安慰劑組:33 例)。
在有激素治療史的婦女中,CE—MPA 聯合治療組的浸潤性乳腺癌相對風險率為 1.86,絕對風險率為每萬人·年 46 例(安慰劑組:25 例)。
在從未接受激素治療的婦女中,CE—MPA 聯合治療組的浸潤性乳腺癌相對風險率為 1.09,絕對風險率為每萬人·年 40 例(安慰劑組:36 例)。
該研究中,相較安慰劑組,CE—MPA 聯合治療組的浸潤性乳腺癌病灶更大,檢出淋巴結陽性的比例更高,癌症確診時的階段也更晚。罕有轉移性癌症的報告;兩組之間的報告率無明顯差異。其它預後因素(如組織學亞型、分級和激素受體狀態等)在兩組之間未見有差異。6 ——參見“臨牀研究資料”(14.3)
與此類似,已有觀察性研究報告,連續多年使用雌、孕激素複方治療導致了乳腺癌風險增加,而雌激素單藥引起了較小的風險增加。一項針對諸前瞻性羣體研究的大型薈萃分析表明,風險的增加和用藥時長相關,且該風險在停藥後至少十年內仍然維持。WHI 試驗的後續研究也表明,雌、孕激素複方治療和乳腺癌風險增長有關。
觀察性研究表明,相比於雌激素單藥治療,雌、孕激素複方治療引起乳腺癌的風險更高,顯性化更早。此類研究基本上未發現不同配方、劑量或給藥途徑的雌、孕激素複方在乳腺癌風險上有任何明顯差異。
已有使用雌激素單藥和雌、孕激素複方治療導致乳腺 X 光異常結果(需進一步排查)增加的報告。
婦女應每月進行一次乳房自查,每年由醫師進行一次乳房檢查。此外,依患者年齡、風險因素和早前乳腺 X 光結果,應安排進行乳腺 X 光掃描。
卵巢癌
WHI 雌激素—孕激素複方研究中,卵巢癌風險有所增加,但無統計意義。平均跟蹤 5.6 年後,CE、MPA 治療組相對安慰劑組的卵巢癌風險比率為 1.58(95% 置信區間 0.77~3.24),絕對風險率為每萬人·年 4 例(安慰劑組:3 例)。7
對 17 項前瞻性、35 項回顧性流行病學研究的薈萃分析發現,曾服用激素以治療更年期症狀的婦女有更高的卵巢癌風險。其中,對來自 17 項前瞻性研究的 12,110 例卵巢癌病例以對照比較的方式進行初步分析。與現行激素治療相關的卵巢癌相對風險率為 1.41(95% 置信區間 1.32~1.50)。不同激素暴露時長之間未產生風險率估測值的差異;即,確診前暴露 5 年以下(中位數 3 年)和確診前暴露 5 年以上(中位數 10 年)未產生這種差異。然而,尚不清楚卵巢癌風險的增加究竟與多長時間的激素治療有關。
5.3 疑似痴呆
WHI 附屬認知研究(WHIMS)的雌激素單藥子研究中,有 2947 名已切除子宮的 65~79 歲婦女被隨機分配到 CE(0.625 mg/天)單藥治療組或安慰劑組。
平均跟蹤 5.2 年後,治療組和安慰劑組分別有 28 名和 19 名婦女被確診疑似痴呆。CE 單藥治療組的疑似痴呆相對風險率為 1.49(95% 置信區間 0.83~2.66),絕對風險率為每萬人·年 37 例(安慰劑組:25 例)。8 ——參見“特殊人羣用藥”(8.5) 和“臨牀研究資料”(14.4)
WHIMS 雌激素—孕激素複方研究中,有 4532 名已絕經的 65~79 歲婦女被隨機分配到 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療組或安慰劑組。
平均跟蹤 4 年後,治療組和安慰劑組分別有 40 名和 21 名婦女被確診疑似痴呆。CE—MPA 聯合治療組的疑似痴呆相對風險率為 2.05(95% 置信區間 1.21~3.48),絕對風險率為每萬人·年 45 例(安慰劑組:22 例)。8 ——參見“特殊人羣用藥”(8.5) 和“臨牀研究資料”(14.4)
綜合以上兩批受試者的結果,可知疑似痴呆的相對風險率為 1.76(95% 置信區間 1.19~2.60)。以上研究僅對 65~79 歲婦女進行,其結論是否適用於較年輕的絕經後婦女尚不清楚。——參見“特殊人羣用藥”(8.5)
5.4 膽囊疾病
已有絕經後婦女服用雌激素出現膽囊疾病(需手術)的風險增至 2~4 倍的報告。
5.5 高鈣血癥
患有乳腺癌、且骨骼有轉移灶的患者,攝入雌激素可能導致重度高鈣血癥。如發生高鈣血癥,應停用雌激素(包括本品),並對症治療,使血鈣水平降低。
5.6 視力異常
已有服用雌激素的婦女出現視網膜血管栓塞的報告。如出現急性部分或完全失明,或有急性眼前垂、複視或偏頭痛發作,應停藥並等待檢查。如眼科檢查提示視神經盤水腫或視網膜血管病變,應終身停用雌激素(包括本品)。
5.7 關於未切除子宮的婦女加用一種孕激素的説明
已有研究報告,在雌激素序貫治療中連續 10 日或以上加用一種孕激素,或在雌激素不間斷治療中加入孕激素,可使子宮內膜增生的發生率低於雌激素單藥治療。子宮內膜增生可能是子宮內膜癌之前兆。
但是,相較雌激素單藥,加用孕激素可能會帶來額外的風險;其中包括乳腺癌風險增加。
5.8 高血壓
在少量病例報告中,(人體)對雌激素的某些特異性反應可導致血壓的大幅升高。在一項大型隨機安慰劑對照試驗中,未發現雌激素對血壓有任何普遍性作用。
5.9 高甘油三酯血癥的加重
對於有高甘油三酯血癥既往史的婦女,雌激素治療可能與血清甘油三酯的升高有關,從而可誘發胰腺炎。如出現胰腺炎,應停用本品。
5.10 肝功能不全和/或有膽汁鬱積性黃疸既往史
如患者的肝功能不全,雌激素代謝可能較慢。如婦女有因雌激素使用或妊娠引起的膽汁鬱積性黃疸既往史,應謹慎治療,一旦症狀復發則應停藥。
5.11 甲狀腺功能減退的加重
使用雌激素可引起甲狀腺素結合球蛋白(TBG)水平的升高。甲狀腺功能正常的情況下,作為補償,TBG 升高可引起甲狀腺素分泌增加,維持血清遊離 T4、T3 濃度在正常範圍。如婦女同時接受甲狀腺素替代治療和雌激素治療,則可能需提高甲狀腺素的劑量。在以本品治療期間,應監測其甲狀腺功能,以確保遊離甲狀腺素水平維持於合理範圍內。
5.12 體液瀦留
雌激素可引起一定程度的體液瀦留。如婦女存在可能影響體液瀦留的狀況(如心功能或腎功能不全),應對其密切觀察。當有證據提示臨牀顯著的體液瀦留時,應停止雌激素單藥治療(包括本品)。
5.13 低鈣血癥
在副甲狀腺功能不全的婦女中,雌激素可引起低鈣血癥。對此類婦女,應考慮雌激素(包括本品)治療的收益是否高於風險。
5.14 子宮內膜異位症狀的加重
已有數個病例報告已切除子宮的婦女給予雌激素單藥治療後出現體內殘餘子宮內膜嵌入體的惡性病變。如婦女切除子宮後仍有殘餘的子宮內膜異位,應考慮加用孕激素。
5.15 遺傳性血管性水腫
對於患有遺傳性血管性水腫的婦女,外源性雌激素可能會使其血管性水腫的症狀加重。對此類婦女,應考慮雌激素(包括本品)治療的收益是否高於風險。
5.16 其它症狀的加重
雌激素治療(包括本品)可能導致以下症狀加重:哮喘、糖尿病、癲癇、偏頭痛、卟啉病、系統性紅斑狼瘡和肝臟血管瘤。如婦女有以上症狀,應考慮雌激素治療的收益是否高於風險。
5.17 注意:乙醇製劑易燃
將本品遠離明火或煙頭,直至完全乾燥。
5.18 和保濕霜的並用
在塗抹本品後一小時使用保濕霜,可使雌二醇的吸收有明顯增加。——參見“藥理毒理”(12.3)
5.19 實驗室檢測事項
血清促卵泡激素(FSH)和雌二醇水平,對中、重度血管舒縮症狀和中、重度外陰及陰道萎縮的管理不具備參考意義。
5.20 藥物與實驗室檢測指標的相互作用
雌激素可導致:
- 凝血酶原時間、凝血活酶時間、血小板凝聚時間加快;
血小板計數增加;
凝血因子 II、VII 抗原、VIII 抗原、VIII 促凝活性、IX、X、XII、VII-X 複合物和 II-VII-X 複合物增加;
β-血小板球蛋白增加;
凝血因子 Xa 抗體水平,抗凝血酶 III 水平及活性下降;
纖維蛋白原水平及活性升高;
纖溶酶原抗原及活性升高。 - 甲狀腺素結合球蛋白(TBG)水平升高,從而總循環甲狀腺素升高——通過對蛋白結合碘(PBI)、T4(色譜柱法或放射免疫法)、T3(放射免疫法)水平的測定而得;
T3 再攝取減少,反映出 TBG 水平的升高;
遊離 T4、遊離 T3 水平不變;
如婦女正接受甲狀腺素替代治療,可能需增加甲狀腺素劑量。 - 其它血清結合蛋白的增加,包括皮質類固醇結合球蛋白(CBG)和性激素結合球蛋白(SHBG)等,從而導致循環皮質類固醇和性激素等增加;
遊離睾酮、雌二醇等激素濃度可能下降;
其它血漿蛋白可能增加(例如血管緊張素原/腎素底物,α-1-抗胰蛋白酶,血漿銅藍蛋白等)。 - 血清高密度脂蛋白(HDL)和 HDL2 膽固醇亞組分濃度均升高;
低密度脂蛋白(LDL)膽固醇濃度降低;
甘油三酯水平升高。 - 糖耐量降低。
六、不良反應
以下嚴重不良反應已於他處提及:
6.1 臨牀試驗報告
因各臨牀試驗的條件不同,無法將一種藥物在臨牀試驗中的不良反應發生率,與另一種藥物的不良反應發生率進行直接比較;其也並非反映實際發生率。
有兩項對照性充分、為時 12 周的臨牀試驗對本品進行研究。本品 1.25 g 治療組和安慰劑組當中發生率 ≥5% 的藥物不良反應列於表一。
「表一」兩項對照充分的臨牀試驗中,本品治療組,即意向治療安全性人羣發生率 ≥5% 的藥物不良反應
| 系統器官分類 | 藥物不良反應 | 本品 1.25 g/天治療組 (168 人) | 安慰劑組 (73 人) |
|---|---|---|---|
| 全身性疾病 | 頭痛 | 9.5 | 2.7 |
| 消化道疾病 | 脹氣 | 5.4 | 4.1 |
| 泌尿和生殖系統疾病 | 乳房疼痛 | 10.7 | 8.2 |
在這兩項臨牀對照試驗中,本品治療組的“用藥部位反應”報告率為 0.6%。此外還提到瘙癢、皮疹等其它皮膚反應。
6.2 上市後的不良反應報告
本品獲准上市以來,發現的不良反應如下。這些不良反應來自使用者自發報告,規模不明,故無法準確估計其發生率、或建立與藥物暴露的病理關係。
- 生殖和泌尿系統疾病: 子宮內膜癌
- 乳房疾病: 乳房疼痛、乳房緊張感、乳腺癌
- 心血管疾病: 深靜脈血栓、心肌梗死、靜脈炎
- 胃腸道疾病: 噁心、腹脹、腹瀉、胃不適
- 皮膚疾病: 脱髮、皮疹、瘙癢、給藥部位症狀(幹皮,疼痛,變色,刺激反應,皮疹等)
- 眼部疾病: 視網膜靜脈阻塞
- 中樞神經系統疾病: 頭痛、眩暈、失眠、感覺減退、腦膜瘤、失語、智力遲鈍、感覺異常
- 其它: 藥效不足、潮熱、關節痛、盜汗、藥效減弱、四肢痛、疲乏、體重增加、疼痛、超敏反應、呼吸急促、惡性間葉瘤、血管性水腫、急性肝炎、面部水腫、意外接觸、肌陣攣、步態障礙、面紅
七、藥物相互作用
體外和體內研究表明,雌激素部分經細胞色素 P450 3A4(CYP3A4)代謝。因此,CYP3A4 誘導劑或抑制劑可能會影響雌激素的代謝。其中:
- CYP3A4 誘導劑:聖約翰草(貫葉連翹)製劑、苯巴比妥、卡馬西平與利福平等可降低雌激素的血漿濃度,從而可能減弱其療效、改變子宮出血譜;
- CYP3A4 抑制劑:紅黴素、克拉黴素、酮康唑、伊曲康唑、利托那韋與葡萄柚汁等均可增加雌激素的血藥濃度,並可能產生副作用。
八、特殊人羣用藥提示
8.1 妊娠婦女用藥
概述
本品不適用於妊娠婦女。儘管目前尚無本品用於妊娠婦女的資料,但在流行病學研究和薈萃分析中發現,受精前或妊娠早期暴露於複方激素類避孕藥(含雌激素和人工孕激素),不會導致生殖器或非生殖器先天畸形(如心臟畸形、短肢缺陷等)的風險增加。
在美國一般人羣中,臨牀認可的妊娠當中出現重大先天畸形和流產的背景頻率估計值,分別為 2~4% 和 15~20%。
8.3 哺乳期婦女用藥
在哺乳婦女中,雌激素可經乳汁分泌,且可導致乳汁分泌減少。乳汁分泌的減少隨時可能發生,但一旦母乳餵養趨於穩定,則該可能性會降低。應綜合考慮母乳餵養對嬰兒發育和健康的益處和哺乳婦女對本品的臨牀需求,以及本品或哺乳婦女的其它基礎狀況對被哺乳嬰兒的任何潛在不良影響。
8.4 兒童用藥
本品不適用於兒童患者。尚未對兒童患者用藥進行研究。
8.5 老年用藥
現有研究中,對於 65 歲以上老年婦女使用本品的反饋是否與較年輕受試者不同,尚缺乏足夠樣本來判斷。
“婦女健康倡議”研究
據 WHI 雌激素單藥研究報告,在給予 CE(0.625 mg/天)單藥治療的婦女中,65 歲以上者的卒中風險相對更高。——參見“警告和注意事項”(5.1) 和“臨牀研究資料”(14.3)
據 WHI 雌激素—孕激素複方研究報告,在給予 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療的婦女中,65 歲以上者的非致命性卒中和浸潤性乳腺癌風險相對更高。——參見“警告和注意事項”(5.1) 和“臨牀研究資料”(14.3)
“婦女健康倡議”認知研究
WHIMS 研究中,65~79 歲婦女接受雌激素單藥或雌激素—孕激素聯合治療後,疑似痴呆風險較安慰劑有所升高。——參見“警告和注意事項”(5.3) 和“臨牀研究資料”(14.4)
兩項子研究均僅對 65~79 歲婦女進行,其結論是否適用於較年輕的絕經後婦女尚不清楚。8 ——參見“警告和注意事項”(5.3) 和“臨牀研究資料”(14.4)
十、藥物過量
雌激素攝入過量可引起噁心、嘔吐、乳房緊張感、腹痛、睏倦和疲乏;婦女可能出現撤退性出血。過量管理措施有停止本品治療、對症治療等。
十一、藥物成分詳情
本品(雌二醇凝膠)為外用可吸收水醇凝膠,含雌二醇 0.06%,無色、透明,乾燥後無臭。每泵給予凝膠 1.25 g,其中含雌二醇 0.75 mg。
雌二醇為白色結晶粉末,化學名稱為雌甾-1,3,5(10)-三烯-3,17β-二醇,化學式:C18H24O2,分子量:272.39。化學結構式如下。
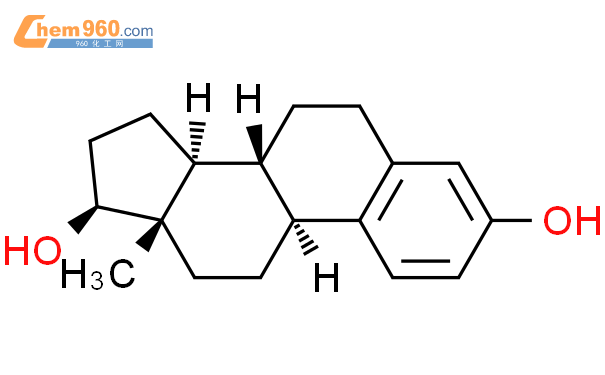
本品的活性成分為雌二醇。其餘成分均無藥理活性,包括:
- 純淨水
- 乙醇
- 三乙醇胺
- 卡波姆 934P
十二、藥理毒理
12.1 作用機理
內源性雌激素在促進女性生殖系統和第二性徵的發育和維持方面,起到很大作用。人體內諸循環雌激素在代謝相互轉化作用下處於動態準平衡,但其中雌二醇是最主要的胞內雌激素,對胞內受體的效力也遠高於雌酮、雌三醇等代謝物。
在月經週期正常的成年女性中,雌激素主要來自卵巢卵泡;其每日可分泌 70~500 μg 雌二醇,分泌量依月經週期階段而異。絕經後,內源性雌激素大多系由腎上腺皮質分泌的雄烯二酮經外周組織轉化而來的雌酮;因此,雌酮及其硫酸結合物:硫酸雌酮,構成了絕經後婦女體內循環雌激素的絕大部分。
雌激素通過與靶組織的細胞受體結合而發揮作用。迄今已發現兩種雌激素受體;二者在不同組織中的分佈比例各異。
循環雌激素可通過一種負反饋機制,調節腦垂體促性腺激素(促黃體激素,即 LH,和促卵泡激素,即 FSH)的分泌。在絕經後婦女中,可見雌激素對這兩種激素的水平有降低作用。
12.2 藥效學特性
血清雌激素濃度一般不能用於推測婦女個體對本品治療的反饋,或發生不良結局的風險。同樣地,將不同雌激素製劑用於婦女個體時,也可能無法通過藥物暴露量的比較來判斷其效力或安全性。
12.3 藥代動力學特性
吸收
雌二醇遵循被動分佈過程,經皮吸收,進入全身循環。吸收速率受角質層擴散速率所限。本品用於皮膚後,需 2~5 分鐘乾燥。
有 24 名絕經後婦女每日將本品 1.25 g(含雌二醇 0.75 mg)用於手臂後部,持續 14 日。在第 14 日,血清雌二醇、雌酮濃度峯值的平均數分別為 46.4 pg/mL 和 64.2 pg/mL。第 14 日用藥後,24 小時平均血清雌二醇、雌酮濃度分別為 28.3 pg/mL 和 48.6 pg/mL。未經修正的第 14 天雌二醇、雌酮平均濃度—時間曲線見圖一。
「圖一」連續 14 日給予本品 1.25 g 之後,未經修正的雌二醇、雌酮平均血清濃度—時間曲線

當每日給予本品 2.5 g 時(兩臂各塗抹 1.25 g),血清雌二醇濃度於第三日達到穩態。
分佈
外源性雌激素的分佈特性與內源性雌激素相似。雌激素廣泛分佈於全身,在性激素靶器官內的分佈濃度普遍更高。隨血液循環的雌激素大多與 SHBG 和白蛋白結合。
代謝
外源性雌激素遵循內源性雌激素的代謝途徑。諸循環雌激素在代謝相互轉化作用下處於動態準平衡。雌激素的轉化主要經肝臟進行。雌二醇可與雌酮相互轉化;二者可轉化為雌三醇,後者是經尿液排泄的主要代謝物。
雌激素在肝臟經硫酸、葡萄糖醛酸化之後,結合物進入肝腸循環,隨膽汁排出進入腸道,後經水解被腸道再吸收。在絕經後婦女中,循環雌激素相當一部分由硫酸結合物構成,尤其是硫酸雌酮;其可作為其它更高效力的雌激素的來源。
本品給予的雌二醇避免了肝臟首過效應,但其臨牀意義尚不清楚。
排泄
雌二醇、雌酮和雌三醇以葡萄糖醛酸和硫酸結合物的形式,從尿液排出。
給予本品 1.25 g 之後,雌二醇的表觀清除半衰期約為 36 小時。
清洗用藥部位造成的影響
有 24 名健康絕經後婦女連續 14 日給予本品 1.25 g/天,期間就清洗用藥部位對血清雌二醇濃度的影響進行評價。用藥後一小時清洗用藥部位,導致了血清雌二醇濃度 24 小時均值下降 22%。
因身體接觸造成雌二醇轉移的可能性
有 24 名健康絕經後婦女持續 14 日通過後臂給予本品 1.25 g/天,期間就雌二醇轉移的可能性進行評價。每日用藥後一小時,令 24 名未用藥的健康絕經後婦女直接接觸用藥者的用藥部位,接觸時長為 15 分鐘。觀察到接觸後,未用藥者體內的血清雌二醇濃度均值未發生改變。
保濕霜/防曬霜對雌二醇吸收的影響
有一項隨機非盲三期交叉試驗,就防曬霜和保濕霜用於 42 名健康絕經後婦女時,對經外用 0.06% 雌二醇凝膠給予的雌二醇之吸收的影響進行評價。結果表明,七日內每日給予外用 0.06% 雌二醇凝膠之後一小時塗抹防曬霜,導致雌二醇 24 小時總暴露劑量(AUC0-24h)和濃度峯值(Cmax)平均下降 16%;七日內每日給予外用 0.06% 雌二醇凝膠之後一小時塗抹保濕霜,導致雌二醇 AUC0-24h 和 Cmax 平均分別上升 38% 和 73%。
尚未就防曬霜/保濕霜先於外用 0.06% 雌二醇凝膠使用時,對雌二醇吸收的影響進行研究。
十三、非臨牀毒理資料
13.1 對動物的致癌性、致突變性與不育作用
在某些動物種類中,長期連續給予天然和人工雌激素使得乳腺、子宮、宮頸、陰道、睾丸和肝臟癌症的頻率增加。
十四、臨牀研究資料
14.1 本品對絕經後婦女的血管舒縮症狀的影響
有一項安慰劑對照研究,將 145 名絕經後婦女(年齡介乎 29~67 歲,白人佔 81.4%)隨機分配到本品 1.25 g(雌二醇 0.75 mg)治療組或凝膠安慰劑組,持續 12 周;在第 4 周和第 12 周評價療效。第 4 周和第 12 周可見中、重度潮熱頻率有統計意義的下降。詳見表二。
「表二」意向治療人羣的日均潮熱發病數和症狀程度分級平均值變化,基於末次觀測值結轉
| 日均潮熱病例數 (中至重度) | 日均症狀程度分級 (輕至重度) | |||
|---|---|---|---|---|
| 安慰劑組 (73 人) | Estrogel 治療組 (0.06%, 1.25g) (72 人) | 安慰劑組 (73 人) | Estrogel 治療組 (0.06%, 1.25g) (72 人) | |
| 基線 | ||||
| 平均值(標準差) | 11.01 (5.66) | 10.33 (3.07) | 2.30 (0.24) | 2.36 (0.29) |
| 第四周(1) | ||||
| 平均值(標準差) | 5.95 (5.17) | 4.43 (4.13) | 2.00 (0.63) | 1.73 (0.73) |
| 均值較基線之差(標準差) | -5.06 (4.91) | -5.91 (3.68) | -0.31 (0.62) | -0.63 (0.71) |
| 與安慰劑組之差 | 0.85 | 0.32 | ||
| P(2) | 0.019(3) | 0.005(3) | ||
| 第十二週(1) | ||||
| 平均值(標準差) | 5.17 (6.52) | 2.79 (3.70) | 1.76 (0.84) | 1.33 (0.97) |
| 均值較基線之差(標準差) | -5.84 (4.52) | -7.55 (3.52) | -0.54 (0.84) | -1.03 (0.94) |
| 與安慰劑組之差 | 1.71 | 0.49 | ||
| P(2) | 0.043(3) | <0.001(3) | ||
(1) 主要監測時間點。
(2) 以 Elteren 非參數檢驗取 P 值。
(3) 與安慰劑組之差有統計意義。
14.2 本品對絕經後婦女的外陰及陰道萎縮的影響
組織活檢顯示,連續給予本品 1.25 g 至第十二週,陰道壁淺表上皮細胞佔比相較基線有明顯增加(P ≤0.001)。同時觀察到安慰劑組的變化不明顯。
14.3 美國“婦女健康倡議”研究結果
美國“婦女健康倡議”(WHI)研究招募約 27000 名絕經後婦女(大多健康)參與兩項子研究,以評價口服 CE(0.625 mg/天)單藥治療或與 MPA(2.5 mg/天)聯合治療在對某些慢性疾病的作用上,相較安慰劑有何風險及收益。
治療中的主要終點為冠心病(CHD,分為非致命性心肌梗死、靜息性心梗和 CHD 猝死)發生;治療中的主要不良結局為浸潤性乳腺癌。研究還記錄初次發生 CHD、浸潤性乳腺癌、卒中、PE、子宮內膜癌(僅限 CE—MPA 複方子研究)、結直腸癌、髖骨骨折或非上述原因導致的死亡的人數,作為“總髮病率”(global index)。兩項子研究均未評價 CE 單藥或 CE—MPA 複方對圍絕經期症狀的作用。
WHI 雌激素單藥研究
WHI 雌激素單藥研究在早期觀察到卒中風險升高,隨即被中止;研究認為,無法按預設的主要終點收集更多有關雌激素單藥的風險及收益的資料。
該研究納入 10739 名婦女(平均年齡 63 歲,範圍 50~79 歲;白人佔 75.3%,黑人佔 15.1%,西班牙裔佔 6.1%,其餘人種佔 3.6%),平均跟蹤 7.1 年後所得結果見表三。
「表三」WHI 雌激素單藥研究中的相對和絕對風險觀測結果(1)
| 不良反應事件 | CE 相對安慰劑的風險比率 (95% 粗置信區間(2)) | CE 治療組(5310 人) 每萬人·年絕對風險率 | 安慰劑組(5429 人) 每萬人·年絕對風險率 |
|---|---|---|---|
| CHD 事件(3) | 0.95 (0.78-1.16) | 54 | 57 |
| - 非致命性心梗 (3) | 0.91 (0.73-1.14) | 40 | 43 |
| - CHD 猝死 (3) | 1.01 (0.71-1.43) | 16 | 16 |
| 卒中(3) | 1.33 (1.05-1.68) | 45 | 33 |
| - 缺血性卒中 (3) | 1.55 (1.19-2.01) | 38 | 25 |
| 深靜脈血栓(3)(4) | 1.47 (1.06-2.06) | 23 | 15 |
| 肺栓塞(3) | 1.37 (0.90-2.07) | 14 | 10 |
| 浸潤性乳腺癌(3) | 0.80 (0.62-1.04) | 28 | 34 |
| 結直腸癌(5) | 1.08 (0.75-1.55) | 17 | 16 |
| 髖骨骨折(3) | 0.65 (0.45-0.94) | 12 | 19 |
| 腰椎骨折(3)(4) | 0.64 (0.44-0.93) | 11 | 18 |
| 下臂/腕骨折(3)(4) | 0.58 (0.47-0.72) | 35 | 59 |
| 所有骨折(3)(4) | 0.71 (0.64-0.80) | 144 | 197 |
| 非以上原因導致的死亡(5)(6) | 1.08 (0.88-1.32) | 53 | 50 |
| 總死亡率(3)(4) | 1.04 (0.88-1.22) | 79 | 75 |
| “總髮病率”(7) | 1.02 (0.92-1.13) | 206 | 201 |
(1) 彙總自 WHI 的多份公開發表材料。材料可於此查閲:nhlbi.nih.gov/whi
(2) “粗置信區間”即未按多重視圖和多重比較進行修正的置信區間。
(3) 結果基於平均跟蹤 7.1 年後集中評審的數據。
(4) 未納入“總髮病率”統計。
(5) 結果為平均跟蹤 6.8 年後所得。
(6) 除乳腺癌、結直腸癌、確診或疑似 CHD、PE、腦血管疾病以外的任何原因導致的死亡。
(7) “總髮病率”包括初次發生 CHD 事件、浸潤性乳腺癌、卒中、肺栓塞、結直腸癌、髖骨骨折或非以上原因導致的死亡的人數。
在被 WHI“總髮病率”所納入的不良反應中,以下不良反應有統計意義的明顯變化:9
- 卒中:每萬人·年增加 12 例
- 髖骨骨折:每萬人·年減少 7 例
治療組的“總髮病率”所列不良反應的絕對風險率每萬人·年增加 5 例,無統計意義。兩組的總死亡率無差異。
研究結果顯示,平均跟蹤 7.1 年後,CE 單藥治療組和安慰劑組婦女之間的主要 CHD 事件(非致命性心梗、靜息性心梗和 CHD 猝死)以及浸潤性乳腺癌發生率總體無差異。詳見表三。
經集中評審的結果顯示,平均跟蹤 7.1 年後,CE 單藥治療組和安慰劑組婦女之間發生卒中的亞型分佈和嚴重性(含致命性卒中)無統計意義的差異。雌激素單藥可增加缺血性卒中的風險,且各組別婦女均發現此現象。10
激素治療開始相對於圍絕經期開始的時間差,可能會影響總體風險—收益。WHI 雌激素單藥研究顯示,在處於 50~59 歲年齡層的婦女中,CHD 和總死亡率風險有下降趨勢,但無統計意義(其中 CHD 危險比率 0.63,95% 置信區間 0.36~1.09;總死亡率危險比率 0.71,95% 置信區間 0.46~1.11)。
WHI 雌激素—孕激素複方研究
WHI 雌激素—孕激素複方研究在早期觸發預設的中止條件,隨即被中止。平均治療並跟蹤 5.6 年後,觀察到“總髮病率”所列事件中的浸潤性乳腺癌及心血管事件風險增加,以至大於預期收益。治療組“總髮病率”所列事件的絕對風險率每萬人·年增加 19 例。
對 CE—MPA 聯合治療組婦女平均跟蹤 5.6 年後,在 WHI“總髮病率”所列事件中,以下事件的絕對風險率有統計意義的明顯變化:
- CHD 事件:每萬人·年增加 7 例
- 卒中:每萬人·年增加 8 例
- PE:每萬人·年增加 10 例
- 浸潤性乳腺癌:每萬人·年增加 8 例
- 結直腸癌:每萬人·年減少 6 例
- 髖骨骨折:每萬人·年減少 5 例
研究納入 16608 名婦女(平均年齡 63 歲,範圍 50~79 歲;白人佔 83.9%,黑人佔 6.8%,西班牙裔佔 5.4%,其他人種佔 3.9%),平均跟蹤 5.6 年後集中評審所得結果見表四。
「表四」平均跟蹤 5.6 年後,WHI 雌激素—孕激素複方研究的相對和絕對風險率觀測結果(1)(2)
| 不良反應事件 | CE/MPA 相較安慰劑的風險比率 (95% 粗置信區間(3)) | CE/MPA 治療組(8506 人) 每萬人·年絕對風險率 | 安慰劑組(8102 人) 每萬人·年絕對風險率 |
|---|---|---|---|
| CHD 事件 | 1.23 (0.99-1.53) | 41 | 34 |
| - 非致命性心梗 | 1.28 (1.00-1.63) | 31 | 25 |
| - CHD 猝死 | 1.10 (0.70-1.75) | 8 | 8 |
| 卒中 | 1.31 (1.03-1.68) | 33 | 25 |
| - 缺血性卒中 | 1.44 (1.09-1.90) | 26 | 18 |
| 深靜脈血栓(4) | 1.95 (1.43-2.67) | 26 | 13 |
| 肺栓塞 | 2.13 (1.45-3.11) | 18 | 8 |
| 浸潤性乳腺癌(5) | 1.24 (1.01-1.54) | 41 | 33 |
| 結直腸癌 | 0.61 (0.42-0.87) | 10 | 16 |
| 子宮內膜癌(4) | 0.81 (0.48-1.36) | 6 | 7 |
| 宮頸癌(4) | 1.44 (0.47-4.42) | 2 | 1 |
| 髖骨骨折 | 0.67 (0.47-0.96) | 11 | 16 |
| 腰椎骨折(4) | 0.65 (0.46-0.92) | 11 | 17 |
| 下臂/腕骨折(4) | 0.71 (0.59-0.85) | 44 | 62 |
| 所有骨折 | 0.76 (0.69-0.83) | 152 | 199 |
| 總死亡率(6) | 1.00 (0.83-1.19) | 52 | 52 |
| “總髮病率”(7) | 1.13 (1.02-1.25) | 184 | 165 |
(1) 彙總自 WHI 的多份公開發表材料。材料可於此查閲:nhlbi.nih.gov/whi
(2) 結果基於集中評審的數據。
(3) “粗置信區間”即未按多重視圖和多重比較進行修正的置信區間。
(4) 未納入“總髮病率”統計。
(5) 含轉移性和非轉移性乳腺癌,但乳腺原位癌除外。
(6) 除乳腺癌、結直腸癌、確診或疑似 CHD、PE、腦血管疾病以外的任何原因導致的死亡。
(7) “總髮病率”包括初次發生 CHD 事件、浸潤性乳腺癌、卒中、肺栓塞、結直腸癌、髖骨骨折或非以上原因導致的死亡的人數。
激素治療開始相對於圍絕經期開始的時間差,可能會影響總體風險—收益。WHI 雌激素—孕激素複方研究顯示,在處於 50~59 歲年齡層的婦女中,總死亡率風險有下降趨勢,但無統計意義(危險比率 0.69,95% 置信區間 0.44~1.07)。
14.4 美國“婦女健康倡議”認知研究結果
WHIMS 雌激素單藥研究,旨在對比 CE 單藥(0.625 mg/天)和安慰劑對疑似痴呆(主要治療結局)的影響,其中招募了 2947 名已切除子宮的 65 歲以上絕經後婦女(大多健康;65~69 歲佔比 45%,70~74 歲佔比 36%,75 歲以上佔 19%)。
平均跟蹤 5.2 年後,CE 單藥治療組相對安慰劑組的疑似痴呆風險比率為 1.49(95% 置信區間 0.83~2.66);絕對風險率則分別為每萬人·年 37 例和 25 例。研究中將阿爾茲海默症(AD)、血管性痴呆(VaD)和混合症狀(同時具備 AD 和 VaD 特徵)均視作疑似痴呆。治療組和安慰劑組最常見的疑似痴呆歸類為 AD。該研究僅對 65~79 歲婦女進行,其結論是否適用於較年輕的絕經後婦女尚不清楚。——8 ——參見“警告和注意事項”(5.3) 和“特殊人羣用藥”(8.5)
WHIMS 雌激素—孕激素複方研究,旨在對比 CE(0.625 mg/天)、MPA(2.5 mg/天)複方和安慰劑對疑似痴呆(主要治療結局)的影響,其中招募了 4532 名 65 歲以上絕經後婦女(大多健康;65~69 歲佔比 47%,70~74 歲佔比 35%,75 歲以上佔 18%)。
平均跟蹤 4 年後,CE—MPA 複方治療組的疑似痴呆相對風險率為 2.05(95% 置信區間 1.21~3.48);絕對風險率則為每萬人·年 45 例(安慰劑組:22 例)。研究中將 AD、VaD 和混合症狀(同時具備 AD 和 VaD 特徵)均視作疑似痴呆。治療組和安慰劑組最常見的疑似痴呆歸類為 AD。該研究僅對 65~79 歲婦女進行,其結論是否適用於較年輕的絕經後婦女尚不清楚。 ——參見“警告和注意事項”(5.3) 和“特殊人羣用藥”(8.5)
綜合兩組 WHIMS 研究羣體的數據之後,報告的疑似痴呆總相對風險率為 1.76(95% 置信區間 1.19~2.60)。組別之間的差異自治療第一年起顯現。尚不清楚以上結論是否適用於較年輕的絕經後婦女。 ——參見“警告和注意事項”(5.3) 和“特殊人羣用藥”(8.5)
十五、參考文獻
- Rossouw JE, et al. Postmenopausal Hormone Therapy and Risk of Cardiovascular Disease by Age and Years Since Menopause. JAMA. 2007;297:1465- 1477. DOI: 10.1001/jama.297.13.1465
- Hsia J, et al. Conjugated Equine Estrogens and Coronary Heart Disease. Arch Int Med. 2006;166:357-365. DOI: 10.1001/archinte.166.3.357
- Curb JD, et al. Venous Thrombosis and Conjugated Equine Estrogen in Women Without a Uterus. Arch Int Med. 2006;166:772-780. DOI: 10.1001/archinte.166.7.772
- Cushman M, et al. Estrogen Plus Progestin and Risk of Venous Thrombosis. JAMA. 2004;292:1573-1580. DOI: 10.1001/jama.292.13.1573
- Stefanick ML, et al. Effects of Conjugated Equine Estrogens on Breast Cancer and Mammography Screening in Postmenopausal Women With Hysterectomy. JAMA. 2006;295:1647-1657. DOI: 10.1001/jama.295.14.1647
- Chlebowski RT, et al. Influence of Estrogen Plus Progestin on Breast Cancer and Mammography in Healthy Postmenopausal Women. JAMA. 2003;289:3234-3253. DOI: 10.1001/jama.289.24.3243
- Anderson GL, et al. Effects of Estrogen Plus Progestin on Gynecologic Cancers and Associated Diagnostic Procedures. JAMA. 2003;290:1739-1748. DOI: 10.1001/jama.290.13.1739
- Shumaker SA, et al. Conjugated Equine Estrogens and Incidence of Probable Dementia and Mild Cognitive Impairment in Postmenopausal Women. JAMA. 2004;291:2947-2958. DOI: 10.1001/jama.291.24.2947
- Jackson RD, et al. Effects of Conjugated Equine Estrogen on Risk of Fractures and BMD in Postmenopausal Women With Hysterectomy: Results From the Women’s Health Initiative Randomized Trial. J Bone Miner Res. 2006;21:817-828. DOI: 10.1359/jbmr.060312
- Hendrix SL, et al. Effects of Conjugated Equine Estrogen on Stroke in the Women’s Health Initiative. Circulation. 2006;113:2425-2434. DOI: 10.1161/CIRCULATIONAHA.105.594077
十六、本品性狀、包裝及貯藏事項
16.1 本品性狀及包裝
本品為無色透明水醇凝膠,含雌二醇 0.06%。本品以非噴霧式按壓泵的形式提供。泵體包含低密度聚乙烯內層、硬塑料殼體和可複用聚丙烯塑料蓋。
每瓶含凝膠 50 克(1.75 盎司),每次定量給予 1.25 克,共可使用 30 次。
NDC: 17139-617-40(50 克裝)
16.2 貯藏事項
將本品置於幼童不可觸及之處。
20~25°C(68~77°F)保存,可於超出一定限度的 15~30°C(59~86°F)保存。——見《美國藥典》(USP)定義“室內恆温”
十七、對患者的勸告提示
建議患者閲讀經 FDA 批准、供患者使用的説明書和用藥指導。
陰道出血
提醒絕經後婦女,如發生任何陰道出血,需立即向醫師報告。——參見“警告和注意事項”(5.2)
雌激素單藥治療相關的潛在嚴重不良反應
提醒絕經後婦女,雌激素單藥治療可導致心血管疾病、惡性腫瘤和疑似痴呆等嚴重不良反應。——參見“警告和注意事項”(5.1, 5.2, 5.3)
雌激素單藥治療相關的常見不良反應
提醒絕經後婦女,雌激素單藥治療可導致頭痛、乳房疼痛和緊張感、噁心、嘔吐等症狀較輕但較常見的不良反應。
供患者使用的説明書
EstroGel® 0.06% (ĕs’trə jĕl) (雌二醇凝膠)
在您開始使用 Estraderm 貼片之前,請先閲讀本患者用説明書,並在每次複診開藥時再次閲讀所有內容。可能會有新增的內容。本説明書不能取代您的醫師——您仍需向醫師洽談您的更年期症狀或治療狀況。
有哪些有關 EstroGel(雌激素)的重要信息是需要我瞭解的?
- 雌激素單藥治療可增加您罹患子宮癌症的幾率。
如您在使用本品期間出現任何陰道異常出血,請立即向醫師報告。絕經後出現陰道出血可能是子宮癌症的前兆。應由醫師檢查陰道異常出血的起因。 - 請勿將雌激素單藥用於預防心臟病、卒中或痴呆(大腦功能減退)。
- 雌激素單藥治療可增加您罹患卒中或血栓的幾率。
- 據一項針對 65 歲以上婦女的研究結果,雌激素單藥治療可增加您罹患痴呆的幾率。
- 請勿將雌激素、孕激素複方用於預防心臟病、卒中或痴呆。
- 雌激素、孕激素聯合治療可增加您罹患心肌梗死、卒中、乳腺癌或血栓的風險。
- 據一項針對 65 歲以上婦女的研究結果,雌激素、孕激素聯合治療可增加您罹患痴呆的幾率。
- 迄今僅有一種雌激素單方製劑和劑量被發現可增加您罹患卒中、血栓和痴呆的幾率。迄今僅有一種雌激素—孕激素複方和劑量被發現可增加您罹患心肌梗死、卒中、乳腺癌、血栓和痴呆的風險。其它製劑或劑量尚未被以同樣的方式進行研究,因此尚不清楚使用本品會對您罹患上述疾病的幾率有何影響。您應定期與醫師洽談是否仍有必要使用本品治療。
什麼是 EstroGel?
本品是一種處方藥用凝膠,內含雌二醇(一種雌激素)。
EstroGel 的用途有哪些?
本品用於更年期後的:
- 中、重度潮熱的緩解。
雌激素是由婦女體內卵巢分泌的一種激素。一般當婦女處於 45~55 歲時,卵巢將停止分泌雌激素。體內雌激素水平的下滑會帶來“更年期”或者是絕經期——此時每月固定的月經週期將停止。有人在正常絕經期前便已切除兩側卵巢;這會導致雌激素水平急劇下滑,即“手術性絕經”。
當雌激素水平開始下滑,有的婦女會感到異常不適;例如,她們會感到面部、頸部和胸部在發熱,或者突然有灼熱感並伴有出汗(即“潮熱”)。一些婦女症狀較輕,無需使用雌激素;其他婦女症狀可能會更嚴重。 - 陰道內和陰道外圍的中、重度病變的治療。
您應定期與醫師洽談是否需以本品調節該病情。如您的訴求僅限於更年期陰道內和陰道外圍的中、重度改變,請和醫師洽談是否適用陰道外用藥。
哪些人不能使用 EstroGel?
如您有以下情況,請勿開始使用本品:
- 異常的陰道出血
絕經後出現陰道出血可能是子宮癌症的前兆。應由醫師檢查陰道異常出血的起因。 - 曾確診有出血性疾病
- 現有特定的腫瘤,或有既往史
雌激素可增加乳房、子宮等發生癌症的幾率。如您現有癌症或有既往史,請與醫師洽談是否應以本品治療。 - 卒中或心梗既往史
- 血栓,或有既往史
- 肝臟疾病,或有既往史
- 對本品及任一成分過敏
本品成分詳見文末。
請將以下情形告知醫師:
- 有任何異常的陰道出血: 絕經後陰道出血可能是子宮癌症的前兆。應由醫師檢查陰道異常出血的起因。
- 有任何在使用本品期間可能加重的症狀: 如您患有哮喘、癲癇、糖尿病、偏頭痛、子宮內膜異位、狼瘡、血管性水腫(面部和舌頭腫脹),或者心臟、肝臟、甲狀腺、腎臟疾病,或血鈣水平高,應由醫師進行細緻檢查。
- 即將接受手術或長期卧牀: 這種情況下,醫師可能會提醒您需停用本品。
- 妊娠,或有妊娠可能: 本品不適用於妊娠婦女。
- 正在哺乳: 本品所含激素可分泌到母乳中。
請將您正服用的一切藥物告知醫師,包括處方藥、非處方藥、維生素和草本營養品等。有的藥物可能會影響本品的作用;本品也可能會影響其它藥物的作用。將您的這些藥物記於一份清單,並在開出新藥時交給醫師和藥師。
我該如何使用 EstroGel?
用藥指導詳見説明書末尾。
- 謹遵醫囑使用。
- 本品僅可用於皮膚。
- 本品含有易燃物酒精。將本品遠離明火或煙頭,直至完全乾燥。
- 您應定期(如每 3~6 個月)與醫師洽談當前劑量,並決定是否仍有必要以本品治療。
EstroGel 可能的副作用有哪些?
治療期間可能會發生的不良反應如下,按嚴重程度和發生頻率進行劃分。
嚴重、但不常見的不良反應包括:
- 心肌梗死
- 卒中
- 血栓
- 乳腺癌
- 子宮內膜癌
- 卵巢癌
- 痴呆
- 血鈣過高或過低
- 膽囊疾病
- 視力異常
- 高血壓
- 高血脂(高甘油三酯血癥)
- 肝臟疾病
- 甲狀腺素水平改變
- 體液瀦留
- 異位子宮內膜癌性病變
- 子宮良性肌瘤的增大
- 有血管性水腫既往史的婦女可能出現血管性水腫(面部和舌頭腫脹)惡化
- 實驗室檢測結果改變,包括出血時間、高血糖等
如您發現以下任何徵兆,或任何其它異常症狀,請即聯繫醫師:
- 新發的乳腺腫塊
- 異常的陰道出血
- 視力或聲音改變
- 新發的嚴重急性頭痛
- 嚴重胸痛、腿痛,可能伴有呼吸急促、虛弱和疲乏
- 嘴唇、舌頭和麪部腫脹,可能伴有發癢的紅疹
症狀較輕、但較常見的不良反應包括:
- 頭痛
- 乳房疼痛或緊張感
- 胃/腹絞痛,腹脹
- 噁心、嘔吐
- 脱髮
- 體液瀦留
- 陰道酵母菌感染
本品可能的不良反應不止於此。有關不良反應詳情及建議,請諮詢醫師或藥師。如有任何惱人且持續的副作用,請告知醫師。如需報告副作用,可致電 FDA:1-800-FDA-1088;或致電美國 ASCEND Therapeutics® 有限公司:1-877-204-1013。
如何降低使用 EstroGel 出現嚴重副作用的幾率?
- 定期與醫師洽談,決定是否應繼續以本品治療。
- 如您有子宮,請與醫師洽談是否有必要加用一種孕激素。
一般推薦有子宮的婦女加用孕激素,以降低罹患子宮癌症的幾率。 - 如使用本品期間出現任何陰道出血,請即聯繫醫師處置。
- 除醫囑另有指示之外,每年接受一次骨盆檢查、乳房檢查和乳腺 X 光掃描。
如家族成員有乳腺癌既往史,或您曾出現乳房腫塊或乳腺 X 光結果異常,可能需加大檢查頻次。 - 如您患有高血壓、高膽固醇(高血脂)、糖尿病,或肥胖,或正在吸煙,您罹患心臟病的幾率可能更高。請向醫師諮詢如何降低心臟病出現的幾率。
如何保存 EstroGel?
- 68~77°F(20~25°C)室温保存。
將本品置於孩童不可觸及之處。
如何安全、有效使用本品的一般説明
藥物有時按説明書外用途開出。請勿將本品超處方範圍使用。請勿將本品給予他人,即使有相同的症狀;本品可能對他人有害。
您可向醫師或藥師索要供專家使用的説明書。
如需更多信息可訪問 estrogel.com,或致電美國 ASCEND Therapeutics® 有限公司:1-877-204-1013。
EstroGel 的成分有哪些?
活性成分: 雌二醇
非活性成分: 純淨水、乙醇、三乙醇胺、卡波姆 934P
用藥指導
請在開始使用本品之前閲讀《用藥指導》,並在每次複診開藥後再次閲讀。可能會有新增的內容。本説明書不能取代您的醫師——您仍需向醫師洽談您的更年期症狀或治療狀況。
您需獲得如下圖所示的產品,以使用本品。

本品以定量按壓泵的形式提供,每次按壓可給予一定量的雌二醇,用於皮膚。每瓶 50 克。
| 步驟 | 詳解 |
|---|---|
步驟一:填充泵頭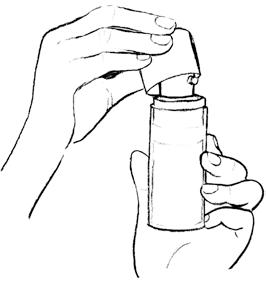 | 開始使用前,須先填充泵頭。 瓶內預留藥劑,可供初次使用前的填充。 打開瓶上的大塑料蓋,如左所示。 緩緩按壓泵頭到底,重複 5 次。不得使用填充時擠出的凝膠。清洗乾淨,以免他人誤觸。 填充後即可開始使用。每次充分按壓可給予等量的凝膠。 |
步驟二:塗抹凝膠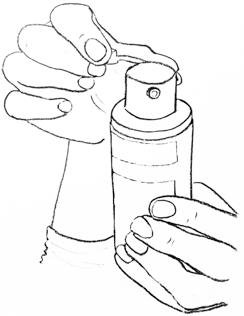 | 切勿讓他人代為塗抹本品。 將本品塗抹於潔淨、乾燥、無破損部位的皮膚。 本品應於沐浴後使用。如需游泳,儘量錯開用藥和游泳的時間。 如泵頭上有小蓋,請打開它,如左圖所示。 |
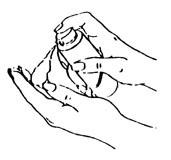 | 使用時,將泵頭對準掌心,輕緩、充分按壓泵頭,如左圖所示。 |
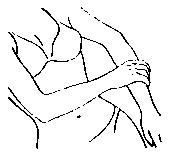 | 用手將本品塗抹於另一側手臂,如左圖所示。 |
 | 將本品攤薄於手腕至肩部之間的整個手臂,如左圖所示。 切勿直接塗抹於乳房或陰道內及其外圍。 塗抹處不得受到摩擦。凝膠需 5 分鐘乾燥,乾燥後方可着衣。 |
| 步驟三:用藥後的操作 | 依次將小蓋和大蓋蓋好。 用藥後請即以清水和香皂清洗雙手。 這會降低他人經手觸及藥品的幾率。 用藥後至少一小時內,切勿讓他人接觸用藥部位。 本品未乾燥時是易燃的。需待本品乾燥,方可吸煙或接近明火。 |
| 步驟四:棄置用完的藥瓶 | 本品預留的藥劑可供填充(完全按壓 5 次)和 30 次用藥。 在填充和 30 次用藥完成後,您需棄置藥瓶。 此時即使尚有殘餘藥劑也不得繼續使用;殘留劑量可能不足一次所需。 |
《患者用説明書》和《用藥指導》已經美國食品藥品監管局批准。
委託商:
ASCEND Therapeutics® US, LLC
Herndon, VA 20170
生產企業:
DPT Laboratories Ltd
San Antonio, TX 78215
141263Rev082022
技術源自 EHG®
©2022 ASCEND Therapeutics® US, LLC
修訂日期:2023 年 12 月