譯者按: 本文為日本富士製藥工業株式會社的戊酸雌二醇注射劑(Progynon Depot,10 mg)説明書翻譯。説明書原文:fuji-pharma.jp/docs/176/document_176.pdf。
請仔細閲讀説明書並在醫師指導下使用
長效雌激素製劑
戊酸雌二醇注射液
プロギノン・デポー筋注10mg
Progynon®-Depot intramuscular injection
日本標準商品分類編號:872473
批准文號:22000AMX00547
上市日期:1956 年 9 月
貯存方法:室温保存
有效期:五年
處方藥(注)
(注) 注意:謹遵醫師等處方箋使用
2023 年 7 月修訂(第一版)
二、禁忌症
有以下症狀的患者不得給予本品:
- 現有或疑似雌激素依賴性惡性腫瘤(如乳腺癌、子宮內膜癌等)。
本品可能導致相關腫瘤惡化或顯性化。——參見 8.2 節 - 有乳腺癌既往史。
本品可能導致乳腺癌復發。——參見 8.2 節 - 未治療的子宮內膜增生。
子宮內膜增生可能與細胞異型有關。——參見 8.2 節 - 血栓性靜脈炎、肺栓塞,或有既往史。
本品可能導致症狀惡化或復發。——參見 11.1.1 節 - 動脈血栓栓塞(如冠心病、腦卒中等),或有既往史。——詳見 11.1.1 節、15.1.3 節、15.1.4 節
- 重度肝臟疾病。——詳見 9.3.1 節
- 未確診的生殖器異常出血。
如該症狀由子宮內膜癌引起,本品可能導致癌症惡化或顯性化。——參見 8.2 節 - 現有或疑似妊娠。——參見 9.5.1 節
三、成分·性狀
3.1 成分
- 商品名:プロギノン・デポー筋注10mg
- 成分及含量:每支 1 mL,含戊酸雌二醇 10 mg
- 輔料:芝麻油
3.2 製劑性狀
- 商品名:プロギノン・デポー筋注10mg
- 色澤與性狀:微黃色透明油性液體
- 劑型:注射劑(安瓿瓶)
四、適應症
- 停經
- 月經紊亂(月經少發或多發)
- 月經出血量異常(過少或過多)
- 痛經
- 功能失調性子宮出血
- 子宮發育不全
- 卵巢缺乏綜合症
- 更年期綜合症
- 不孕症
五、與適應症有關的注意事項
停經
持續性停經患者,在最後一次月經結束後至少八週內不得使用本品。
六、用法用量
戊酸雌二醇用於成人,通常每 1~4 周肌注一次,每次 5~10 mg。應視症狀適當調整劑量。
八、重要提示
- 據外國報告,女性長期並用雌激素與孕激素製劑後,發生乳腺癌的風險高於對照組女性,且該風險隨用藥時長增大;因此,使用本品時,應對患者的風險—收益進行慎重考慮,且以最小必要劑量使用。不得長期盲目使用本品。——參見 15.1.2 節
- 使用本品前,必須採集患者個人病史和家族史,進行乳房及婦科檢查(有子宮的患者應進行子宮內膜活檢,並以超聲波對子宮內膜厚度進行檢查)。
開始使用本品後,應定期進行乳房及婦科檢查。——參見 2.1、2.2、2.3、2.7 節,9.1.1、9.1.3、9.1.4 節
九、有特殊情況的患者之注意事項
9.1 有併發症、既往史等的患者用藥
- 有乳腺癌家族性風險;乳房結節;乳腺炎;或乳腺掃描結果異常:
本品可能導致相關症狀惡化。——參見 8.2 節 - 術前,或長期卧牀不動:
本品導致凝血功能增強,可能使心血管副作用風險增大。——參見 11.1.1 節 - 子宮肌瘤:
本品可能導致子宮肌瘤發展。 - 子宮內膜症:
本品可能導致症狀惡化。 - 心臟病,或有既往史:
本品可能導致鈉瀦留或體液瀦留。 - 癲癇:
本品可能導致症狀惡化。 - 糖尿病:
用藥時需密切監視。 - 全身性紅斑狼瘡:
本品可能導致症狀惡化。 - 骨骼發育可能未完成,或處於青春期前:
本品可能導致骨骺提前閉合和性早熟。——參見 9.7 節
9.2 腎功能不全患者用藥
- 腎病,或有既往史:
本品可能導致鈉瀦留或體液瀦留。
9.3 肝功能不全患者用藥
- 重度肝臟疾病:
不得使用本品。代謝功能不全時,本品可增加肝臟負擔,使相關症狀加重。——參見 2.6 節 - 肝臟疾病(非重度):
本品可能導致症狀惡化。
9.4 可生育婦女用藥
停經或子宮發育不全患者
使用本品時禁止妊娠;應注意採取適當的非激素性避孕手段(除安全期避孕法和體温測定法外)。另外,治療週期(約 28 日)內如未發生撤退性出血,應考慮妊娠可能;在鑑別診斷中排除妊娠可能之前,須中止本品的使用。
9.5 妊娠婦女用藥
- 現有或疑似妊娠的婦女禁用本品。尚未對本品用於妊娠婦女的有效性和安全性指標進行臨牀試驗。——參見 2.8 節
- 已有報告表明雌激素製劑用於妊娠動物(小鼠)之後,後代成長後的陰道上皮及子宮內膜發生癌性病變1), 2)。另外,已有報告證實雌激素製劑用於新生兒(小鼠)後,其成長後的陰道上皮有癌性病變3)。
9.6 哺乳期婦女用藥
應兼顧本品治療的效果和母乳餵養的益處,決定是否繼續或中止哺乳。本品已知可分泌到健康婦女的乳汁中。
9.7 兒童用藥
詳見 9.1.9 節。
十、藥物相互作用
10.2 與其它藥物並用的注意事項
與以下藥物並用時應注意:
| 藥品名 | 臨牀症狀·處置方法 | 作用機理·風險因素 |
|---|---|---|
| 降血糖藥物,包括 - 胰島素製劑 - 磺脲類藥物(如甲苯磺丁脲) - 雙胍類藥物(如鹽酸丁雙胍) | 本品會減弱此類藥物降低血糖的作用。 應注意密切觀察血糖異常患者的狀況, 調整降血糖藥劑量等。 | 已知雌激素會影響糖 耐量,使血糖上升。 |
十一、不良反應
以下不良反應可能會在本品使用期間發生;使用時應密切觀察,發現異常時應停用本品,並對症治療。
11.1 嚴重不良反應
- 血栓(頻率不詳):
已有長期使用雌激素製劑引起血栓栓塞的報告。——參見 2.4 節、2.5 節、9.1.2 節
11.2 其它不良反應
| 分類 | 頻率不詳 |
|---|---|
| 過敏 | 過敏反應 |
| 精神和神經系統類 | 精神疾病復發 |
| 代謝和營養類 | 高鈣血癥、鈉瀦留、體液瀦留 |
| 子宮類 | 撤退性出血、經間期出血、經血量改變 |
| 乳房類 | 乳房疼痛、乳房緊張感 |
| 其它 | 頭痛 |
十四、通用注意事項
14.1 使用藥劑的注意事項
- 本品僅用於肌肉注射。
- 避免在可能干擾生理月經時用藥。
- 為避免影響組織、神經等,肌注時應注意以下幾點:
- 僅在必要時肌注本品,且以最小必要劑量使用。特別地,不得在同一部位重複注射。另外,對早產兒、新生兒、嬰兒、幼兒、小兒時要尤其注意。
- 注意避開神經。
- 如注射針頭刺入時感到劇痛或發現血液迴流,請立即拔出針頭,更換注射部位。
十五、其它注意事項
15.1 臨牀應用資料
15.1.1 激素替代療法(HRT)與子宮內膜癌風險
流行病學調查報告顯示,絕經後婦女長期使用雌激素製劑(約一年以上),發生子宮內膜癌的風險較對照組婦女偏高,且該風險隨使用時長增大(1~5 年風險率 2.8 倍,10 年以上風險率 9.5 倍);與孕激素製劑並用時,可抑制子宮內膜癌風險(0.8 倍於對照組婦女)4)。
15.2 HRT 與乳腺癌風險
- 在美國進行、針對絕經後婦女的隨機對照試驗(“女性健康倡議”,WHI 試驗)的結果顯示,結合雌激素—孕激素聯合治療組的乳腺癌風險,相較安慰劑組有統計意義的增長(風險比率:1.24)5)。
同時進行的、針對已摘除子宮的婦女的試驗結果顯示,結合雌激素單藥治療組的乳腺癌風險,相較安慰劑組無統計意義的差異(風險比率:0.80)6), 7)。 ——參見 8.1 節 - 在英國進行的流行病學調查(“百萬女性研究”,MWS)的結果顯示,雌激素—孕激素聯合治療的婦女的乳腺癌風險,較對照組有統計意義的增長(2.00 倍)。該風險隨治療時長增大(一年以下 1.45 倍;一至四年 1.74 倍;五至九年 2.17 倍;十年以上 2.31 倍)8)。——參見 8.1 節
15.1.3 HRT 與冠心病風險
美國 WHI 試驗結果顯示,結合雌激素—孕激素聯合治療組的冠心病風險,較安慰劑組有偏高趨勢,尤其在治療一年後有統計意義的增長(風險比率:1.81)。9)
同時進行的、針對已摘除子宮的婦女的試驗結果顯示,結合雌激素單藥治療組的乳腺癌風險,相較安慰劑組無統計意義的差異(風險比率:0.91)6)。
——參見 2.5 節
15.1.4 HRT 與腦卒中風險
美國 WHI 試驗結果顯示,結合雌激素—孕激素聯合治療組的腦卒中(主要為腦梗塞)之風險,相較安慰劑組有統計意義的增長(風險比率:1.31)10)。
同時進行的、針對已摘除子宮的婦女的試驗結果顯示,結合雌激素單藥治療組的腦卒中(主要為腦梗塞)風險,相較安慰劑組有統計意義的增長(風險比率:1.37)6), 11)。
——參見 2.5 節
15.1.5 HRT 與認知障礙風險
在美國進行、針對 65 歲以上絕經後婦女的隨機對照試驗(WHI 認知研究,WHIMS)的結果顯示,結合雌激素—孕激素聯合治療組的認知障礙(含阿爾茨海默症)發生風險,較安慰劑組有統計意義的增長(風險比率:2.05)12)。
同時進行的、針對已摘除子宮的婦女的試驗結果顯示,結合雌激素單藥治療組的認知障礙(含阿爾茨海默症)風險,相較安慰劑組雖無統計意義的差異,但有增長趨勢(風險比率:1.49)13)。
15.1.6 HRT 與卵巢癌風險
- 流行病學調查結果顯示,絕經後婦女長期使用雌激素製劑後,卵巢癌風險較對照組偏高14) -16)。
- 美國 WHI 試驗顯示,結合雌激素—孕激素聯合治療組的卵巢癌風險,相較安慰劑組雖無統計意義的差異,但有增長趨勢(風險比率:1.58)17)。
15.1.7 HRT 與膽囊疾病風險
美國 WHI 試驗顯示,結合雌激素—孕激素聯合治療組的膽囊疾病風險,相較安慰劑組有統計意義的增長(風險比率:1.59)。
同時進行的、針對已摘除子宮的婦女的試驗結果顯示,結合雌激素單藥治療組的膽囊疾病風險,相較安慰劑組有統計意義的增長(風險比率:1.67)18)。
十六、藥代動力學特性
16.2 吸收
戊酸雌二醇經肌肉注射後,自注射點位被緩慢釋放,並被分解為雌二醇與戊酸。血清雌二醇濃度在注射後 3~5 日達到最高,半衰期約 4~5 日(外國資料)19) ,20)。
16.5 排泄
尿液、糞便排出比例約為 9:1(外國資料)19)。
十八、藥理毒理
18.1 作用機理
- 戊酸雌二醇在體內被代謝成為雌二醇,從而發揮作用。多項動物實驗顯示,戊酸雌二醇使用後的雌激素效力與雌二醇幾乎一致19)。
- 在摘除卵巢的小鼠中,戊酸雌二醇對陰道、子宮重量有增長作用,且隨劑量增長。另外,還可見其對促性腺激素及排卵有抑制作用19)。
十九、本品有效成分的物化特性
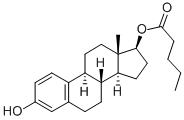
- 化學結構式:見上
- 通用名稱:戊酸雌二醇(Estradiol Valerate)
- 化學名稱:雌甾-1,3,5(10)-三烯-3,17β-二醇 17-戊酸酯
- 分子式:C23H32O3
- 分子量:356.50
- 熔點:143~150℃
- 性狀:白色結晶或微晶粉末,無味。
本品易溶於乙醇(95%)、1,4-二氧六環或乙醚,微溶於甲醇,略溶於芝麻油,幾乎不溶於水。 - CAS 代碼:979-32-8
二十二、包裝規格
每盒 10 支安瓿瓶,每支 10 mg/1 mL。
二十三、參考文獻
- 安田佳子他:醫學のあゆみ. 1976;98(8):537-538
- 安田佳子他:醫學のあゆみ. 1976;99(8):611-612
- 守隆夫:醫學のあゆみ. 1975;95(11):599-602
- Grady D, et al.:Obstet Gynecol. 1995;85(2):304-313
- Chlebowski RT, et al.:JAMA. 2003;289(24):3243-3253
- Anderson GL, et al.:JAMA. 2004;291(14):1701-1712
- Stefanick ML, et al.:JAMA. 2006;295(14):1647-1657
- Beral V, et al.:Lancet. 2003;362(9382):419-427
- Manson JE, et al.:N Engl J Med. 2003;349(6):523-534
- Wassertheil-Smoller S, et al.:JAMA. 2003;289(20):2673-2684
- Hendrix SL, et al.:Circulation. 2006;113(20):2425-2434
- Shumaker SA, et al.:JAMA. 2003;289(20):2651-2662
- Shumaker SA, et al.:JAMA. 2004;291(24):2947-2958
- Rodriguez C, et al.:JAMA. 2001;285(11):1460-1465
- Lacey JV Jr, et al.:JAMA. 2002;288(3):334-341
- Beral V, et al.:Lancet. 2007;369(9574):1703-1710
- Anderson GL, et al.:JAMA. 2003;290(13):1739-1748
- Cirillo DJ, et al.:JAMA. 2005;293(3):330-339
- Düsterberg B, et al.:Maturitas. 1982;4(4):315-324
- Düsterberg B, et al.:Hormone Res. 1985;21(3):145-154
二十四、文獻請求和問詢聯繫方式
富士製薬工業株式會社 富山工場 學術情報課
〒939-3515 富山県富山市水橋辻ヶ堂1515番地
(TEL)076-478-0032
(FAX)076-478-0336
二十六、生產和銷售等企業信息
26.1 生產、銷售企業
富士製薬工業株式會社
富山県富山市水橋辻ヶ堂1515番地
説明書原文和譯文修訂記錄
| 原文修訂日期 | 翻譯日期 |
|---|---|
| 2010 年 6 月 | – |
| 2013 年 2 月(第八版) | 2023 年 4 月 26 日 |
| 2023 年 7 月(重編第一版) | 2023 年 8 月 16 日 |