譯者按: 本文為美國諾華製藥公司的雌二醇外用貼片(Estraderm)說明書的中文翻譯,略有改動。譯文篇幅很長,其中專家用說明書約 1.2 萬字,患者用說明書約 2700 字,可跳轉閱讀後者。說明書原文:accessdata.fda.gov/drugsatfda_docs/label/2012/019081s042lbl.pdf
修改日期:2012 年 7 月
請仔細閱讀說明書並在醫師指導下使用
Estraderm®
(雌二醇透皮製劑)
僅限處方使用
警告:本品有子宮內膜癌、心血管疾病、乳癌風險和疑似痴呆風險
雌激素單藥治療
子宮內膜癌風險
高劑量雌激素用於子宮完整的婦女,可提高其子宮內膜癌風險。已知在雌激素治療中加用一種孕激素製劑,可降低子宮內膜增生(可能是子宮內膜癌之前兆)的風險。
如絕經後婦女出現未確診的持續或反覆性異常陰道出血,應採取適當的診斷手段以排除惡性腫瘤(包括酌情進行定向或隨機子宮內膜取樣)。
——參見“警告事項 - 惡性腫瘤 - 子宮內膜癌”
心血管疾病風險和疑似痴呆風險
雌激素單藥治療不得用於預防心血管疾病或痴呆。——參見“臨床研究結果”“警告事項 - 心血管疾病”和“疑似痴呆風險”
美國“婦女健康倡議”(WHI)雌激素單藥研究報告,絕經後婦女(50~79 歲)每日以口服結合雌激素(CE,0.625 mg/天)單藥治療,持續 7.1 年,其患卒中與深靜脈血栓(DVT)的風險增加。——參見“臨床研究結果”和“警告事項 - 心血管疾病”
WHI 附屬的認知研究(WHIMS)中的雌激素單藥研究報告,絕經後婦女(65 歲或以上)以 CE(0.625 mg/天)單藥治療 5.2 年後,其發生疑似痴呆的風險較安慰劑組有所增長。尚不清楚該結果是否對較年輕的絕經後婦女適用。——參見“臨床研究結果”“警告事項 - 疑似痴呆風險”和“注意事項 - 老年用藥”
對於其他劑量下的 CE 和其它給藥形式的雌激素,儘管缺乏可比資料支援,但應視為同樣具有上述風險。
雌激素—孕激素聯合治療
心血管疾病風險和疑似痴呆風險
雌激素—孕激素聯合治療不得用於預防心血管疾病或痴呆。——參見“臨床研究結果”和“警告事項 - 心血管疾病”和“疑似痴呆風險”
WHI 雌激素、孕激素複方研究報告,絕經後婦女(50~79 歲)接受口服 CE(0.625 mg/天)、醋酸甲羥孕酮(MPA,2.5 mg/天)聯合治療 5.6 年後,其 DVT、肺栓塞(PE)、卒中與心肌梗塞(MI)患病風險較安慰劑組有所提高。——參見“臨床研究結果”和“警告事項 - 心血管疾病”
WHI 附屬的 WHIMS 雌激素、孕激素複方研究報告,絕經後婦女(65 歲或以上)接受 CE(0.625 mg/天)、MPA(2.5 mg)聯合治療 4 年後,其出現疑似痴呆的風險較安慰劑組有所增長。尚不清楚該結果是否對較年輕的絕經後婦女適用。——參見“臨床研究結果”“警告事項 - 疑似痴呆風險”和“注意事項 - 老年用藥”
乳癌風險
WHI 雌激素合併孕激素研究表明,浸潤性乳癌的患病風險也有所增長。——參見“臨床研究結果”和“警告事項 - 惡性腫瘤 - 乳癌”。
對於其他劑量下的 CE、MPA 和其它給藥形式的雌激素與孕激素製劑,儘管缺乏可比資料支援,但應視為同樣具有上述風險。
雌激素以及加用的孕激素均應按每名患者的情況,在確保療效、控制風險的前提下,以最小有效劑量、最短使用時長開出。
簡介
Estraderm(雌二醇透皮製劑)(以下簡稱“本品”)設計用於貼合皮膚,透過薄膜以有限速率釋放雌二醇。
本品分為 0.05 mg 或 0.1 mg 劑型,貼合滲透性處於平均水平的皮膚時,每日可向體內給予 0.05 或 0.1 mg 雌二醇(皮膚滲透性的個體間差異約達 20%)。兩種劑型的接觸面積分別為 10、20 cm2,雌二醇(標準品)含量分別為 4、8 mg,乙醇(標準品)含量分別為 0.3、0.6 mL。兩種劑型單位面積內的成分含量相等。
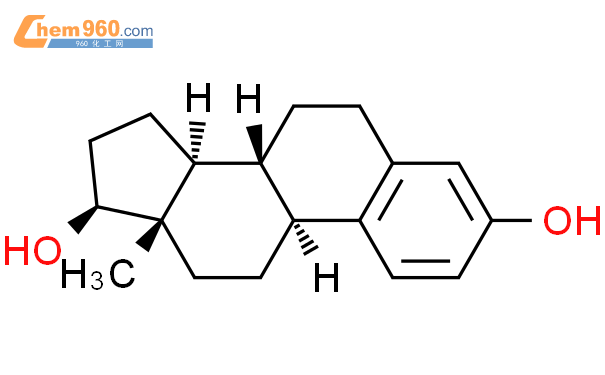
雌二醇(標準品)為白色結晶粉末,化學名稱為雌甾-1,3,5(10)-三烯-3,17β-二醇。化學結構式如下。
本品由四層材料構成,自外表面至皮膚接觸面分別是:
- 最外層,為透明聚醋酸乙烯酯薄膜
- 藥品貯存層,含有雌二醇(標準品)與乙醇(標準品),以羥丙基纖維素(NF)製成膠狀物;
- 析出層,為聚醋酸乙烯酯薄膜
- 貼上層,以輕質礦物油(NF)與聚異丁烯製成
另貼上面外貼有矽化聚酯薄膜作為保護膜,使用前須撕下。
本品的有效成分為雌二醇;其餘成分均無藥理活性。本品使用時,雌二醇會隨乙醇蒸發而釋放。
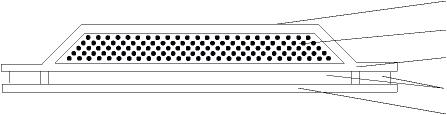
由上而下分別為:最外層、藥品貯存層、析出層、貼上層和保護膜。
藥效學特性
內源性雌激素在促進女性生殖系統和第二性徵的發育和維持方面,起到很大作用。人體內諸迴圈雌激素在代謝相互轉化作用下處於動態準平衡,但其中雌二醇是最主要的胞內雌激素,對胞內受體的效力也遠高於雌酮、雌三醇等代謝物。在月經週期正常的成年女性中,雌激素主要來自卵巢卵泡;其每日可分泌 70~500 μg 雌二醇,分泌量依月經週期階段而異。絕經後,內源性雌激素大多系由腎上腺皮質分泌的雄烯二酮經外周組織轉化而來的雌酮;因此,雌酮及其硫酸結合物:硫酸雌酮,構成了絕經後婦女體內迴圈雌激素的絕大部分。
雌激素透過與靶組織的細胞受體結合而發揮作用。迄今已發現兩種雌激素受體;二者在不同組織中的分佈比例各異。
迴圈雌激素可透過一種負反饋機制,調節腦性腺激素釋放素(促黃體激素,即 LH,和促卵泡激素,即 FSH)的分泌。在絕經後婦女中,可見雌激素對這兩種激素的水平有降低作用。
一項採用透皮雌二醇的研究中,0.1 mg 劑量使雌二醇血藥水平升高 66 pg/mL,平均達 73 pg/mL。研究中未發現腎素或其它肝蛋白濃度有明顯升高(肝蛋白包括性激素結合球蛋白、甲狀腺素結合球蛋白和皮質類固醇結合球蛋白)。
藥代動力學特性
雌二醇(經皮吸收後)僅有一小部分被皮膚代謝。相反的是,口服雌二醇會被肝臟迅速代謝成雌酮及其結合物,導致雌酮的迴圈水平高於雌二醇。因此,透皮給藥不僅可形成治療所需的雌二醇血藥水平,且產生的雌酮及其結合物水平更低,所需總劑量也低於口服。
A. 吸收
使用本品所產生的雌二醇血藥濃度,與約 20 倍於本品劑量下的口服雌二醇所產生的濃度相當。一項單次用藥研究中,14 名絕經後婦女單次使用本品,每日攝入外源性 0.05、0.1 mg 雌二醇;使用後,4 小時內雌二醇血藥濃度升高,此後兩種劑型分別維持血藥濃度高於基線 32、67 pg/mL。同時,血清雌酮濃度分別僅升高 9、27 pg/mL。移除本品後 24 小時內,血清雌二醇、雌酮濃度恢復至用藥前的基線。
使用期間,尿中雌二醇結合物的大致排出量高於基線 5~10 倍,而在移除本品後 2 日內恢復至基線附近。
相比之下,口服雌二醇(2 mg/天)用於絕經後婦女時,連續服用 3 日後,雌二醇的血藥平均水平較基線升高 59 pg/mL,而雌酮較基線升高 302 pg/mL。尿中雌二醇結合物排出量較基線增長約 100 倍,且停藥 7~8 日後仍未回落至基線。
在一項為期三週的多次用藥研究中,14 名絕經後婦女每週兩次使用本品 0.05 mg 裝,其穩態血清雌二醇、雌酮濃度分別增長 30 pg/mL 和 12 pg/mL。移除最後一個(第六個)貼片後,尿中雌二醇結合物排出量於 3 日內回落至基線,提示體內雌激素蓄積極少或不存在。
B. 分佈
外源性雌激素的分佈特性與內源性雌激素相似。雌激素廣泛分佈於全身,在性激素靶器官內的分佈濃度普遍更高。體內迴圈的雌激素大多與性激素結合球蛋白(SHBG)和白蛋白結合。
C. 代謝
外源性雌激素遵循內源性雌激素的代謝途徑。諸迴圈雌激素在代謝相互轉化作用下處於動態準平衡。雌激素的轉化主要經肝臟內的細胞色素 P450(CYP)亞型:CYPIA2 和 CYP3A4 進行。雌二醇可進一步代謝成硫酸、葡萄糖醛酸結合物;雌二醇及其代謝物的葡萄糖醛酸化透過尿苷二磷酸葡萄糖醛酸轉移酵素(UGT)的亞型:UGT1A1、UGT2B7 進行。
雌二醇可與雌酮相互轉化;二者可轉化為雌三醇,後者是經尿液排洩的主要代謝物。
雌激素在肝臟經硫酸、葡萄糖醛酸化之後,結合物進入肝腸迴圈,隨膽汁排出進入腸道,後經水解被腸道再吸收。在絕經後婦女中,迴圈雌激素相當一部分由硫酸結合物構成,尤其是硫酸雌酮;其可作為其它更高效力的雌激素的來源。
D. 排洩
雌二醇、雌酮和雌三醇以葡萄糖醛酸和硫酸結合物的形式,從尿液排出。
透皮給藥可形成治療所需的雌二醇血藥水平,同時使雌酮及其代謝物的迴圈水平低於口服給藥,所需劑量也低於口服。由於雌二醇半衰期很短(約 1 小時),透皮給藥時的雌二醇水平在本品移除後會迅速下降(例如在序貫療程中)。
E. 特殊人群用藥
尚未對腎功能不全、肝功能不全患者等特殊人群進行藥代動力學研究。
F. 藥品相互作用
體內及體外研究表明,雌激素部分經 CYP3A4 代謝。故 CYP3A4 誘導劑或抑制劑可能影響雌激素的代謝。
CYP3A4 誘導劑:聖約翰草(貫葉連翹)製品、苯巴比妥、卡馬西平與利福平等可降低雌激素血藥濃度,從而可能減弱其療效、改變子宮出血譜;
CYP3A4 抑制劑:紅黴素、克拉黴素、酮康唑、伊曲康唑、利托那韋與葡萄柚汁等均可增加雌激素的血藥濃度,並可能產生副作用。
臨床研究結果
本品對血管舒縮症狀的影響
有兩項研究設計用於評定(本品)對絕經後婦女的中重度血管舒縮症狀的緩解作用。
其中一項試驗評估了本品用於控制絕經後潮熱發生率的有效性。該試驗包含兩個階段,每階段患者均治療 21 天:
- 一期:針對兩組患者(共 30 人)的雙盲隨機平行試驗。其中,第一組給予透皮安慰劑貼片,另一組以本品給予雌二醇(0.10 mg/天)。
- 二期:單盲試驗,加入第三組患者,以本品給予雌二醇(0.05 mg/天)。本階段未引入安慰劑對照組。
研究收集並分析了內源性生殖激素(含雌二醇、雌酮、促卵泡激素和促黃體激素)的基線水平及治療 21 天后水平的實驗室測定值。結果如下(平均 ± 標準差):
| 組別 | 潮熱發生率基線 (次/小時) | 治療 21 天后潮熱發生率 (次/小時) |
|---|---|---|
| Estraderm 0.05 mg/天 | 0.79±0.08 | 0.35±0.10 |
| Estraderm 0.10 mg/天 | 0.65±0.06 | 0.21±0.09 |
| 安慰劑 | 0.87±0.10 | 0.88±0.10 |
其中,兩個治療組的潮熱平均發生率均有統計意義的減少;安慰劑組的平均發生率無明顯變化。
兩個 Estraderm 治療組中可見雌二醇(E2)、雌酮(E1)的迴圈水平以及二者比例較基線有所提高,恢復至絕經前的早、中卵泡期水平。
FSH、LH 水平皆較基線有所下降,也降至絕經前的水平。
另一項為雙盲隨機對照研究,設計用於評估本品對圍絕經期症狀的有效性,並與某種口服活性藥品進行比較——該藥在 0.625 mg 或 1.25 mg 劑量下,有效控制了患者(共 124 人)的圍絕經期症狀。研究中一部分患者已於參試前 3 個月切除卵巢,另一部分於參試前 6 個月經歷最後一次月經。受試者有 75% 已切除卵巢。
研究透過患者每日自行記錄的潮熱發生史和嚴重程度,以及其它五種圍絕經期症狀(盜汗、頭痛、失眠、陰道不適和尿急)的發生史,來評價治療的有效性。
研究將第 1~3 周的潮熱平均發生率和第 5~7 周的潮熱平均發生率進行對比。受試者換用本品後,無論是已切除卵巢者還是整個實驗組,無一出現相較口服藥物有統計意義的差異。
本品對絕經後骨質疏鬆症的影響
有兩項研究分別設計用於評定本品對絕經後婦女的骨質疏鬆症的預防、和治療功效。
其中一項係為期兩年的前瞻性雙盲隨機平行分層研究,計劃評定本品對骨質疏鬆病變的預防效果。其中,受試婦女(共 95 人)已於參試前 2 年內切除卵巢或子宮,術後六個月以上未出現雌激素缺乏;受試者分為兩個年齡層(40~49 歲,50 歲以上)參試,再分為三個治療組(本品 0.025、0.05、0.10 mg/天)和一個安慰劑組。研究隨後進行彙總分析,與安慰劑組做對比。研究透過雙光子吸收法(DPA)對腰 2~4 椎骨密度(BMD)的百分比變幅(原文如此——譯者注)進行測定,作為衡量治療有效性的主要指標。
結果如下:
| 組別 | 骨密度平均變幅 (g/cm2) |
|---|---|
| Estraderm 0.10 mg/天 | +3.66 |
| Estraderm 0.05 mg/天 | +0.82 |
| Estraderm 0.025 mg/天 | -2.95 |
| 安慰劑 | -6.42 |
相比於安慰劑組,諸治療組的骨密度變幅均有統計意義的差異。
另一項係為期 12 個月的雙盲平行安慰劑對照試驗,旨在評定本品與口服醋酸甲羥孕酮(MPA)合併用於患骨質疏鬆症、已證實有既往脊柱骨折的絕經後婦女時,對預防骨密度進一步流失和新發/惡化的脊柱骨折的臨床有效性。其中,治療組接受以下序貫療程:
- 每 28 日為一週期,週期第 1~22 日內每隔 3.5 日使用本品一片(共 6 片),劑量 0.1 mg/天;
- 在第 13~22 日加用 MPA 口服片(10 mg/次,一次/天);
- 第 23~28 日停藥。
對照組則相應地給予等量安慰劑。
治療一年後,研究透過雙光子吸收法(DPA)對腰 2~4 椎骨密度(BMD)的百分比變幅進行測定,作為衡量治療有效性的主要指標。結果顯示,聯合治療組的骨密度在治療六個月後、一年後有統計意義的增加,分別為 +4.0% 和 +7.5%。安慰劑組僅觀察到微小變幅(不足 1%)。
美國“婦女健康倡議”研究結果
美國“婦女健康倡議”(WHI)研究招募約 27000 名絕經後婦女(大多健康)參與兩項子研究,以評定口服 CE(0.625 mg/天)單藥治療或與 MPA(2.5 mg/天)聯合治療在對某些慢性疾病的作用上,相較安慰劑有何風險及收益。
治療中的主要終點為冠心病(CHD,分為非致命性心肌梗塞、靜息性心梗和心梗猝死)發生;治療中的主要不良結局為浸潤性乳癌。研究還記錄初次發生 CHD、浸潤性乳癌、卒中、PE、子宮內膜癌(僅限 CE 合併 MPA 的子研究)、結直腸癌、髖骨骨折或非上述原因導致的死亡的人數,作為“總髮病率”(global index)。兩項子研究均未評定 CE 單藥或 CE、MPA 複方對圍絕經期症狀的作用。
WHI 雌激素單藥研究
WHI 雌激素單藥研究在早期觀察到卒中風險升高,隨即被中止;研究認為,無法按預先設定的主要終點收集更多有關雌激素單藥的風險及收益的資料。
該研究納入 10739 名婦女(平均年齡 63 歲,範圍 50~79 歲;白人佔 75.3%,黑人佔 15.1%,西班牙裔佔 6.1%,其餘人種佔 3.6%),平均跟蹤 7.1 年後所得結果如下。
「表一」WHI 雌激素單藥研究中的相對和絕對風險觀測結果(1)
| 不良反應事件 | CE 相對安慰劑的風險比率 (95% 粗置信區間(2)) | CE 治療組(5310 人) 每萬人·年絕對風險率 | 安慰劑組(5429 人) 每萬人·年絕對風險率 |
|---|---|---|---|
| CHD 事件(3) | 0.95 (0.78-1.16) | 54 | 57 |
| - 非致命性心梗 (3) | 0.91 (0.73-1.14) | 40 | 43 |
| - CHD 猝死 (3) | 1.01 (0.71-1.43) | 16 | 16 |
| 卒中(3) | 1.33 (1.05-1.68) | 45 | 33 |
| - 缺血性卒中 (3) | 1.55 (1.19-2.01) | 38 | 25 |
| 深靜脈血栓(3)(4) | 1.47 (1.06-2.06) | 23 | 15 |
| 肺栓塞(3) | 1.37 (0.90-2.07) | 14 | 10 |
| 浸潤性乳癌(3) | 0.80 (0.62-1.04) | 28 | 34 |
| 結直腸癌(5) | 1.08 (0.75-1.55) | 17 | 16 |
| 髖骨骨折(3) | 0.65 (0.45-0.94) | 12 | 19 |
| 腰椎骨折(3)(4) | 0.64 (0.44-0.93) | 11 | 18 |
| 下臂/腕骨折(3)(4) | 0.58 (0.47-0.72) | 35 | 59 |
| 所有骨折(3)(4) | 0.71 (0.64-0.80) | 144 | 197 |
| 非以上原因導致的死亡(5)(6) | 1.08 (0.88-1.32) | 53 | 50 |
| 總死亡率(3)(4) | 1.04 (0.88-1.22) | 79 | 75 |
| “總髮病率”(7) | 1.02 (0.92-1.13) | 206 | 201 |
(1) 彙總自 WHI 的多篇公開發表文章。文章可於此查閱:nhlbi.nih.gov/whi
(2) “粗置信區間”即未按多重檢視和多重比較進行修正的置信區間。
(3) 結果基於平均跟蹤 7.1 年後集中評審的資料。
(4) 未納入“總髮病率”統計。
(5) 結果為平均跟蹤 6.8 年後所得。
(6) 除乳癌、結直腸癌、確診或疑似 CHD、PE、腦血管疾病以外的任何原因導致的死亡。
(7) “總髮病率”包括初次發生 CHD 事件、浸潤性乳癌、卒中、肺栓塞、結直腸癌、髖骨骨折或非以上原因導致的死亡的人數。
在被 WHI“總髮病率”所納入的不良反應中,以下不良反應有統計意義的明顯變化:
- 卒中:每萬人·年增加 12 例
- 髖骨骨折:每萬人·年減少 7 例
治療組的“總髮病率”所列不良反應的絕對風險率每萬人·年增加 5 例,無統計意義。兩組的總死亡率無差異。
研究結果顯示,平均跟蹤 7.1 年後,CE 單藥治療組和安慰劑組婦女之間的主要 CHD 事件(非致命性心梗、靜息性心梗和 CHD 猝死)以及浸潤性乳癌發生率總和無差異。
研究結果顯示,平均跟蹤 7.1 年後,CE 單藥治療組和安慰劑組婦女之間發生卒中的型別分佈和嚴重性(含致命性卒中)無統計意義的差異。雌激素單藥可增加缺血性卒中的風險,且各組別婦女均發現此現象。
激素治療開始相對於圍絕經期開始的時間差,可能會影響總和風險—收益。WHI 雌激素單藥研究顯示,在處於 50~59 歲年齡層的婦女中,CHD 和總死亡率風險有下降趨勢,但無統計意義(其中 CHD 危險比率 0.63,95% 置信區間 0.36~1.09;總死亡率危險比率 0.71,95% 置信區間 0.46~1.11)。
WHI 雌激素—孕激素複方研究
WHI 雌激素—孕激素複方研究在早期觸發預設的中止條件,隨即被中止。平均治療並跟蹤 5.6 年後,觀察到“總髮病率”所列事件中的浸潤性乳癌及心血管事件風險增加,以至大於預期收益。治療組“總髮病率”所列事件的絕對風險率每萬人·年增加 19 例。
對 CE、MPA 聯合治療組婦女平均跟蹤 5.6 年後,在 WHI“總髮病率”所列事件中,以下事件的絕對風險率有統計意義的明顯變化:
- CHD 事件:每萬人·年增加 7 例
- 卒中:每萬人·年增加 8 例
- PE:每萬人·年增加 10 例
- 浸潤性乳癌:每萬人·年增加 8 例
- 結直腸癌:每萬人·年減少 6 例
- 髖骨骨折:每萬人·年減少 5 例
研究納入 16608 名婦女(平均年齡 63 歲,範圍 50~79 歲;白人佔 83.9%,黑人佔 6.8%,西班牙裔佔 5.4%,其他人種佔 3.9%),平均跟蹤 5.6 年後集中評審所得結果如下。
「表二」平均跟蹤 5.6 年後,WHI 雌激素—孕激素複方研究的相對和絕對風險率觀測結果(1)(2)
| 不良反應事件 | CE/MPA 相較安慰劑的風險比率 (95% 粗置信區間(3)) | CE/MPA 治療組(8506 人) 每萬人·年絕對風險率 | 安慰劑組(8102 人) 每萬人·年絕對風險率 |
|---|---|---|---|
| CHD 事件 | 1.23 (0.99-1.53) | 41 | 34 |
| - 非致命性心梗 | 1.28 (1.00-1.63) | 31 | 25 |
| - CHD 猝死 | 1.10 (0.70-1.75) | 8 | 8 |
| 卒中 | 1.31 (1.03-1.68) | 33 | 25 |
| - 缺血性卒中 | 1.44 (1.09-1.90) | 26 | 18 |
| 深靜脈血栓(4) | 1.95 (1.43-2.67) | 26 | 13 |
| 肺栓塞 | 2.13 (1.45-3.11) | 18 | 8 |
| 浸潤性乳癌(5) | 1.24 (1.01-1.54) | 41 | 33 |
| 結直腸癌 | 0.61 (0.42-0.87) | 10 | 16 |
| 子宮內膜癌(4) | 0.81 (0.48-1.36) | 6 | 7 |
| 宮頸癌(4) | 1.44 (0.47-4.42) | 2 | 1 |
| 髖骨骨折 | 0.67 (0.47-0.96) | 11 | 16 |
| 腰椎骨折(4) | 0.65 (0.46-0.92) | 11 | 17 |
| 下臂/腕骨折(4) | 0.71 (0.59-0.85) | 44 | 62 |
| 所有骨折 | 0.76 (0.69-0.83) | 152 | 199 |
| 總死亡率(6) | 1.00 (0.83-1.19) | 52 | 52 |
| “總髮病率”(7) | 1.13 (1.02-1.25) | 184 | 165 |
(1) 彙總自 WHI 的多篇公開發表文章。文章可於此查閱:nhlbi.nih.gov/whi
(2) 結果基於集中評審的資料。
(3) “粗置信區間”即未按多重檢視和多重比較進行修正的置信區間。
(4) 未納入“總髮病率”統計。
(5) 含轉移性和非轉移性乳癌,但乳腺原位癌除外。
(6) 除乳癌、結直腸癌、確診或疑似 CHD、PE、腦血管疾病以外的任何原因導致的死亡。
(7) “總髮病率”包括初次發生 CHD 事件、浸潤性乳癌、卒中、肺栓塞、結直腸癌、髖骨骨折或非以上原因導致的死亡的人數。
激素治療開始相對於圍絕經期開始的時間差,可能會影響總和風險—收益。WHI 雌激素—孕激素複方研究顯示,在處於 50~59 歲年齡層的婦女中,總死亡率風險有下降趨勢,但無統計意義(危險比率 0.69,95% 置信區間 0.44~1.07)。
美國“婦女健康倡議”認知研究結果
“婦女健康倡議”附屬認知研究(WHIMS)的雌激素單藥研究,旨在對比 CE 單藥(0.625 mg/天)和安慰劑對疑似痴呆(主要治療結局)的影響,其中招募了 2947 名已切除子宮的絕經後婦女(大多健康;65~69 歲佔比 45%,70~74 歲佔比 36%,75 歲以上佔 19%)。
平均跟蹤 5.2 年後,CE 單藥治療組相對安慰劑組的疑似痴呆風險比率為 1.49(95% 置信區間 0.83~2.66);絕對風險率則分別為每萬人·年 37 例和 25 例。研究中將阿爾茲海默症(AD)、血管性痴呆(VaD)和混合症狀(同時具備 AD 和 VaD 特徵)均視作疑似痴呆。治療組和安慰劑組最常見的疑似痴呆歸類為 AD。該研究僅對 65~79 歲婦女進行,其結論是否適用於較年輕的絕經後婦女尚不清楚。——參見“警告事項 - 疑似痴呆”和“注意事項 - 老年用藥”
WHIMS 的雌激素—孕激素複方研究,旨在對比 CE(0.625 mg/天)、MPA(2.5 mg/天)複方和安慰劑對疑似痴呆(主要治療結局)的影響,其中招募了 4532 名絕經後婦女(大多健康;65~69 歲佔比 47%,70~74 歲佔比 35%,75 歲以上佔 18%)。
平均跟蹤 4 年後,CE、MPA 複方治療組的疑似痴呆相對風險率為 2.05(95% 置信區間 1.21~3.48);絕對風險率則為每萬人·年 45 例(安慰劑組:22 例)。研究中將 AD、VaD 和混合症狀(同時具備 AD 和 VaD 特徵)均視作疑似痴呆。治療組和安慰劑組最常見的疑似痴呆歸類為 AD。該研究僅對 65~79 歲婦女進行,其結論是否適用於較年輕的絕經後婦女尚不清楚。——參見“警告事項 - 疑似痴呆”和“注意事項 - 老年用藥”
綜合兩組 WHIMS 研究群體的資料之後,報告的疑似痴呆總相對風險率為 1.76(95% 置信區間 1.19~2.60)。組別之間的差異自治療第一年起顯現。尚不清楚以上結論是否適用於較年輕的絕經後婦女。——參見“警告事項 - 疑似痴呆”和“注意事項 - 老年用藥”
適應症
本品適應症有:
- 圍絕經期引起的中重度血管舒縮症狀。
- 圍絕經期引起的中重度會陰、陰道萎縮。如僅需治療會陰、陰道萎縮,宜考慮外用陰道製劑。
- 由性腺發育不全、去勢或原發性卵巢衰退引起的雌激素缺乏。
- 絕經後骨質疏鬆的預防。如僅需預防絕經後骨質疏鬆,僅當患者處於骨質疏鬆症高發風險時考慮治療,且應謹慎考慮非雌激素藥品。
預防絕經後骨質疏鬆,主要依靠負重運動、適當補鈣和補充維生素 D,以及必要時進行藥物治療。絕經後婦女每日需攝入平均 1500 mg 的鈣。因此,如婦女在日常飲食中攝入的鈣不足,可考慮服用鈣補劑(前提是無禁忌症)。此外,絕經後婦女每日宜攝入 400~800 IU 的維生素 D,以確保鈣吸收充分。
禁忌症
有以下任意情況的婦女停用本品:
- 未確診的陰道異常出血
- 現有、疑似乳癌,或有既往史
- 現有或疑似雌激素依賴性腫瘤
- 現有 DVT、PE,或有既往史
- 現有動脈血栓性疾病(如卒中、心肌梗塞),或有既往史
- 本品引起的超敏反應或血管性水腫
- 現有 C 蛋白、S 蛋白或抗凝血酵素不足,或有其它血栓形成性疾病
- 現有或疑似妊娠
警告事項
請先參見“文首的警告說明”。
1. 心血管疾病
已有雌激素單藥治療引起卒中和 DVT 風險增加的報告。
已有雌激素—孕激素聯合治療引起 PE、DVT、卒中和心梗風險增加的報告。
如出現以上事件或有疑似徵兆,應立即停止雌激素或雌、孕激素治療。
有以下情況的患者應謹慎:
- 動脈疾病風險因素,如高血壓、糖尿病、吸菸、高膽固醇水平和肥胖等
- 深靜脈血栓(VTE)風險因素,如有既往史或家族史、肥胖、系統性紅斑狼瘡等
1a. 卒中風險
據 WHI 雌激素單藥研究報告,50~79 歲婦女給予 CE(0.625 mg/天)單藥治療,其卒中風險相較同年齡安慰劑組有統計意義的增長:治療組每萬人·年 45 例,安慰劑組 33 例。——參見“臨床研究結果”
風險增長在治療第一年顯現,此後增長持續。如出現卒中或有疑似徵兆,應立即停止雌激素單藥治療。
分組分析表明,50~59 歲婦女給予 CE(0.625 mg/天)單藥治療,其卒中風險相較安慰劑組未見增長:治療組每萬人·年 18 例,安慰劑組 21 例。
據 WHI 雌激素—孕激素複方研究報告,50~79 歲婦女給予 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療,其卒中風險相較同年齡安慰劑組有統計意義的增長:治療組每萬人·年 33 例,安慰劑組 25 例。——參見“臨床研究結果”
風險增長在治療第一年顯現,此後增長持續。如出現卒中或有疑似徵兆,應立即停止雌激素—孕激素聯合治療。
1b. 冠心病風險
據 WHI 雌激素單藥研究報告,婦女給予雌激素單藥治療後,CHD 事件風險率相較安慰劑組總和未受影響。——參見“臨床研究結果”
分組分析表明,50~59 歲婦女(圍絕經期開始不足 10 年)給予 CE(0.625 mg/天)單藥治療,其卒中風險相較安慰劑組有所降低,但無統計意義:治療組每萬人·年 8 例,安慰劑組 16 例。
據 WHI 雌激素—孕激素複方研究報告,婦女給予 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療後,CHD 事件風險率相較安慰劑組有所增加,但無統計意義:治療組每萬人·年 41 例,安慰劑組 34 例。
相對風險率在治療第一年可見增長,此後第 2~5 年有下降趨勢。
一項有關心血管疾病二線預防的臨床對照試驗中(“心臟與雌激素/孕激素替代治療研究”;HERS),有心臟病史的絕經後婦女(2763 人,平均年齡 66.7 歲)給予 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療,該療法對心血管未見任何收益。平均跟蹤 4.1 年後,曾確診冠心病的絕經後婦女使用該療法,未降低 CHD 事件的總和發生率。治療第一年,治療組的 CHD 事件發生率高於安慰劑組;但此後發生率一致。
參與 HERS 的受試者中,有 2321 人同意參與另一項非盲延伸試驗,即 HERS II。該試驗的平均跟蹤期為 2.7 年,與 HERS 相加即為 6.8 年。治療組和安慰劑組的 CHD 事件發生率,在 HERS、HERS II 以及綜合二者來看均相當。
1c. 靜脈血栓栓塞風險
據 WHI 雌激素單藥研究報告,婦女給予 CE(0.625 mg/天)單藥治療後,其 VTE(含 DVT 及 PE)風險率相較同年齡安慰劑組有所增長:治療組每萬人·年 30 例,安慰劑組 22 例。但是,僅 DVT 風險的增長具備統計意義:治療組每萬人·年 23 例,安慰劑組 15 例。VTE 風險的增長在治療第一、二年顯現。——參見“臨床研究結果”
如出現 VTE 或有疑似徵兆,應立即停止雌激素單藥治療。
據 WHI 雌激素—孕激素複方研究報告,婦女給予 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療後,VTE 風險率相較安慰劑組增長一倍,且有統計意義;而 DVT、PE 風險同樣有統計意義的增長:
- VTE:治療組每萬人·年 35 例,安慰劑組 17 例
- DVT:治療組每萬人·年 26 例,安慰劑組 13 例
- PE:治療組每萬人·年 18 例,安慰劑組 8 例
VTE 風險的增長在治療第一年顯現,此後增長持續。——參見“臨床研究結果”
如出現 VTE 或有疑似徵兆,應立即停止雌激素—孕激素聯合治療。
如果可能,在接受可能引起血栓栓塞風險增加的手術之前,應提前 4~6 周以上停用雌激素;需長期臥床不動時,也應停用雌激素。
2. 惡性腫瘤
2a. 子宮內膜癌風險
已有子宮完整的婦女使用高劑量雌激素治療導致子宮內膜癌風險增加的報告。報告中,使用高劑量雌激素後,患者的子宮內膜癌風險增至未使用者的 2~12 倍;風險與治療時長和雌激素劑量有關。
多數研究表明,雌激素使用不足一年時,不會使該風險明顯增加。長期使用雌激素(5~10 年或以上)與更高的風險有關,且停藥後至少 8~15 年內,風險仍會維持。
有必要對所有服用雌激素單藥或雌、孕激素複方的婦女進行臨床監測。如絕經後婦女有未確診的持續、或反覆的陰道異常出血,應採取適當的診療手段(如酌情進行定向或隨機子宮內膜取樣),以排除惡性腫瘤。
無證據表明天然雌激素在與人工雌激素等效的劑量下,導致的子宮內膜癌風險與人工雌激素不同。已證實在雌激素治療中加用一種孕激素,可降低子宮內膜增生(可能是子宮內膜癌之前兆)的風險。
2b. 乳癌風險
WHI 雌激素單藥研究(CE 0.625 mg)是有關雌激素單藥與乳癌之關係的方面迄今最重要的一項臨床隨機試驗。據研究報告,平均跟蹤 7.1 年後,CE 單藥治療組的浸潤性乳癌風險未見增長(相對風險率:0.80)。——參見“臨床研究結果”
WHI 雌激素—孕激素複方研究(CE 0.625 mg/天 + MPA 2.5 mg/天)是有關雌、孕激素複方與乳癌之關係的方面迄今最重要的一項臨床隨機試驗。研究中有 26% 的婦女報告早前曾使用雌激素單藥或雌、孕激素複方治療。平均跟蹤 5.6 年後,CE、MPA 治療組相對安慰劑組的浸潤性乳癌風險比率為 1.24,絕對風險率為每萬人·年 41 例(安慰劑組:33 例)。
在有激素治療經歷的婦女中,治療組的浸潤性乳癌相對風險率為 1.86,絕對風險率為每萬人·年 46 例(安慰劑組:25 例)。
在從未接受激素治療的婦女中,治療組的浸潤性乳癌相對風險率為 1.09,絕對風險率為每萬人·年 40 例(安慰劑組:36 例)。
該研究中,相較安慰劑組,CE、MPA 治療組的浸潤性乳癌病灶更大,檢出淋巴結陽性的比例更高,癌症確診時的階段也更晚。罕有轉移性癌症的報告;兩組之間的報告率無明顯差異。其它預後因素(如組織學亞型、分級和激素受體狀態等)在兩組之間未見有差異。——參見“臨床研究結果”
與此類似,已有觀察性研究報告連續多年使用雌激素單藥或雌、孕激素複方治療之後,乳癌風險增加(雌激素單藥增幅較小)。風險隨用藥時長增加,停藥後約 5 年逐漸回落至基線(僅觀察性研究有較多資料可佐證停藥後的風險)。
觀察性研究表明,相比於雌激素單藥治療,雌、孕激素複方治療引起乳癌的風險更高,顯性化更早。但是,這類研究未發現不同配方、劑量或給藥途徑的雌、孕激素複方對乳癌風險有任何明顯差異。
已有使用雌激素單藥和雌、孕激素複方治療導致乳腺 X 光異常結果(需進一步排查)增加的報告。
婦女應每月進行一次乳房自查,每年由醫師進行一次乳房檢查。此外,依患者年齡、風險因素和早前乳腺 X 光結果,應安排進行乳腺 X 光掃描。
2c. 卵巢癌風險
WHI 雌激素—孕激素複方研究中,卵巢癌風險有些微增加,但無統計意義。平均跟蹤 5.6 年後,CE、MPA 治療組相對安慰劑組的卵巢癌風險比率為 1.58(95% 置信區間 0.77~3.24),絕對風險率為每萬人·年 4 例(安慰劑組:3 例)。
多項流行病學研究中,雌激素單藥或雌、孕激素複方製劑的使用與卵巢癌風險增加有關——尤其是當使用時長達 5 年以上時。然而,並非所有流行病學研究均認為(激素)暴露的時長與風險增加有關,其中有的認為不存在聯絡。
3. 疑似痴呆
WHIMS 雌激素單藥研究中,有 2947 名已切除子宮的 65~79 歲婦女被隨機分配到 CE(0.625 mg/天)單藥治療組或安慰劑組。
平均跟蹤 5.2 年後,治療組和安慰劑組分別有 28 名和 19 名婦女被確診疑似痴呆。CE 單藥治療組的疑似痴呆相對風險率為 1.49(95% 置信區間 0.83~2.66),絕對風險率為每萬人·年 37 例(安慰劑組:25 例)。——參見“臨床研究結果”與“注意事項 - 老年用藥”
WHIMS 雌激素—孕激素複方研究中,有 4532 名已絕經的 65~79 歲婦女被隨機分配到 CE(0.625 mg/天)、MPA(2.5 mg/天)聯合治療組或安慰劑組。
平均跟蹤 4 年後,治療組和安慰劑組分別有 40 名和 21 名婦女被確診疑似痴呆。CE—MPA 聯合治療組的疑似痴呆相對風險率為 2.05(95% 置信區間 1.21~3.48),絕對風險率為每萬人·年 45 例(安慰劑組:22 例)。——參見“臨床研究結果”與“注意事項 - 老年用藥”
綜合以上兩批受試者的結果,可知疑似痴呆的相對風險率為 1.76(95% 置信區間 1.19~2.60)。以上研究僅對 65~79 歲婦女進行,其結論是否適用於較年輕的絕經後婦女尚不清楚。——參見“注意事項 - 老年用藥”
4. 膽囊疾病風險
已有絕經後婦女服用雌激素出現膽囊疾病(需手術)的風險增至 2~4 倍的報告。
5. 高鈣血癥風險
患有乳癌、且骨骼有轉移灶的患者,攝入雌激素可能導致重度高鈣血癥。如發生高鈣血癥,應停用雌激素,並對症治療,使血鈣水平降低。
6. 視力異常風險
已有服用雌激素的患者出現視網膜血管栓塞的報告。如出現急性部分或完全失明,或有急性眼前垂、複視或偏頭痛發作,應停藥並等待檢查。如眼科檢查提示視神經盤水腫或視網膜血管病變,應終身停用雌激素。
7. 過敏性反應與血管性水腫
本品上市以來,已有使用本品時發生過敏性反應、需緊急處理的報告。具體的不良反應如下:
- 皮膚疾病(皮疹、皮膚瘙癢、面部/嘴唇/舌腫脹)
- 以下二者之一:
- 呼吸道疾病(呼吸功能損傷)
- 胃腸道疾病(腹痛、嘔吐)
本品上市以來,已有使用本品的患者出現血管性水腫、需醫療干預的報告。水腫部位包括舌、喉、面部、手、頭部和足。如舌、聲門、喉部出現水腫,可能導致氣道不暢。
如患者使用本品出現任何過敏性反應、血管性水腫等,不應再行使用。
8. 遺傳性血管性水腫
對於患有遺傳性血管性水腫的婦女,外源性雌激素可能會使其血管性水腫的症狀加重。
注意事項
A. 一般注意事項
A1. 關於未切除子宮的婦女需加用一種孕激素的事項
已有研究報告,在雌激素序貫療程中連續 10 日或以上加用一種孕激素,或者在雌激素不間斷療程中每日加用孕激素,可使子宮內膜增生的發生率低於雌激素單藥治療。子宮內膜增生可能是子宮內膜癌之前兆。
但是,相較雌激素單藥,加用孕激素可能會帶來額外的風險;其中包括乳癌風險增加。
A2. 關於血壓升高的事項
少量病例報告指出,(人體)對雌激素的某些特異性反應可導致血壓的大幅升高。在一項大型隨機安慰劑對照試驗中,未發現雌激素對血壓有任何普遍性作用。
A3. 關於高甘油三酯血癥的事項
對於有高甘油三酯血癥既往史的婦女,雌激素治療可能與血清甘油三酯(可誘發胰腺炎)的升高有關。如出現胰腺炎,考慮停止雌激素治療。
A4. 關於肝功能不全和/或有膽汁鬱積性黃疸既往史的患者的事項
儘管透皮給予的雌激素可繞過肝臟代謝的首渡效應,但如患者的肝功能不全,雌激素代謝可能較慢。如婦女有因雌激素使用或妊娠引起的膽汁鬱積性黃疸既往史,應謹慎治療,一旦症狀復發則應停藥。
A5. 關於甲狀腺功能減退的事項
使用雌激素可引起甲狀腺素結合球蛋白(TBG)水平的升高。甲狀腺功能正常的情況下,作為補償,TBG 升高可引起甲狀腺素分泌增加,維持血清遊離 T4、T3 濃度在正常範圍。如婦女同時接受甲狀腺素替代治療和雌激素治療,則可能需提高甲狀腺素的劑量,且應監測其甲狀腺功能,以確保遊離甲狀腺素水平維持於合理範圍內。
A6. 關於體液瀦留的事項
雌激素可導致一定程度的體液瀦留。如婦女存在可能影響體液瀦留的狀況(如心功能或腎功能不全),開具雌激素時應密切觀察。
A7. 關於低鈣血癥的事項
對於患有甲狀旁腺功能減退的婦女,雌激素可能會誘導低鈣血癥,故應慎用雌激素治療。
A8. 關於子宮內膜異位症狀加重的事項
已有數個病例報告已切除子宮的婦女給予雌激素單藥治療後出現體內殘餘子宮內膜嵌入體的惡性病變。如婦女切除子宮後仍有殘餘的子宮內膜異位,應考慮加用孕激素。
A9. 關於其它症狀加重的事項
雌激素治療可能導致以下症狀加重:哮喘、糖尿病、癲癇、偏頭痛、卟啉病、系統性紅斑狼瘡和肝臟血管瘤。如婦女有以上症狀,應慎用雌激素。
B. 供患者使用的說明書
建議醫師開具本品處方時,與患者洽談《供患者使用的說明書》內容。
C. 實驗室檢測指標
已知血清 FSH 與雌二醇水平對中重度血管舒縮症狀、中重度會陰及陰道萎縮的管理無參考意義。
如需治療由性腺功能減退、去勢、原發性卵巢衰退引起的雌激素缺乏,則實驗室檢測結果有助於指導用藥劑量。
D. 藥品與實驗室檢測指標的相互作用
雌激素可導致:
- 凝血酵素原時間、凝血活酵素時間、血小板凝聚時間加快;
血小板計數增加;
凝血因子 II、VII 抗原、VIII 抗原、VIII 促凝活性、IX、X、XII、VII-X 複合物和 II-VII-X 複合物增加;
β-血小板球蛋白增加;
凝血因子 Xa 抗體、抗凝血酵素 III 水平下降;
抗凝血酵素 III 活性降低;
纖維蛋白原水平及活性升高;
纖溶酵素原抗原及活性升高。 - TBG 升高,從而總迴圈甲狀腺素升高——透過對蛋白結合碘(PBI)、T4(色譜柱法或放射免疫法)、T3(放射免疫法)水平的測定而得;
T3 再攝取減少,反映出 TBG 水平的升高;
遊離 T4、遊離 T3 水平不變;
如婦女正接受甲狀腺素替代治療,可能需增加甲狀腺素劑量。 - 其它血清結合蛋白的增加,包括皮質類固醇結合球蛋白(CBG)和 SHBG 等,從而導致迴圈皮質類固醇和性激素等增加;
遊離睪酮、雌二醇等激素濃度可能下降;
其它血漿蛋白可能增加(例如血管緊張素原/腎素底物,α-1-抗胰蛋白酵素,血漿銅藍蛋白等)。 - 血清高密度脂蛋白(HDL)和 HDL-2 膽固醇亞組分濃度均升高;
低密度脂蛋白(LDL)膽固醇濃度降低;
甘油三酯水平升高。 - 糖耐量降低。
E. 致癌性、致突變性與對生育力的影響
對某些動物物種長期連續給予天然和人工雌激素,可導致乳腺、子宮、子宮頸、陰道、睪丸和肝臟致癌率升高。
F. 妊娠婦女用藥
妊娠期間停用本品。——參見“禁忌症”
妊娠早期的婦女不慎服用口服避孕藥(含雌激素與孕激素)之後,對其後代畸形的風險僅有微弱、以至無影響。
G. 哺乳婦女用藥
哺乳期間停用本品。已知哺乳婦女使用雌激素可導致母乳分泌減少、質量降低。婦女給予雌激素後,在其乳汁中檢測到雌激素。哺乳婦女應慎用本品。
H. 兒童用藥
已有雌激素用於有青春期延遲的青年人以誘導青春期的實踐。除此以外,雌激素對兒童患者的安全性及有效性尚未確立。
已知在兒童生理青春期尚未結束、發育正常時,超期多次使用大劑量雌激素,可加快骨骺閉合,導致成年身高較小。如需對骨骼生長尚未完成的患者給予雌激素,建議在用藥期間定期監測骨齡和對骺骨化中心的影響。
此外,對未開始青春期的女孩給予雌激素治療,會誘發乳房發育和陰道角質化,並可能誘發陰道出血。
I. 老年用藥
現有研究中,對於 65 歲以上老年婦女使用本品的反饋是否與較年輕受試者不同,尚缺乏足夠樣本來判斷。
“婦女健康倡議”研究結果
WHI 雌激素單藥研究顯示,65 歲以上婦女以 CE(0.625 mg/天)治療後,發生卒中的相對風險更高。
WHI 雌激素—孕激素複方研究顯示,65 歲以上婦女以 CE(0.625 mg/天)、MPA(2.5 mg/天)治療後,發生非致命性卒中和浸潤性乳癌的相對風險更高。——參見“臨床研究結果”
“婦女健康倡議”認知研究結果
WHIMS 研究顯示,65~79 歲絕經後婦女以雌激素單藥或雌、孕激素複方治療後,發生疑似痴呆的風險較安慰劑組更高。該研究僅對 65~79 歲婦女進行,其結論是否適用於較年輕的絕經後婦女尚不清楚。——參見“臨床研究結果”和“警告事項 - 疑似痴呆風險”
不良反應
因各臨床試驗的條件不同,無法將一種藥品在臨床試驗中的不良反應發生率,與另一種藥品的不良反應發生率進行直接比較;其也並非反映實際發生率。
臨床試驗中,本品最常見的不良反應為用藥部位紅腫、刺激感。有 17% 的婦女患者報告該不良反應,並有 2% 因此停止治療。罕見皮疹的報告。另有罕見的系統性過敏反應報告。
上市後的不良反應報告
本品獲准上市以來,發現的不良反應如下。這些不良反應來自使用者自發報告,規模不明,故無法準確估計其發生率、或建立與本品成分暴露的病理關係。
- 泌尿與生殖系統疾病:突破性出血、點狀出血、子宮內膜增生、子宮平滑肌瘤
- 乳房疾病:乳癌、乳房不適、乳房疼痛和緊張感
- 心血管疾病:高血壓、靜脈曲張、肺栓塞
- 胃腸道疾病:腹痛、腹脹、肝功能指標異常、膽汁鬱積性黃疸、噁心、嘔吐、腹瀉、膽結石、膽囊異常
- 皮膚疾病:脫髮、接觸性皮炎、色素沉著異常、黃褐斑、皮膚瘙癢
- 中樞神經系統疾病:情緒不穩、眩暈、抑鬱、焦躁、性慾異常、頭痛、偏頭痛
- 其它疾病:背痛、四肢痛、水腫、超敏反應、性慾異常、體重增加或體重減少
此外,已有其它形式的雌激素治療引起的其它不良反應報告。
藥品過量
雌激素攝入過量可能會引起噁心、嘔吐、乳房緊張感、腹痛、睏倦和疲乏;婦女可能出現撤退性出血。過量管理措施有停止本品治療、對症治療等。
用法用量
使用本品時,應將貼上面置於清潔、乾燥的軀幹皮膚(如臀部、腹部等)。應選擇不受陽光直射的部位貼上。不得將本品置於乳房。
本品應每週更換兩次。貼上部位應輪換,同一部位用藥後應輪空至少一週。有油脂、破損或炎症的部位不宜貼上。一旦本品啟封、保護膜被揭開,則應立即使用。本品貼上時應以手掌牢牢按壓 10 秒左右,確保貼片、尤其是邊緣接觸良好。
本品偶見脫落,此時可再次貼回;必要時可啟用新的貼片。無論何種情況,均應遵循預設的療程。
治療開始時的事項
對於子宮完整的絕經後婦女,應在其雌激素治療開始時加用一種孕激素,以降低子宮內膜癌風險。無子宮的婦女無需加用。
雌激素以及加用的孕激素應以最低有效劑量使用,在滿足治療目標和風險所需的情況下,用藥時長應儘量短。應視臨床情況定期(如每 3~6 個月)對患者進行重新評估,以確定是否仍有必要進行治療。
如子宮完整的絕經後婦女出現未確診的持續、或反覆的陰道異常出血,應採取適當的診療手段(如酌情進行定向或隨機子宮內膜取樣),以排除惡性腫瘤。
本品分為 0.05 mg 和 0.1 mg 兩種劑型。患者應從最低劑量開始治療。本品的最低有效劑量尚未確立。
- 中重度血管舒縮症狀或中重度會陰、陰道萎縮的治療:開始時採用本品 0.05 mg 裝,每週兩片。
- 絕經後骨質流失的預防性治療:絕經後儘早開始以本品 0.05 mg/天治療。劑量可按需調整。停止雌激素治療可能導致骨質再次開始流失,流失速度與絕經後初期相仿。
如婦女當前未使用口服雌激素,可立即開始以本品治療。但若正使用口服雌激素,應先停用口服激素,一週後再開始以本品治療;不過如圍絕經期症狀在一週內復發,可提前使用本品。
治療排期
無子宮的患者可連續給予本品治療。子宮完整的婦女應序貫給予本品治療(如連續三週用藥,後停藥一週)。
包裝規格
Estraderm 雌二醇透皮貼片 0.05 mg/天——每片面積 10 cm2,含雌二醇(標準品)4 mg,粗給藥速率* 為 0.05 mg/天。
每盒 8 片,以日期標註。(NDC 0078-0480-42)
Estraderm 雌二醇透皮貼片 0.1 mg/天——每片面積 20 cm2,含雌二醇(標準品)8 mg,粗給藥速率* 為 0.1 mg/天。
每盒 8 片,以日期標註。(NDC 0078-0481-42)
* 參見“簡介”。
30°C (86°F) 以下儲存。
啟封后請勿儲存。一旦從封袋取出,需立即使用。
供患者使用的說明書
Estraderm®
(雌二醇透皮貼片)
在您開始使用 Estraderm 貼片之前,請先閱讀本患者用說明書,並在每次複診開藥時再次閱讀所有內容。可能會有新增的內容。本說明書不能取代您的醫師——您仍需向醫師洽談您的治療狀況或過程。
有哪些有關 Estraderm(雌激素)的重要資訊是需要我瞭解的?
- 雌激素單藥治療可增加您罹患子宮癌症的機率。
如您在使用本品期間出現任何陰道異常出血,請立即向醫師報告。絕經後出現陰道出血可能是子宮癌症的前兆。應由醫師檢查陰道異常出血的起因。 - 請勿將雌激素單藥用於預防心臟病、卒中或痴呆(大腦功能減退)。
- 雌激素單藥治療可增加您罹患卒中或血栓的機率。
- 據一項針對 65 歲以上婦女的研究結果,雌激素單藥治療可增加您罹患痴呆的機率。
- 請勿將雌激素、孕激素複方用於預防心臟病、卒中或痴呆。
- 雌激素、孕激素聯合治療可增加您罹患心臟病、卒中、乳癌或血栓的風險。
- 據一項針對 65 歲以上婦女的研究結果,雌激素、孕激素聯合治療可增加您罹患痴呆的機率。
- 您應定期與醫師洽談是否仍有必要使用本品治療。
什麼是 Estraderm?
本品是一種外用貼片,內含雌二醇(一種雌激素)。按以下指示貼上於皮膚後,本品可透過皮膚將雌激素釋放到體內。
Estraderm 的用途有哪些?
本品用於:
絕經後中重度潮熱的緩解。
雌激素是由婦女體內卵巢分泌的一種激素。一般當婦女處於 45~55 歲時,卵巢將停止分泌雌激素。體內雌激素水平的下滑會帶來“更年期”或者是絕經期——此時每月固定的月經週期將停止。有人在正常絕經期前便已切除兩側卵巢;這會導致雌激素水平急劇下滑,即“手術性絕經”。
當雌激素水平開始下滑,有的婦女會感到異常不適;例如,她們會感到面部、頸部和胸部在發熱,或者突然有灼熱感並伴有出汗(即“潮熱”)。一些婦女症狀較輕,無需補充雌激素;其他婦女症狀可能會更嚴重。
絕經後陰道內壁和外圍變化的緩解。
對於此用途,您應定期與醫師洽談是否仍有必要以本品治療。如您的訴求僅限於絕經後陰道內壁和外圍變化的緩解,請與醫師洽談是否值得換以外用陰道製劑治療。
治療未絕經、但卵巢分泌雌激素不足的婦女的某些狀況。
幫助降低您罹患骨質疏鬆症的機率。
絕經後,骨密度會變小,從而導致骨骼更脆弱、更易發生骨折,即骨質疏鬆症。如您的訴求僅限於絕經後骨質疏鬆症的預防,請與醫師洽談是否值得換以不含雌激素的其它療法或藥品治療。
還有其它方式可幫助您降低絕經後患骨質疏鬆症的機率,例如:負重運動(行走或跑步)、補鈣(鈣含量需達 1500 mg/天)、補充維生素 D(每日 400~800 個單位),等等。在採取以上措施之前,有必要與醫師洽談相關事項。
您應定期與醫師洽談是否仍有必要繼續以本品治療。
哪些人不能使用 Estraderm?
如您有以下情況,請勿開始使用本品:
- 異常的陰道出血
- 現有特定的腫瘤,或有既往史
雌激素可增加乳房、子宮等發生癌症的機率。如您現有癌症或有既往史,請與醫師洽談是否應以本品治療。 - 卒中或心臟病既往史
- 血栓,或有既往史
- 肝臟疾病,或有既往史
- 曾確診有出血性疾病
- 對本品及任一成分過敏
本品成分詳見文末。 - 有懷孕可能
請將以下情形告知醫師:
- 有任何異常的陰道出血: 絕經後陰道出血可能是子宮癌症的前兆。應由醫師檢查陰道異常出血的起因。
- 您的一切身體不適: 如您患有哮喘、癲癇、糖尿病、偏頭痛、子宮內膜異位、狼瘡,或者心臟、肝臟、甲狀腺、腎臟疾病,或血鈣水平高,應由醫師進行細緻檢查。
- 您正服用的一切藥品: 要告知的包括處方藥和非處方藥、維生素和草本營養品等。有的藥品可能會影響本品的作用;本品也可能會影響其它藥品的作用。
- 即將接受手術或長期臥床: 這種情況下,您可能需停用本品。
- 正在哺乳: 本品所含激素可分泌到母乳中。
我該如何使用 Estraderm?
- 從最低劑量開始使用,並與醫師洽談當前劑量對您有何作用。
- 治療期間,雌激素應儘可能以最低劑量使用,且僅在需要治療時使用。本品的最低有效劑量尚未確立。您應定期(如每 3~6 個月)與醫師洽談當前劑量,並決定是否仍有必要以本品治療。
Estraderm 的使用方式和使用部位
每份貼片有獨立包裝。沿外包裝的刻痕撕開包裝(請勿裁剪),取出貼片。貼片內有氣泡屬正常現象。
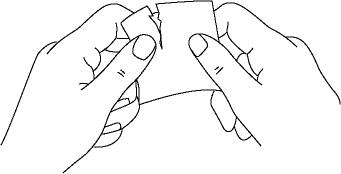
貼片表面有一層保護膜,其下就是需附著於皮膚的貼上面。貼上之前必須先撕下保護膜:首先,透過拇指和食指捏住貼片邊緣並相向揉搓,使保護膜滑動;之後抓住貼片邊沿,撕下保護膜並棄置之。儘量避免接觸到貼上面。
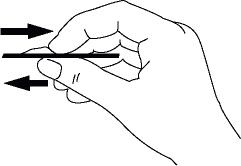
將貼片貼上面置於乾燥、清潔的軀幹皮膚表面(如臀部、腹部等)。
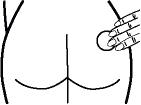
應選擇不受陽光直射的部位貼上。對部分人而言,貼上於臀部可能會更舒適。請勿將本品置於乳房。
貼上部位須輪換,同一部位用藥後應輪空至少一週。有油脂、破損或炎症的部位不宜貼上。請勿將本品置於中腰;緊身衣物可能會將其刮落。一旦本品啟封、保護膜被揭開,則應立即使用。貼上時應以手掌牢牢按壓 10 秒左右,確保貼片、尤其是邊緣接觸良好。
本品應持續附著於皮膚,直至下一個更換時機。使用新貼片時,您可嘗試換用另一個部位貼上,找到最舒適、不易被衣物刮落之處。
Estraderm 的使用時間
本品每週應更換兩次。每塊貼片的背面有一週日期的選項,方便您記住用藥規律。您可標記其中兩個日期,此後須於每週的這兩日更換貼片。
更換貼片時,將用過的貼片取下並棄置。原貼上處可能有粘合劑殘留,可輕鬆刮落。之後,將新貼片置於除原貼上處以外的部位。(同一部位用藥後應輪空至少一週。)
請注意:進行浸浴、游泳、淋浴等活動時,與水的接觸不會影響貼片工作。本品偶見脫落,此時可再次貼回;必要時可啟用新的貼片。無論何種情況,均應遵循預設的用藥規律。
Estraderm 可能的副作用有哪些?
治療期間可能會發生的不良反應如下,按嚴重程度和發生頻率進行劃分。
嚴重、但不常見的不良反應包括:
- 心臟病
- 卒中
- 血栓
- 痴呆
- 乳癌
- 子宮內膜癌
- 卵巢癌
- 高血壓
- 高血糖
- 膽囊疾病
- 肝臟疾病
- 子宮良性肌瘤的增大
- 嚴重的過敏反應
如您發現以下任何徵兆,或任何其它異常症狀,請即聯絡醫師:
- 新發的乳腺腫塊
- 異常的陰道出血
- 視力或聲音改變
- 新發的嚴重急性頭痛
- 嚴重胸痛、腿痛,可能伴有呼吸急促、虛弱和疲乏
- 嘴唇、舌頭和麵部腫脹
症狀較輕、但較常見的不良反應包括:
- 頭痛
- 乳房疼痛
- 陰道不規律出血或點狀出血
- 胃/腹絞痛,腹脹
- 噁心、嘔吐
- 脫髮
- 體液瀦留
- 陰道酵母菌感染
本品可能的不良反應不止於此。有關不良反應詳情及建議,請諮詢醫師或藥師。可向 FDA 報告不良反應事件,電話:1-800-FDA-1088。
如何降低使用 Estraderm 出現嚴重副作用的機率?
- 定期與醫師洽談,決定是否應繼續以本品治療。
- 如您有子宮,請與醫師洽談是否有必要加用一種孕激素。一般推薦有子宮的婦女加用孕激素,以降低罹患子宮癌症的機率。
- 如使用本品期間出現任何陰道出血,請即聯絡醫師處置。
- 除醫囑另有指示之外,每年接受一次骨盆檢查、乳房檢查和乳腺 X 光掃描。如家族成員有乳癌既往史,或您曾出現乳房腫塊或乳腺 X 光結果異常,可能需加大檢查頻次。
- 如您患有高血壓、高膽固醇(高血脂)、糖尿病,或肥胖,或正在吸菸,您罹患心臟病的機率可能更高。請向醫師諮詢如何降低心臟病出現的機率。
如何安全、有效使用本品的一般說明
藥品有時按說明書外用途開出。請勿將本品超處方範圍使用。請勿將本品給予他人,即使有相同的症狀;本品可能對他人有害。
請將本品置於幼兒不可觸及之處。
本說明書總結了有關本品最重要的資訊。如需更多資訊,請與醫師或藥師洽談。您可向其索要供專家使用的說明書。此外,還可撥打以下電話免費諮詢:1-888-NOW-NOVA (1-888-669-6682)。
Estraderm 的成分有哪些?
本品由四層材料構成。由外面至皮膚接觸面分別是:
- 最外層,為透明聚醋酸乙烯酯薄膜
- 藥品貯存層,含有雌二醇(標準品)與乙醇(標準品),以羥丙基纖維素(NF)製成膠狀物
- 析出層,為聚醋酸乙烯酯薄膜
- 貼上層,以輕質礦物油(NF)與聚異丁烯製成
另貼上層外貼有矽化聚酯薄膜作為保護膜,使用前須撕下。
本品的有效成分為雌二醇;其餘成分均無藥理活性。本品使用時,雌二醇會隨乙醇蒸發而釋放。
修訂日期:2012 年 7 月(T2012-07)
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936