譯者按
- ⚠ 免責聲明:本文不構成任何醫療、處方建議。如有醫療需要,應於專業醫師指導下進行。
- 因譯者能力所限,部分術語之翻譯或有紕漏,煩請指正。
摘要
醋酸環丙孕酮(CPA)是一種孕激素與抗雄製劑,廣泛用於女性化激素治療。其作為孕激素的作用,遠甚於作為雄激素受體拮抗劑的作用。一般作為孕激素用於順性別婦女時,其劑量介乎 1–2 mg/天;作為抗雄製劑時,其劑量介乎 50–300 mg/天。但對於後者,會有強烈的孕激素過量影響,以及與之關聯的副作用和風險。
CPA 因其孕激素作用可抑制睾酮水平,故也有拮抗促性腺激素之效應。單服 CPA 時,睾酮水平最大可壓制 50% 至 70%;而結合小劑量雌激素服用時,其可完全抑制來自性腺的睾酮分泌,並將睾酮水平降低約 95%——正好落入女性範圍。儘管歷史上曾有女性傾向跨性別者每日服用 50–100 mg 的 CPA,但目前已知的是,5–10 mg/天的劑量足以最大程度(或接近最大程度)抑制睾酮水平。
CPA 本身通常以 50 mg/片的形式提供。這些片劑可被切藥器切開,之後每日或隔日服用一次,這樣日均劑量可減至 6.25 至 12.5 mg。低劑量 CPA 不僅可顯著減少開銷,而且有更好的耐受性及安全性。出於其低劑量仍保持的效用、以及和劑量相關的風險之考量,針對女性傾向跨性別者的 CPA 臨牀用量正在快速減少。
前言
本文討論醋酸環丙孕酮(CPA)的劑量。CPA 是一種孕激素製劑與抗雄製劑,用於女性傾向跨性別者的激素治療。
本文探討了以更低劑量服用 CPA,並深入論證了低劑量的合理性。
如果讀者只對推薦劑量感興趣,可見推薦劑量一節。
CPA 之效力、傳統劑量與健康風險
CPA 是一種強效孕激素,當用於順性別婦女時,1 mg/天的劑量即可抑制排卵,1–3 mg/天即可使子宮內膜轉化 (維基百科; 表格; Endrikat et al., 2011)。該劑量的 CPA 之效力,相當於處在黃體期的絕經前婦女自然產生的孕酮量(25 mg/天)以及孕酮水平(15 ng/mL)之效力。與此對應,當 CPA 作為孕激素用於順性別婦女時(例如作為避孕藥,或更年期激素療法制劑),其以每片 1/2 mg 的形式提供(維基百科)。
和其孕激素效力相反,CPA 作為雄激素受體拮抗劑之效力弱得多(維基百科)。作為抗雄製劑,其劑量一般介乎 50–300 mg/天,對於順性別男女皆如此。對於女性,一般使用 50–100 mg/天以改善受雄激素影響的皮膚與毛髮之狀況(例如痤瘡與多毛症);而對於男性,則一般使用 100–300 mg/天以治療前列腺癌(若伴隨去勢手段,則使用 100–200 mg/天;單服 CPA 療法則需 200–300 mg/天)(維基百科)。為此,CPA 一般被製成 50mg 或 100mg 的片劑以供服用 (維基百科)。CPA 作為抗雄製劑有雙重機制:通過其低劑量下的孕激素作用來抑制睾酮水平,高劑量下還可直接阻止睾酮作用於雄激素受體。
在傳統臨牀劑量下,因孕激素效力遠甚於雄激素受體拮抗劑效力,CPA 會有強烈的孕激素過量影響。有三篇文獻摘錄描述了這點:
CPA 與其前身醋酸氯地孕酮相似,皆為強效孕激素,在 20–30 mg 劑量下即可使子宮內膜轉化。……
CPA 每個月為完全達到臨牀上的雄激素拮抗效果所需劑量的生理效力,應相當於一個月經週期內所產生孕酮之效力的三十倍。CPA 儘管是 (抗雄) 這方面最有用的藥物,但並非是理想的抗雄製劑,尤其是,某些副作用還與孕激素的過量攝入有關(而非其雄激素拮抗效應)。……
在需要 CPA 完全發揮雄激素拮抗效應的場合,產生的諸如疲倦、無力、體重增加等不良反應皆可能與嚴重過量攝入的孕激素之效力有關。(Hammerstein et al., 1975)
Fixson (1963) 在已摘除卵巢、且事前服用了雌激素的婦女身上試用 CPA;20–30 mg 的劑量可使子宮內膜轉化,這説明其為一種強效孕激素。對於月經推遲的試驗,其有效劑量不明,但估計應低於 1mg/天(Miller and Jacobs 1986)。
相比於孕激素效力,CPA 的雄激素拮抗效應應被認為相當羸弱;為完全發揮該效應,需要每日服用 100mg,這相當於用於月經週期轉化的劑量之三倍(Hammerstein and Cupceancu 1969)(值得一提的是,該數值相當於整個月經週期中黃體分泌的孕酮總量)。 (Hammerstein, 1990)
在內分泌學性質上,CPA 應具有較強的孕激素效力以及有限的雄激素拮抗效力。……
關於其孕激素活性,每月(每週期)需要 20-30 mg 以轉化受雌激素驅動(oestrogen-primed)的子宮內膜,該劑量和醋酸氯地孕酮以及其它強效孕激素相似。為完全發揮雄激素拮抗效力,每日須至少服用 50-100 mg 的 CPA,此劑量相當於女性在整個月經週期的孕酮暴露量的兩到三倍。必須承認,這種孕激素的攝入已嚴重過量,除非大幅減少其用量以及效力。……
已有人指出,CPA 並非一種有利於內分泌平衡的藥物成分,因為其孕激素效力顯著優於雄激素拮抗效力。有一種方法可以避免伴隨高劑量反向序貫療法而生的孕激素的嚴重過量:就是合併使用低劑量的避孕藥和一種純抗雄製劑(例如遊離的環丙孕酮)。……
必須強調的是,CPA 遠不是一種用於多毛症的抗雄療法的理想藥物,因為其孕激素效力過強,局部作用也並不佳。因此,在未來值得為此尋找平衡性更好的抗雄製劑。 (Hammerstein, 1979)
因高劑量 CPA 導致的孕激素攝入的高度過量,以及 CPA 高劑量下產生的已知不良反應與風險之間,存在一定關聯(維基百科)。這些副作用包括:疲倦、抑鬱、體重增加、高泌乳素水平(維基百科)、良性腦膜瘤(Aly, 2020; 維基百科; 表格 1; 表格 2)、血栓(維基百科)以及心血管問題(維基百科)等。這些風險和劑量相關;迄今未發現每日 1/2 mg 的 CPA 與此存在關聯(但有一項例外,即合用炔雌醇時會提高血栓風險)。CPA 的肝毒性同樣與劑量相關:一般當劑量超過 20 mg/天時,肝轉化酶水平會有升高;若超過 100 mg/天,有罕見概率出現肝衰竭(維基百科; 表格)。低劑量能夠儘量減少風險,這就是為何使用盡可能少的 CPA 的根本所在。
歷史上,曾有女性傾向跨性別者每日服用 50–100 mg 的 CPA(例如 Moore, Wisniewski, & Dobs, 2003)。但在 2017 年,美國內分泌學會發布了最新一版針對跨性別者激素治療的臨牀實踐指南,其中將 CPA 的推薦用量從 50–100 mg/天降至 25–50 mg/天(Hembree et al., 2017; Hembree et al., 2009)。此舉可能是受到了日漸明瞭的高劑量 CPA 之風險的驅動。不過,新的推薦用量似乎仍遠超實際所需。
低劑量或高劑量 CPA 對睾酮的抑制
像 CPA 一類的孕激素,可以顯著抑制出生指派性別為男、性腺完整的人羣當中的睾酮水平。從 1970 年代到 1980 年代初發表的一系列規模較小且質量較低、但值得一提的研究項目發現,健康年輕男性每日服用 5–10 mg 的 CPA,可將睾酮水平抑制 40–70%(見表 1)。其中,一些項目報告了使用 5 mg/天劑量的睾酮抑制程度,和使用 10 mg/天劑量的幾乎一致(皆抑制了約 50%)(Wang & Yeung, 1980; 圖表);而 10 mg/天劑量的效果則與 20 mg/天相近(皆為約 60–70%)(Koch et al., 1976; Koch et al., 1975; 圖表)。同一項目裏即使 CPA 劑量加倍,也未能提高睾酮抑制率,這表明實際僅需 5 或 10 mg/天的 CPA 劑量,即可最大程度抑制睾酮。
一項近年進行的、使用更現代和更可靠的血清睾酮定量方法的研究項目,發現了 10 mg/天用量的 CPA 可將睾酮水平抑制 66%(從約 600±150 ng/dL 壓減至約 185 ng/dL)(Meriggiola et al., 2002a; 圖表)。
與此類似,另一項年份更近的研究發現,10–20 mg/天的 CPA 可將睾酮水平從 431 ng/dL 左右抑制到 149 ng/dL 左右,抑制率 65%;且不同劑量間未發現(療效)差異。(Zitzmann et al., 2017; 圖表)
表 1: 低劑量 CPA(5–30 mg/天)所引起的睾酮等性激素水平的變化
| CPA 劑量 | 受試者 | 結果 | 資料來源 |
|---|---|---|---|
| 30 mg/天 | 正常男性 5 人 | 睾酮“大幅”減少。 未提供具體數值,但有個體的睾酮水平圖表。 後來對一人試驗 5 mg/天劑量,其對精子生成或睾酮的影響不及 30 mg/天。 此外還報告了促性腺激素分泌減少。 | Petry et al. (1972); Petry et al. (1970a); Petry et al. (1970b); Petry et al. (1970c) |
| 10 或 20 mg/天 | 25–35 歲健康可生育女性 15 人; 其中 7 人劑量 10 mg/天, 8 人劑量 20 mg/天 | 兩個組別的“雄激素(主要為睾酮)”均下降 60%。 LH 變化不一,FSH 略為下降。 未提供具體數值,僅有圖表。 | Koch et al. (1976); Koch et al. (1975) |
| 0、5 或 10 mg/天 | 20–40 歲健康男性 18 人 (分為 3 組,每組 6 人) | 睾酮下降,LH 與 FSH 不變。 未提供具體激素水平或其它細節。 | Roy et al. (1976) |
| 10 mg/天 | 可生育的健康年輕男性 10 人 (年齡 21–35 歲,平均 27.2 ± 3.2 歲) | 睾酮初值 495 ± 66 ng/dL,四周後降至 154 ± 23 ng/dL,降幅 70%; 十二個月後睾酮 187 ± 38 ng/dL。 此外 DHT 下降 50%,LH 下降 30%,FSH 下降 40%;而泌乳素升高 75%。 還有其它激素水平的數值及圖表。 | Moltz et al. (1980); Moltz et al. (1978a); Moltz et al. (1978b) |
| 5 或 10 mg/天 | 20–40 歲健康男性 14 人 (每組 7 人) | 兩個組別的睾酮均下降。 未提供具體激素水平或其它細節。 | Roy & Chatterjee (1979a) |
| 10 mg/天 | 32–35 歲正常可生育男性 3 人; 單用 CPA 12–18 周, 此後與 75 mg/天的美睾酮並用 | 論文未提及睾酮水平。 | Roy & Chatterjee (1979b) |
| 20 mg/天 | 26–55 歲健康男性 10 人 | 睾酮初值 482(範圍 410–560)ng/dL,降至 130(110–162)ng/dL,降幅 73%(71–75%)。 此外 DHT 下降 51%(範圍 47–55%); LH 下降 39%(範圍 34–45%); FSH 下降 66%(範圍 47–78%); 17-羥孕酮下降 59%; 雄烯二酮(A4)下降 30%; 磺酸睾酮(TS)下降 34%; 磺酸二氫睾酮(DHTS)下降 35%。 另有其它激素水平的數值及圖表。 | de la Torre (1979) |
| 5 或 10 mg/天 | 男性 7 人(每組 4 人); 有一人交替服用 5 mg/天和 10 mg/天 | 睾酮增幅為“−40%”或“–50%”。 5 mg/天組的睾酮初值 745 ng/dL,治療後 460 ng/dL(–38%),停藥後 668 ng/dL; 10 mg/天組的睾酮初值 708 ng/dL,治療後 398 ng/dL(–44%),停藥後 670 ng/dL。 另有 LH 及 FSH 水平數值。 | Føgh et al. (1979); Damgaard-Pederson et al. (1980); Føgh et al. (1980); Foegh (1983) |
| 0、5 或 10 mg/天 | 20–51 歲正常健康男性 25 人。其中: 5 mg/天組七人,平均年齡 37 ± 10 歲; 10 mg/天組八人,平均 32 ± 8 歲; 對照組十人,平均 32 ± 10 歲。 | 5 mg/天組中,睾酮初值 663 ± 120 ng/dL,降至 320 ± 160 ng/dL,降幅 52%; 10 mg/天組中,睾酮初值 692 ± 180 ng/dL,降至 340 ± 160 ng/dL,降幅 51%。 雌二醇水平隨睾酮下降。 此外,5 mg/天組中,LH 初值 2.1 ± 0.7 IU/L,降至 1.4 ± 0.5 IU/L,降幅 33%; 10 mg/天組中,LH 初值 2.3 ± 1.0 IU/L,降至 1.2 ± 0.5 IU/L,降幅 48%。 5 mg/天組中,FSH 初值 3.1 ± 1.9 IU/L,降至 1.8 ± 0.9 IU/L,降幅 42%; 10 mg/天組中,FSH 初值 2.7 ± 1.0 IU/L,降至 1.5 ± 0.7 IU/L,降幅 44%。 | Wang & Yeung (1980) |
| 10 或 25 mg/天 | 29–37 歲健康男性 4 人; 其中 10 mg 組三人,25 mg 組一人 | 睾酮“小幅下降”。 雌二醇“降幅更大”。 LH 無明顯變化。 FSH“在所有人中下降”,降幅“或多或少”。 未提供具體激素水平,但有圖表。 | Fredricsson & Carlström (1981) |
| 10 或 20 mg/天 | 21–38 歲健康男性 30 人 | 睾酮下降 70%; LH 下降 35%,而 FSH“也觀測到類似降幅”。 未提供具體數值。 | Moltz et al. (1982) |
| 10 mg/天 | 健康男性 5 人 (除 CPA 組外還有安慰劑組和 2、5、10 mg/天地諾孕素組, 每組有健康男性 5 人) | CPA 組中,睾酮初值約 600 ± 150 ng/dL,降至約 185 ng/dL,降幅 66 ± 4%。 另有 LH、FSH、SHBG 等血清水平,以及安慰劑組、地諾孕素組的激素變化。 | Meriggiola et al. (2002a) |
| 10 或 20 mg/天 | 健康年輕男性 14 人(每組 7 人) | 兩組中睾酮初值約 431 ng/dL,降至約 149 ng/dL,降幅 65%。 未提供每組單獨的數值。 LH、FSH 抑制率在兩組間無明顯差異(間接表明了睾酮抑制率無差異的原因)。 另有使用其它孕激素製劑後引起的激素水平數值。 | Zitzmann et al. (2017) |
以下圖表摘自上述部分研究,將其結果可視化:
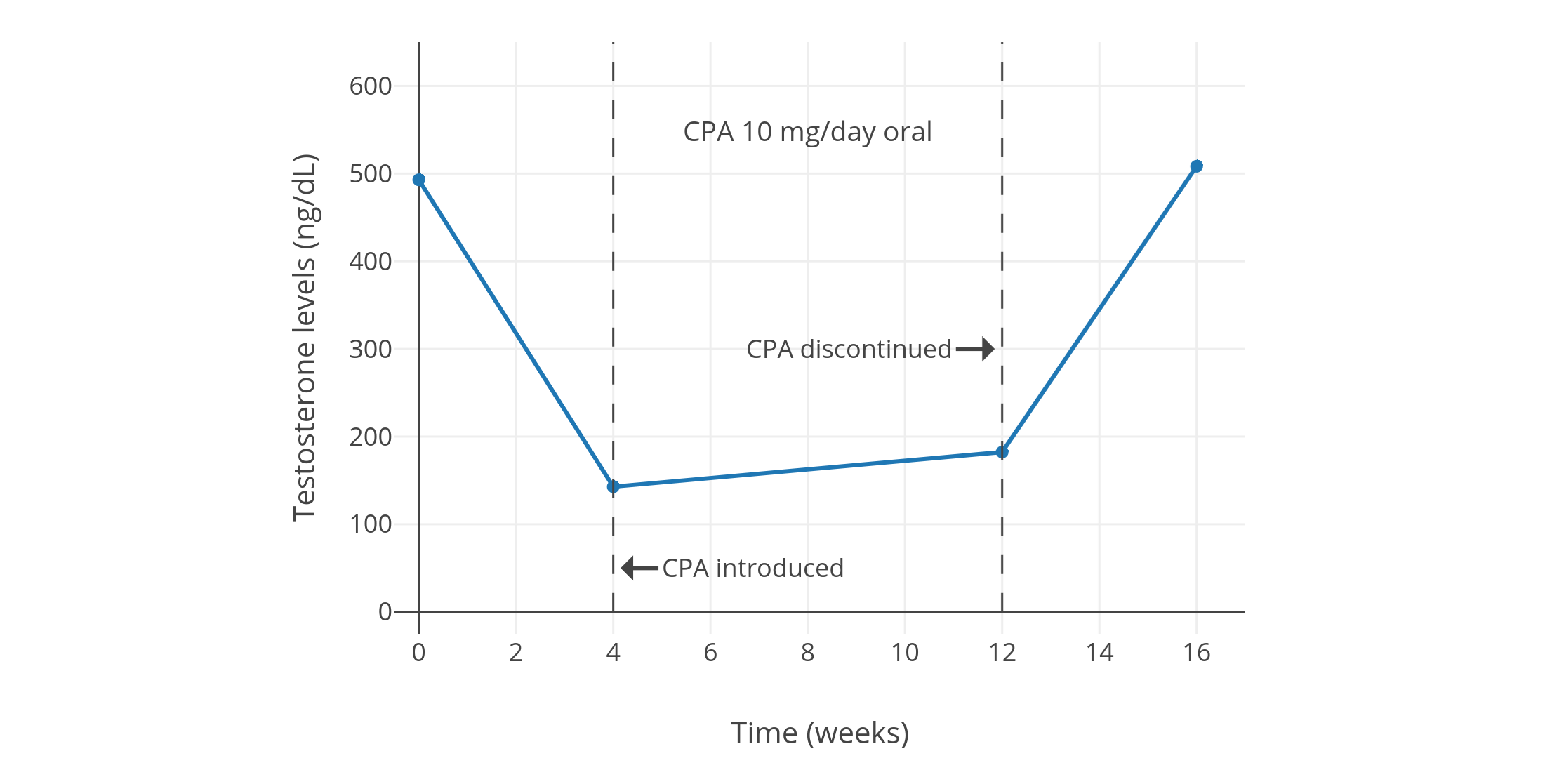
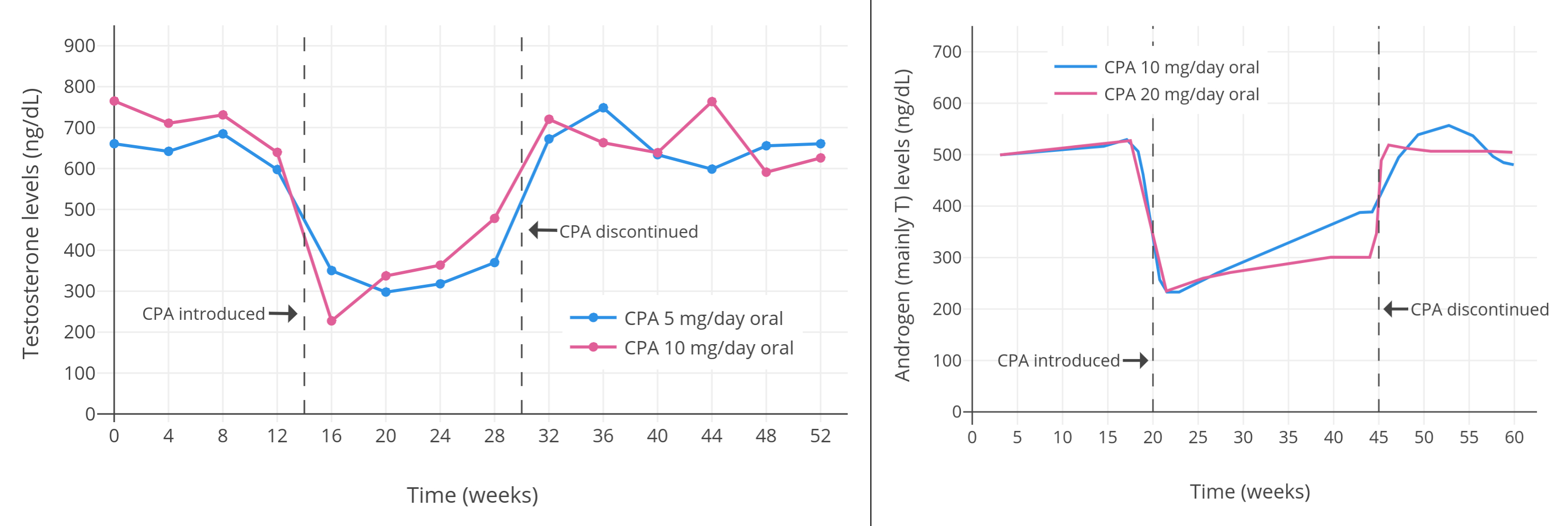
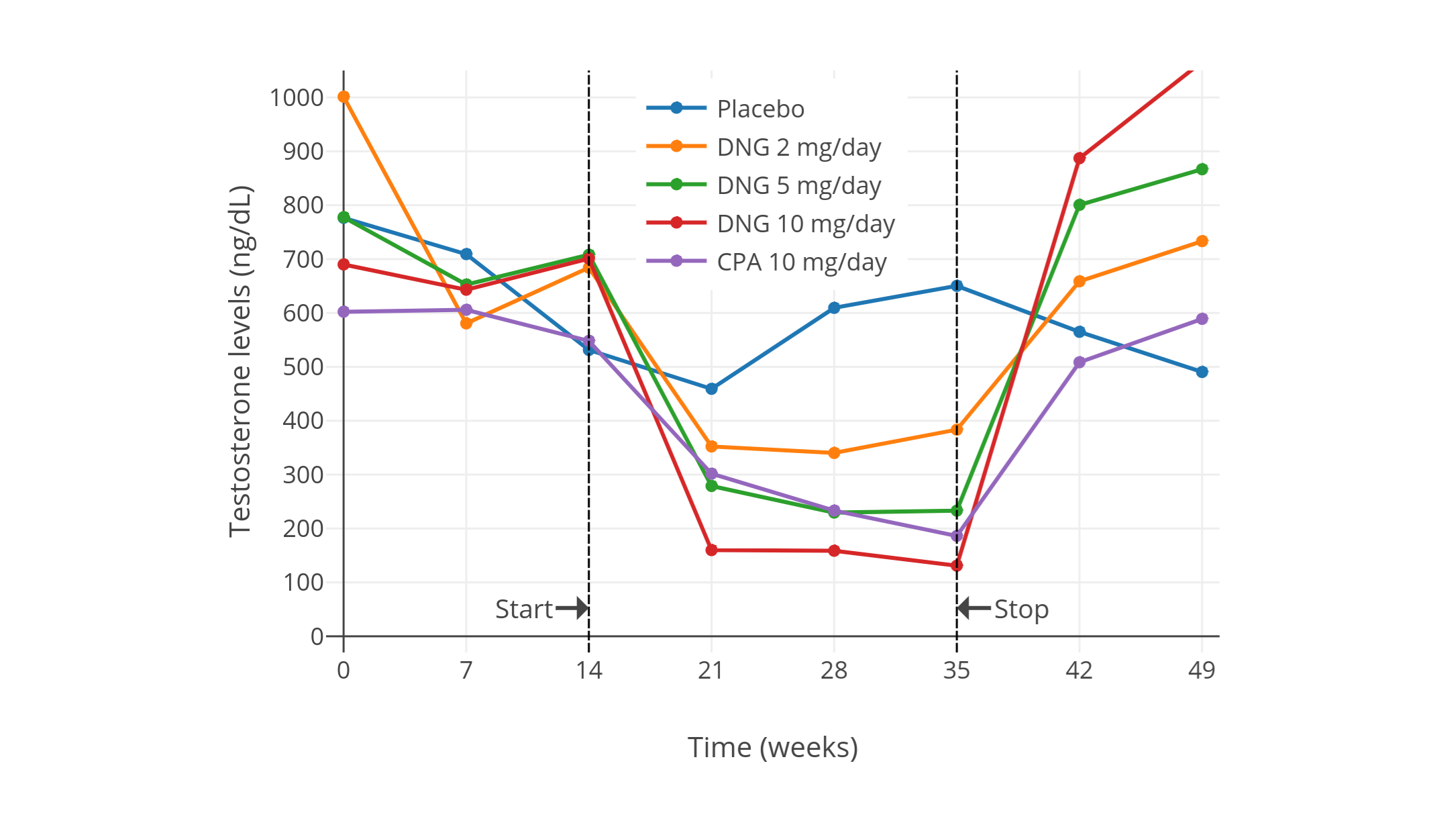
圖 1–4: 男性單服低劑量 CPA 期間的睾酮水平變化。資料來源:
- 上圖:Moltz et al. (1980); Moltz et al. (1978a); Moltz et al. (1978b)
- 中左圖:Wang & Yeung (1980)
- 中右圖:Koch et al. (1976); Koch et al. (1975)
- 下圖:Meriggiola et al. (2002a)
- 另見維基百科圖庫。
下圖來自上述 2002 年的研究項目,其中睾酮水平以時間分辨熒光分析法(DELFIA)進行測定。該項目還研究了不同劑量的地諾孕素(DNG);其僅需 1 mg/天劑量即可抑制排卵,這點與 CPA 相似。
有關去氧孕烯、地諾孕素、醋酸氯地孕酮等其它孕激素的研究項目,也同樣發現:在男性身上可最大程度抑制睾酮水平的劑量,約為婦女抑制排卵所需劑量的 5–10 倍(維基百科 1; 2; 3)。另一項有關醋酸炔諾酮和左炔諾孕酮的研究也印證了這點(Zitzmann et al., 2017; 圖表)。
類似地,當用於男性激素避孕時,孕激素作為抗促性腺激素製劑所需的最大有效劑量至少也有順性別婦女所需的 5–12 倍(Foegh, 1983)。
基於後者一般使用 1 mg/天的認知,可以認為 5–10 mg/天劑量的 CPA 即可將睾酮的抑制效果最大化。該範圍也與上述項目之發現相吻合。
有關更高劑量 CPA 的研究項目則發現,高劑量下睾酮的抑制效果,僅略優於低劑量的表現。近年來一些針對健康的青春期及成年女性傾向跨性別者的研究項目,發現在單服 50–100 mg/天的 CPA 的情況下,睾酮水平被抑制了 46–61%(在 4–12 個月內,從 456–602 ng/dL 降至 226–294 ng/dL)(Toorians et al., 2003; Giltay et al., 2004; T’Sjoen et al., 2005; Tack et al., 2017)。
針對老年男性前列腺癌患者的研究則發現,高劑量 CPA 單藥療法可最多將睾酮水平抑制 70–80%(降到了 50–200 ng/dL)(Gräf, Brotherton, & Neumann, 1974; Jacobi et al., 1980; 圖表; Knuth, Hano, & Nieschlag, 1984; 圖表; Schröder & Radlmaier, 2002; Nelson, 2012)。
之所以在前列腺癌患者身上測出了更大的睾酮抑制率,可能是因為不同項目之間驗血方法有所區別,以及/或者老年人羣的下丘腦–垂體–性腺軸(HPG 軸)功能更弱、從而使睾酮水平更低(Liu, Takahashi, & Veldhuis, 2017; Winters, Wang, & Fortigel Study Group, 2010)。
目前已有人發現,長期使用單服孕激素療法,會發生睾酮水平的“復原”或“逃逸”現象:儘管 (前期) 其在最大有效劑量下即被顯著抑制,但最終會逐漸回升。迄今該現象主要見於醋酸甲地孕酮(維基百科);但在 CPA 上亦有證實(Goldenberg & Bruchovsky, 1991; Saborowski, 1987; Jacobi, Tunn, & Senge, 1982)。其中一項研究顯示,睾酮水平起初被抑制了 70% 左右;但在第 6–12 個月療程中,其回升至 50% 左右,並在此後至多 24 個月內維持穩定。採用孕激素單藥療法抑制睾酮時,需要關注到睾酮的逃逸現象。不過,雌激素合併孕激素療法尚未被發現與此現象有關。
與雌激素合用時對睾酮的抑制作用
女性傾向跨性別者一般會將 CPA 與雌激素合用。雌激素同樣可抑制睾酮水平。二者合用時,可產生抑制睾酮的協同作用,其劑量相較單服雌激素或孕激素時也更少(Fink, 1979; Geller & Albert, 1983; Bastianelli et al., 2018)。 (如果單用雌激素,) 要將睾酮抑制到和經外科手術(即睾丸切除術)、或經藥物(即 GnRH 激動劑/拮抗劑)去勢相一致的水平,則要求相對較高的雌激素水平——例如 200–500 pg/mL 之間(維基百科; 圖表)。由於需要超生理劑量的雌二醇方可最大程度(或接近最大程度)抑制睾酮,因此,往往採用低劑量雌二醇結合抗雄製劑/孕激素的方式來替代。
多項研究中,將雌二醇與高劑量 CPA(50–100 mg/天)合併用於女性傾向跨性別者時,其將睾酮水平抑制到了女性正常範圍內(50 ng/dL 或 1.7 nmol/L 以下)(Giltay & Gooren, 2000; Giltay et al., 2000; Giltay et al., 2003; Giltay et al., 2004; Toorians et al., 2003; T’Sjoen et al., 2005; Slagter et al., 2006; T’Sjoen et al., 2009; Ott et al., 2011; Wierckx et al., 2012; Wierckx et al., 2014; Zubiaurre-Elorza et al., 2014; Fuss et al., 2015; Van Caenegem et al., 2015; Gava et al., 2016; Bultynck et al., 2017; Fung, Hellstern-Layefsky, & Lega, 2017; Kranz et al., 2017; Tack et al., 2017; Wiepjes et al., 2017; de Blok et al., 2018; Defreyne et al., 2018; Vita et al., 2018; Angus et al., 2019; Chen et al., 2019; Scharff et al., 2019; van Dijk et al., 2019; van Velzen et al., 2019; Vereecke, 2019; Vlot et al., 2019; Wiepjes et al., 2019; Kranz, Kaufmann, & Lanzenberger, 2020; Meyer et al., 2020; Gava et al., 2020; Sofer et al., 2020; Vereecke et al., 2021)。
1980 和 1990 年代,針對前列腺癌患者的臨牀研究發現,將高劑量孕激素(例如每日 100–300 mg 的 CPA、或 40–160 mg 的醋酸甲地孕酮)結合低劑量雌激素(例如每日 0.1–0.2 mg 的己烯雌酚、或 0.5–1.5 mg 的雌二醇)使用,可完全抑制性腺的睾酮分泌,並將睾酮水平降至去勢後的範圍(小於 50 ng/dL)(Geller et al., 1981a; Geller et al., 1981b; Geller & Albert, 1983; Goldenberg et al., 1988; Johnson et al., 1988; Geller, 1988; Venner et al., 1988; Geller, 1991; Goldenberg & Bruchovsky, 1991; Bruchovsky et al., 1993; Goldenberg et al., 1996)。與此類似,一份 1989 年的病例系列報告也披露,有 3 名女性傾向跨性別者在以 100 mg/天的 CPA 合併較低劑量雌激素治療後,取得了同樣療效(Jequier, Bullimore, & Bishop, 1989)。
這裏有一篇文獻摘錄對 CPA 用於前列腺癌治療的情況做了詳述:
如前所述,CPA 並未完全抑制血漿睾酮濃度:其被抑制了 70% 左右,但數值仍相當於去勢後濃度的三倍。為系統研究該問題,Rennie 等 (59) 調查並對比了 12 種睾酮除去法。他們發現,將 CPA 與極低劑量的己烯雌酚(0.1 mg/天)合用,可高效去除雄激素(例如血漿睾酮、組織內的雙氫睾酮)。該團隊隨後還發現,每日 200mg、甚至 100mg 的 CPA 足以獲得相似的內分泌反饋,這也和其第二階段臨牀治療的相當正面的反饋具有關聯性 (60,61)。從內分泌學視角而言,這項研究法不僅具有較多潛在優勢,而且邏輯性很強:這種給藥方案可結合兩種製劑的抗雄效果;僅需少量雌激素,即可將血漿睾酮水平降低至經過去勢的程度。一旦睾酮達到去勢後水平,只需少量 CPA 即可中和剩餘雄激素(主要來自腎上腺)的作用。在第三階段療程裏,並未將合用低劑量 CPA 及己烯雌酚的療法,與常規療法進行比較。考慮到現有內分泌反饋與觀察結果,二者合用的療法應該具有相對其它常規療法的競爭力。(Schröder & Radlmaier, 2002)
一項 2016 年的研究發現,在每日服用 50 mg 的 CPA、並塗抹 1–2 mg 雌二醇透皮凝膠的女性傾向跨性別者當中,45 pg/mL 左右的雌二醇水平(結合 CPA)並不足以將睾酮抑制到女性/去勢後範圍;其睾酮水平約為 120–190 ng/dL(Gava et al., 2016; 圖表)。不過,85 pg/mL 左右的雌二醇水平(結合 CPA)則完全抑制了性腺的睾酮分泌,最終睾酮水平約在 20 ng/dL。因此,結合 CPA 來完全抑制睾酮所需的雌二醇濃度,需達到一個特定最小值。
另一項 2019 年的有關 CPA 與口服戊酸雌二醇用於女性傾向跨性別者的研究顯示,完全抑制睾酮水平所需的雌二醇濃度,中位數為 76 pg/mL,第 25 百分位數為 63 pg/mL(Angus et al., 2019; 圖表)。
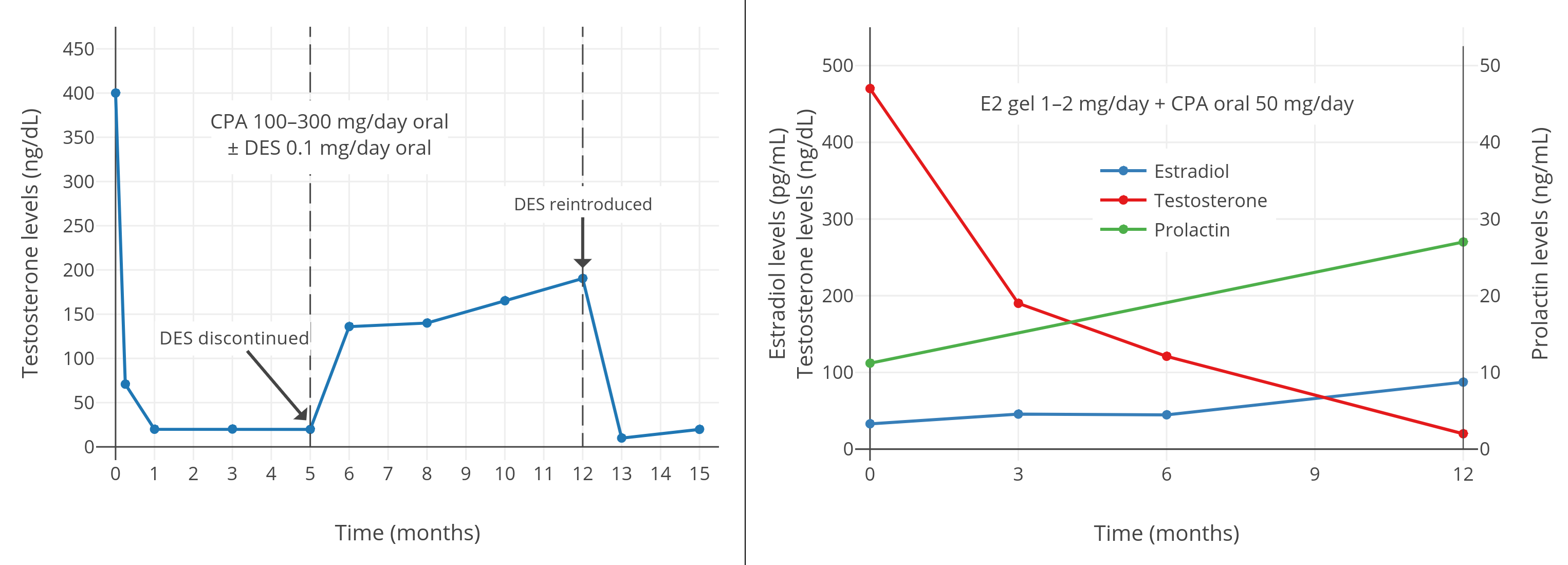
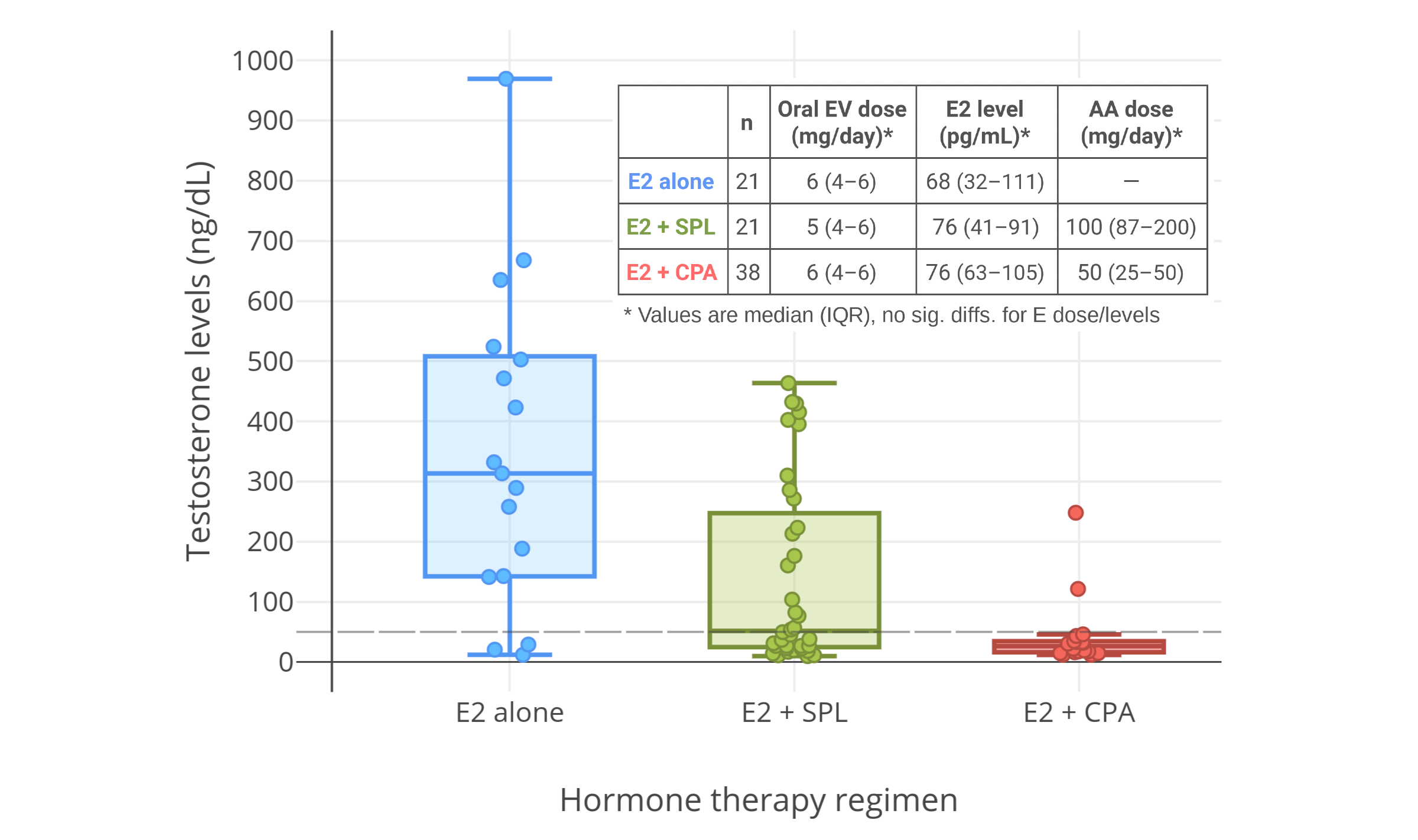
圖 5–7: 男性、女性傾向跨性別者合用 CPA 與低劑量雌激素時的睾酮濃度。資料來源:
- 左上圖:Goldenberg et al. (1988)
- 右上圖:Gava et al. (2016)
- 下圖:Angus et al. (2019)
- 另見維基百科圖庫。
右上圖附註:透皮雌二醇平均劑量在第 6–12 個月有所提升,此做法可能導致了睾酮抑制率有所加強。
Fung 及其同行發現,將 25 或 50 mg/天的 CPA 結合口服雌二醇(約 3.5 mg/天)或透皮雌二醇(約 3.5 mg/天的凝膠,或約 100 μg/天的貼片)用於女性傾向跨性別者,可完全、一致地抑制性腺的睾酮分泌,其睾酮水平被抑制約 95%(Fung, Hellstern-Layefsky, & Lega, 2017)。該劑量的雌二醇被認為可達到平均 100 pg/mL 的雌二醇水平(Aly, 2020; 維基百科)。
該研究恰巧比美國內分泌學會的 2017 年版《指南》(Hembree et al., 2017)早發佈六個月;其可能是促使後者所推薦的 CPA 劑量減少的原因(從 50–100 mg/天降至 25–50 mg/天)。
迄今罕有研究了結合低劑量 CPA 與中、低劑量雌激素對睾酮之抑制的項目。不過,基於單服 5–10 mg/天的 CPA 已可最大程度抑制睾酮的事實,可以認為其效果與高劑量的類似。根據部分研究,結合使用 5–12.5 mg/天的 CPA 與用於生理替代的睾酮的健康年輕男性,已檢測不出促性腺激素(小於 0.5 IU/L),睾丸功能因此被完全抑制(Meriggiola et al., 1998; Meriggiola et al., 2002b)。雌二醇的促性腺激素拮抗效應,相對睾酮也更強(維基百科),因此這些發現或許也適用於結合 CPA 與用於生理替代的雌二醇(例如平均 100–200 pg/mL 的雌二醇濃度)的情況。
依據 Meyer 等人 (2020) 對 155 名女性傾向跨性別者合用 CPA 與雌二醇進行的研究,10、25、50 mg/天劑量的 CPA 並未在睾酮水平上形成差異;三者皆達到較高抑制率(平均降至 15–20 ng/dL,落入女性正常範圍的下限)。其中所用雌二醇形態包括:口服戊酸雌二醇(劑量範圍 3–10 mg/天、中位數 6 mg/天),雌二醇透皮凝膠(劑量範圍 1.5–6 mg/天、中位數 2.25 mg/天),以及雌二醇透皮貼片(100 μg/天)。雌二醇濃度平均達 100 pg/mL 左右;而四分位間距(即第 25、第 75 百分位之差)則可達 100 pg/mL 左右。該研究表明,對於女性傾向跨性別者,在雌二醇水平足夠高的情況下,僅需不超過 10 mg/天的 CPA 即可完全抑制睾酮水平。
另一項研究也發現,女性傾向跨性別者使用小於 20 mg/天、和大於 50 mg/天的 CPA,在睾酮抑制率上無任何區別(Even-Zohar et al., 2020)。
在雌二醇水平合適的情況下,為抑制睾酮甚至僅需低於 5 mg/天劑量的 CPA(例如 2 mg/天),然而尚無任何研究予以證實。不過,這種概念在對其它孕激素的研究中已有先例。例如,在一項研究裏,女性傾向跨性別者每日服用 10 mg 的醋酸甲羥孕酮(該劑量大致相當於可抑制絕經前婦女排卵的 CPA 劑量:1 mg/天(表格)),其睾酮水平下降了 63%,達 215 ng/dL(相比之下,雌二醇—螺內酯聯合療法可達 79 ng/dL)(Jain, Kwan, & Forcier, 2019)。因此,可以期望極低劑量的 CPA 也能達到類似效果;而且,這種劑量還具有將人體孕激素暴露量減至正常生理水平的益處。
更低劑量 CPA 的臨牀應用
考慮到高劑量 CPA 的風險、以及其低劑量下較強的睾酮抑制能力,臨牀上低劑量 CPA 正更多地被用於女性化激素治療。許多文獻證實了這點,其中向女性傾向跨性別者推薦了更少的劑量(例如 Lederbogen, 2009; Fung, Hellstern-Layefsky, & Lega, 2017; Heath & Wynne, 2019; Winkler-Crepaz et al., 2017; Mahfouda et al., 2018; Oliphant et al., 2018; Athanasoulia-Kaspar & Stalla, 2019; Bourns, 2019; Fuss et al., 2019; Jacobeit, 2019; Nota, den Heijer, & Gooren, 2019; 澳洲與新西蘭臨牀試驗登記系統, ANZCTR, 2020; Meyer et al., 2020; T’Sjoen et al., 2020)。其中,Nota, den Heijer, & Gooren (2019) 的文章將 CPA 推薦的、最低必要劑量定為 10–50 mg/天,該劑量與先前過大的推薦及使用劑量(100 mg/天)(Asscheman & Gooren, 1993; Gooren, Giltay, & Bunck, 2008)形成了鮮明反差。
更高劑量 CPA 的雄激素受體拮抗效應
CPA 的雄激素受體拮抗效應相對較弱;為達到有意義、或明顯的雄激素受體拮抗效果,每日需服用 50–300 mg。但不幸的是,該劑量造成了孕激素的嚴重過度攝入,並與更高風險及更多不良反應有關。因此,不宜再推薦使用這種劑量。相反,CPA 應僅作為孕激素,以較低劑量來抑制睾酮水平。例如,可最大程度抑制睾酮的 CPA 劑量,大約在 10 mg/天或以下(不過 12.5 mg/天亦可接受);適宜女性傾向跨性別者的最大劑量,應接近該數值。
需要強調的是:將 CPA 結合雌激素使用,可將睾酮水平輕鬆抑制到女性、或去勢後範圍(往往還低於 女性平均水平),因此並不需要伴隨雄激素受體拮抗作用。無論如何,如果仍需要、或期望通過雄激素受體拮抗作用來中和剩餘的處在女性、或去勢後水平的睾酮(例如治療頑固性痤瘡、或有其它目的),可以在 CPA 之外再補充少量非孕激素類雄激素受體拮抗劑,例如比卡魯胺(100–200 mg/天)或螺內酯(12.5–25 mg/天);這些相對高劑量 CPA 而言更為安全。
CPA 的推薦劑量
抑制睾酮所需劑量
如結合雌激素使用:
對於女性傾向跨性別者,下表所示 CPA 劑量足以最大 程度抑制睾酮水平:
表 2: 與雌激素並用時,可最大程度抑制女性傾向跨性別者體內睾酮的 CPA 劑量
| 劑型 | 最小劑量 | 最大劑量 | 用法 |
|---|---|---|---|
| 10 mg 片劑 | 5 mg/天 | 10 mg/天 | 每日半片到一片 |
| 50 mg 片劑 | 6.25 mg/天 | 12.5 mg/天 | 每日 ⅛ 到 ¼ 片 |
最初一個月內,僅使用最小劑量。一個月過後,檢查睾酮水平以確認其是否處在女性、或去勢後範圍(50 ng/dL 以下)。如要完全抑制睾酮,需同時讓雌二醇水平至少達到 65 pg/mL 左右(無關 CPA 劑量)。如果一個月後睾酮未被充分抑制、而雌二醇水平已足夠,那麼將 CPA 劑量加至最大推薦量,過一個月再檢查睾酮水平。不過,作為替代,也可增加雌二醇用量;雌二醇水平越高,睾酮抑制率更佳。
如單服 CPA:
不建議單服 CPA 以抑制睾酮;因為其存在骨質疏鬆風險,以及其它由性激素缺乏引起的症狀(維基百科; Aly, 2019)。無論如何,單服的推薦劑量基本等同於上述合用雌激素時的用量。不過,略高的劑量(10–12 mg/天)不失為一種更好的選擇。
孕激素作用所需劑量
對於女性傾向跨性別者,下表所示 CPA 劑量基本與通常的孕激素生理暴露量(即排卵期內孕激素水平)相似:
表 3: 可在女性傾向跨性別者體內表達生理性孕激素效力的 CPA 推薦劑量
| 劑型 | 劑量 | 用法 |
|---|---|---|
| 10 mg 片劑 | 2.5 mg/天 | 每日 ¼ 片 |
| 50 mg 片劑 | 3.125 mg/天 | 每日 1/16 片 |
達到預期劑量的手段
CPA 通常被製成 50 mg 片劑;這會給控制低劑量造成困難。此時可以使用切藥器來切割 CPA 片劑。另外,還可每過 2 日或 3 日服用一次 CPA(而非每日服用),這樣可平攤日均劑量。有一點需要補充:CPA 的清除半衰期較長,一般為 1.5–2 日,最長可達 4 日(維基百科; 圖表)。因此,隔日服用、甚至每 3 日服用一次,是有市場的,也完全合情合理。
後記
後記一:正在開展的 GoLoCypro 研究
澳大利亞昆士蘭大學的 Judith Dean 博士,正進行一項名曰 GoLoCypro 的研究(2019–2022 年;其它資料)。該項目正評估 120–350 名女性傾向跨性別者合用 CPA 與雌二醇時,不同 CPA 劑量(每週兩次 12.5 mg,隔日 12.5 mg,以及每日 12.5 mg、25 mg、50 mg)所產生的影響。CPA 劑量會被滴定到一個可維持睾酮水平在 0.5–1.5 nmol/L(14–43 ng/dL)的臨牀目標範圍內的最小值。該項目是首批有關 CPA 用於女性傾向跨性別者的劑量範圍研究之一;其提供的有關可充分抑制睾酮的 CPA 最小劑量的寶貴資料亦備受關注。
後記二:Kuijpers 等人 (2021) 與 Even Zohar 等人 (2021) 所作研究
2021 年 7 月,歐洲性別不一致調查組織網絡(ENIGI)在線發表了一篇有關女性傾向跨性別者使用低劑量 CPA 的研究論文:
- Kuijpers, S. M., Wiepjes, C. M., Conemans, E. B., Fisher, A. D., T’Sjoen, G., & den Heijer, M. (2021). Toward a lowest effective dose of cyproterone acetate in trans women: Results from the ENIGI study. The Journal of Clinical Endocrinology & Metabolism, 106(10), e3936–e3945. [DOI: 10.1210/clinem/dgab427]
該項目結合使用了雌二醇與 CPA,所用劑量如下:
- 雌二醇: 戊酸雌二醇片(每日口服 2-6 mg)、貼片(50–150 μg/天)、凝膠等;
- CPA: 不服用(0 mg/天)、10 mg/天、25 mg/天、50 mg/天、100 mg/天。
在不服用 CPA 的實驗組,睾酮的抑制並不充分;而所有服用 CPA 的實驗組皆達到完全、且一致的睾酮抑制效果。結果如下:
| CPA 劑量 | 不服用 | 10 mg/天 | 25 mg/天 | 50 mg/天 | 100 mg/天 |
|---|---|---|---|---|---|
| 初始受試者人數 | 34 | 4 | 234 | 599 | 11 |
| 提高劑量的人數 | 16 | 1 | 11 | 2 | 0 |
| 降低劑量的人數 | 0 | 0 | 4 | 40 | 7 |
| 睾酮水平(nmol/L) | 5.5 | 0.9 | 0.9 | 1.1 | 0.9 |
| 睾酮水平(ng/dL) | ~160 | ~26 | ~26 | ~32 | ~26 |
| 檢出睾酮低於 2 nmol/L 次數佔比 | 46.3% | 92.3% | 96.2% | 93.4% | 100% |
該項目並未提供調整 CPA 劑量之後受試者總人數,以及其驗血結果。因此,10 mg/天實驗組的實際人數與驗血結果並不可靠。不過,基於以上“檢出睾酮低於 2 nmol/L 次數佔比”的數據,該實驗組的驗血次數應當至少有 13 次(92.3% 大致等於 12/13,但也可能是 24/26,以此類推)。論文作者考慮到該組別人數/驗血次數較少,也作出瞭解釋:
本項目是屬於 ENIGI 倡議之下的一項前瞻性羣組研究。項目中為跨性別女性所用的主要醫療方案,是每日結合使用雌激素與 50 mg 的 CPA。在實驗的第一年,一些參與者使用每日 100 mg 的 CPA 劑量。此後不久,其處方調整為每日 50 mg 的 CPA。鑑於近年出現越來越多的有關 CPA 的健康擔憂,CPA 劑量後來又從 50 mg 減至 25 mg、10 mg。然而,受冠狀病毒 (COVID-19) 疫情影響,來自 10 mg/天劑量組的參與者的結果,只有少量可用於分析。
該項目還發現,除了睾酮抑制率之外,在泌乳素與高密度脂蛋白(膽固醇)濃度上,10 mg/天劑量 CPA 的影響要小於高劑量。該項目也測定了肝轉化酶水平,但未發現不同劑量之間有差異。
論文作者總結如下:
總而言之,對於這組跨性別女性羣體,10 mg/天的 CPA 被發現足以將睾酮濃度降低至在順性別婦女測出的範圍內。該劑量 CPA 不僅和高劑量同樣有效,而且對泌乳素濃度的影響更小,也能維持更高的高密度脂蛋白(膽固醇)水平。
儘管相較 CPA,選擇長期副作用更少的 GnRH 激動劑會更佳;但如果 GnRH 激動劑有禁忌症、無法獲取、或者無法報銷的情況,那麼依據本項目的發現,低劑量 CPA 也不失為一種選項。
將來的研究重點,應該放在對更小劑量 CPA(例如 5 mg)之效力的評估、以及其潛在的長期副作用上。
圍繞該論文的觀點,論文作者之一:Guy T’Sjoen 及其他同行還在一篇對女性傾向跨性別者而言最佳的激素療法之論述中,推薦 CPA 劑量應不高於 10 或 12.5 mg/天,且不應持續服用超過兩年(Glintborg et al., 2021)。值得一提的是,T’Sjoen 其人被視為跨性別醫學方面首屈一指的專家之一;他也是美國內分泌學會《跨性別護理指南》的聯名作者之一(Hembree et al., 2017)。
在 Kuijpers 及其同行發表論文後不久,以色列的 Even Zohar 及其同行也於 2021 年 7 月,發表了一篇有關女性傾向跨性別者使用低劑量 CPA 的研究論文(其最初在 2020 年 5 月,作為會議摘要發表):
- Even Zohar, N., Sofer, Y., Yaish, I., Serebro, M., Tordjman, K., & Greenman, Y. (2021).
Low-Dose Cyproterone Acetate Treatment for Transgender Women.
The Journal of Sexual Medicine, 18(7), 1292–1298. [10.1016/j.jsxm.2021.04.008] - 會議摘要:Even-Zohar et al., 2020
在該論文的前言部分,有如下敍述:
為協助醫師對跨性別女性進行治療,一些組織已發佈了《治療指南》。CPA 已被廣泛用於給藥方案當中。總的來説,近年來 CPA 的推薦劑量已在減小:在美國內分泌學會 2009 年版《指南》當中,CPA 推薦劑量為 50–100 mg/天;但到了 2017 年,該劑量修訂為 25–50 mg/天。而在澳大利亞跨性別健康專業協會的 2019 年版《指南》所建議的 CPA 劑量,則為 12.5–25 mg/天。至於由歐洲性醫學會發布的 2020 年版《指南》,則將 CPA 劑量修訂為 10–50 mg/天。迄今尚無有關不同 CPA 劑量的效力與安全性之間的對比數據的論文發表。
該論文的研究者發現,當合用雌二醇時,低劑量 CPA(10–20 mg/天)的睾酮抑制率與高劑量(50–100 mg/天)一致。睾酮水平降低到了(或接近)女性/去勢後範圍(一般不超過 2 nmol/L 或 58 pg/mL)。
有 38 名女性傾向跨性別者服用低劑量 CPA,其中 32 名(84%)的劑量為 10 mg/天、6 名(16%)的劑量為 20 mg/天,平均劑量 11.6 ± 3.7 mg/天。雌二醇則通過透皮貼片(平均劑量 83.7 ± 36.5 μg/天)、透皮凝膠(平均劑量 3.8 ± 1.2 g/天)或者口服(平均劑量 4.1 ± 1.7 mg/天)的形式給藥。後續在低劑量、高劑量 CPA 組別當中,雌二醇濃度平均達到了約 110 到 350 pmol/L(或約 30–95 pg/mL)。
除睾酮抑制效果之外,研究還發現了:在 12 個月激素治療過後,低劑量 CPA 組別的泌乳素水平(398 ± 69 mIU/mL)顯著低於高劑量的水平(804 ± 121 mIU/mL)。
基於這些發現,論文作者敍述如下:
我們建議,現有的《臨牀實踐指南》應修訂其為跨性別女性推薦的 CPA 劑量。
Kuijper 等人 (2021) 和 Even Zohar 等人 (2021) 均聲明,其為首次揭露女性傾向跨性別者服用低劑量 CPA 之療效。不過,這項成就其實應該屬於 Meyer 等人 (2020);其於 2020 年 2 月便已發現,女性傾向跨性別者合用雌二醇與 10、25、50 mg/天的 CPA 時,可獲得一致的睾酮抑制效果。
Lim 等人 (2020) 在 2020 年 5/7 月發表了一篇論文;其研究課題並非與 CPA 及睾酮抑制效果有關,不過,其報告了 26 名女性傾向跨性別者分別使用口服與透皮雌二醇時,睾酮水平中位數(四分位間距)分別為 0.6 (0.4–1.0) nmol/L 和 0.9 (0.7–1.6) nmol/L;她們還分為了合用雌二醇與低劑量 CPA(12.5–18.8 mg/天,中位數 12.5;共 14 人)、摘除性腺後單用雌二醇(共 9 人)、以及合用雌二醇與螺內酯(共 3 人)等組別。
後記三:Kumar 等人 (2021) 所報告的與低劑量 CPA 有關的肝衰竭病例
一篇於 2021 年 12 月發表的論文報告了一起由低劑量 CPA 引起的致命肝衰竭病例:
- Kumar, P., Reddy, S., Kulkarni, A., Sharma, M., & Rao, P. N. (2021).
Cyproterone acetate induced Acute liver failure: Case report and review of the literature.
Journal of Clinical and Experimental Hepatology, 11(6), 739–741. [DOI: 10.1016/j.jceh.2021.01.003]
該病例描述了一名 30 歲順性別婦女連續六個月服用 25 mg/天的 CPA 以治療多毛症,但患上了急性肝衰竭;住院四天後不治身亡。這是迄今報告的第二起和低於 100 mg/天劑量的 CPA 之肝毒性有關的病例(維基百科; 表格),也是第一起有關 CPA 對於順性別婦女之肝毒性的病例。該病例表明,在肝毒性上,即便相對較低的 CPA 劑量:25 mg/天,也並非足夠安全。
該論文還強調了女性傾向跨性別者應使用最低有效劑量(不大於 10–12.5 mg/天)的重要性。
後記四:Coleman 等人 (2022) 所作 WPATH SOC8《指南》
2022 年 9 月,世界跨性別人士健康專業協會(WPATH)發佈了第八版《跨性別及性別多元化人羣健康護理標準》(SOC8),其中首次為跨性別激素治療提供建議(Coleman et al., 2022)。其向女性傾向跨性別者推薦的 CPA 劑量為 10 mg/天(Coleman et al., 2022)。此劑量遠比早前發佈的《跨性別護理指南》所建議的要低;這也是首次有主流《指南》推薦如此低的劑量。
該《標準》提及了 Kuijpers 等人 (2021) 並支持其推薦的劑量[但並未提及 Even Zohar 等人 (2021) 或 Meyer 等人 (2020)],同時還討論了腦膜瘤和高泌乳素水平等與 CPA 劑量有關的風險(Coleman et al., 2022)。
考慮到 WPATH 的這篇《標準》在跨性別健康領域的重要地位和影響力,可以認為,全球範圍內在女性化激素治療當中使用低劑量 CPA 的情況將會更普遍。有當下公認的循證實踐在先,不應再繼續使用高劑量 CPA。
後記五:Collet 等人 (2023) 所作研究
2022 年 10 月,一項對雌二醇與 CPA 的睾酮抑制效果進行細緻評估的研究,公開發表了論文:
- Collet, S., Gieles, N., Wiepjes, C. M., Heijboer, A. C., Reyns, T., Fiers, T., Lapauw, B., den Heijer, M., & T’Sjoen, G. (2023).
Changes in serum testosterone and adrenal androgen levels in transgender women with and without gonadectomy.
The Journal of Clinical Endocrinology & Metabolism, 108(2), 331–338. [DOI:10.1210/clinem/dgac576]
該項目屬於歐洲性別不一致調查組織網絡(ENIGI)倡議之下的一部分,其中大多數患者來自荷蘭阿姆斯特丹的診所、以及比利時根特的診所。
該項目中有 275 名女性傾向跨性別者接受雌二醇合併 CPA 治療。她們的總睾酮、遊離睾酮水平,以及由腎上腺分泌的雄激素——脱氫表雄酮(DHEA)、硫酸脱氫表雄酮(DHEA-S)與雄烯二酮(A4)等——之水平,以液相色譜–質譜聯用法(LC-MS)進行測定;測定時間定於跟蹤開始時(基線)、第 3 個月、第 12 個月、第 2–4 年以及經手術切除性腺之後(此時不再服用 CPA)。至於其雌二醇水平,則以 LC-MS(阿姆斯特丹方面)或免疫測定法(根特方面)進行測定。
其所用雌二醇形式與劑量,大多為 4 mg/天的口服戊酸雌二醇或 100 μg/天的雌二醇透皮貼片;而 CPA 的劑量多為 25–50 mg/天。
這些人當中有大約一半,在以激素治療約兩年之後都接受了性腺切除術。
結果顯示:
- 在不同跟蹤時長下,以 LC-MS 和免疫測定法測定的雌二醇水平中位數,分別為 49–75 pg/mL(合 180–275 pmol/L)和 63–69 pg/mL(232–255 pmol/L)。
- 在接受激素治療達三個月之後,總睾酮水平從 536 ng/dL (18.6 nmol/L) 降至 12 ng/dL (0.40 nmol/L),降幅 97.1%;而遊離睾酮水平從 109 pg/mL (378 pmol/L) 降至 2.0 pg/mL (7.1 pmol/L),降幅 98.3%;此後,總睾酮、遊離睾酮水平維持穩定。
- 至於 DHEA、DHEA-S 及 A4 等激素的水平,降幅則分別達 24.9–28.0%、20.1–23.5% 及 36.5%,到了激素治療第 3–12 月之後也基本不變。
- 接受性腺切除術並停用 CPA 之後,並未出現睾酮水平的變化。
論文作者指出,在本研究中,接受激素治療的女性傾向跨性別者的睾酮水平,與順性別婦女接近或稍低於之。
參考文獻
- Angus, L., Leemaqz, S., Ooi, O., Cundill, P., Silberstein, N., Locke, P., Zajac, J. D., & Cheung, A. S. (2019). Cyproterone acetate or spironolactone in lowering testosterone concentrations for transgender individuals receiving oestradiol therapy. Endocrine Connections, 8(7), 935–940. [DOI:10.1530/ec-19-0272]
- Asscheman, H., & Gooren, L. J. (1992). Hormone Treatment in Transsexuals. In Bocking, W. O., Coleman, E. (Eds). Gender Dysphoria: Interdisciplinary Approaches in Clinical Management (pp. 39–54). Binghamton: Haworth Press. / Journal of Psychology & Human Sexuality, 5(4), 39–54. [Google 學術] [Google 閲讀] [DOI:10.1300/J056v05n04_03]
- Athanasoulia-Kaspar, A. P., & Stalla, G. K. (2019). Endokrinologische Betreuung von Patienten mit Transsexualität. Geburtshilfe und Frauenheilkunde, 79(7), 672–675. [DOI:10.1055/a-0801-3319]
- Bastianelli, C., Farris, M., Rosato, E., Brosens, I., & Benagiano, G. (2018). Pharmacodynamics of combined estrogen-progestin oral contraceptives 3. Inhibition of ovulation. Expert Review of Clinical Pharmacology, 11(11), 1085–1098. [DOI:10.1080/17512433.2018.1536544]
- Bourns, A. (2019). Guidelines for Gender-Affirming Primary Care with Trans and Non-Binary Patients, 4th Edition. Toronto: Rainbow Health Ontario/Sherbourne Health. [URL] [PDF]
- Bruchovsky, N., Larry Goldenberg, S., Akakura, K., & Rennie, P. S. (1993). Luteinizing hormone-releasing hormone agonists in prostate cancer. Elimination of flare reaction by pretreatment with cyproterone acetate and low-dose diethylstilbestrol. Cancer, 72(5), 1685–1691. [DOI:10.1002/1097-0142(19930901)72:5<1685::aid-cncr2820720532>3.0.co;2-3]
- Bultynck, C., Pas, C., Defreyne, J., Cosyns, M., den Heijer, M., & T’Sjoen, G. (2017). Self-perception of voice in transgender persons during cross-sex hormone therapy. The Laryngoscope, 127(12), 2796–2804. [DOI:10.1002/lary.26716]
- Chen, H., Wiepjes, C. M., van Schoor, N. M., Heijboer, A. C., de Jongh, R. T., den Heijer, M., & Lips, P. (2019). Changes of Vitamin D-Binding Protein, and Total, Bioavailable, and Free 25-Hydroxyvitamin D in Transgender People. The Journal of Clinical Endocrinology & Metabolism, 104(7), 2728–2734. [DOI:10.1210/jc.2018-02602]
- Coleman, E., Radix, A. E., Bouman, W. P., Brown, G. R., de Vries, A. L., Deutsch, M. B., Ettner, R., Fraser, L., Goodman, M., Green, J., Hancock, A. B., Johnson, T. W., Karasic, D. H., Knudson, G. A., Leibowitz, S. F., Meyer-Bahlburg, H. F., Monstrey, S. J., Motmans, J., Nahata, L., … & Arcelus, J. (2022). [World Professional Association for Transgender Health (WPATH)] Standards of Care for the Health of Transgender and Gender Diverse People, Version 8. International Journal of Transgender Health, 23(Suppl 1), S1–S259. [DOI:10.1080/26895269.2022.2100644] [URL] [PDF]
- Collet, S., Gieles, N., Wiepjes, C. M., Heijboer, A. C., Reyns, T., Fiers, T., Lapauw, B., den Heijer, M., & T’Sjoen, G. (2023). Changes in serum testosterone and adrenal androgen levels in transgender women with and without gonadectomy. The Journal of Clinical Endocrinology & Metabolism, 108(2), 331–338. [DOI:10.1210/clinem/dgac576]
- Damgaard-Pedersen, F., & Føgh, M. (1980). The effect of cyproterone acetate on serum lipids in normal men. Acta Endocrinologica, 94(2), 280–283. [DOI:10.1530/acta.0.0940280]
- de Blok, C. J., Klaver, M., Wiepjes, C. M., Nota, N. M., Heijboer, A. C., Fisher, A. D., Schreiner, T., T’Sjoen, G., & den Heijer, M. (2017). Breast Development in Transwomen After 1 Year of Cross-Sex Hormone Therapy: Results of a Prospective Multicenter Study. The Journal of Clinical Endocrinology & Metabolism, 103(2), 532–538. [DOI:10.1210/jc.2017-01927]
- Defreyne, J., Vantomme, B., Van Caenegem, E., Wierckx, K., De Blok, C., Klaver, M., Nota, N. M., Van Dijk, D., Wiepjes, C. M., Den Heijer, M., & T’Sjoen, G. (2018). Prospective evaluation of hematocrit in gender-affirming hormone treatment: results from European Network for the Investigation of Gender Incongruence. Andrology, 6(3), 446–454. [DOI:10.1111/andr.12485]
- Endrikat, J., Gerlinger, C., Richard, S., Rosenbaum, P., & Düsterberg, B. (2011). Ovulation inhibition doses of progestins: a systematic review of the available literature and of marketed preparations worldwide. Contraception, 84(6), 549–557. [DOI:10.1016/j.contraception.2011.04.009]
- Even-Zohar, N., Sofer, Y., Yaish, I., Serebro, M., Tordjman, K., & Greenman, Y. (2020). SUN-042 Low Dose Cyproterone Acetate for the Treatment of Transgender Women - a Retrospective Study. Journal of the Endocrine Society, 4(Suppl 1), A715–A715. [DOI:10.1210/jendso/bvaa046.1412]
- Even Zohar, N., Sofer, Y., Yaish, I., Serebro, M., Tordjman, K., & Greenman, Y. (2021). Low-Dose Cyproterone Acetate Treatment for Transgender Women. The Journal of Sexual Medicine, 18(7), 1292–1298. [DOI:10.1016/j.jsxm.2021.04.008]
- Fink, G. (1979). Feedback Actions of Target Hormones on Hypothalamus and Pituitary With Special Reference to Gonadal Steroids. Annual Review of Physiology, 41(1), 571–585. [DOI:10.1146/annurev.ph.41.030179.003035]
- Føgh, M., Corker, C. S., Hunter, W. M., McLean, H., Philip, J., Schou, G., & Shakkebæk, N. E. (1979). The effects of low doses of cyproterone acetate on some functions of the reproductive system in normal men. Acta Endocrinologica, 91(3), 545–552. [DOI:10.1530/acta.0.0910545]
- Føgh, M., Knudsen, J. B., & Gormsen, J. (1980). Effect of cyproterone acetate on platelet aggregability, fibrinolytic activity and fibrinolytic capacity in normal men. Acta Endocrinologica, 94(3), 430–432. [DOI:10.1530/acta.0.0940430]
- Foegh, M. (1983). Evaluation of Steroids as COntraceptives in Men. Acta Endocrinologica, 104(3 Suppl b), S9–S48. [DOI:10.1530/acta.0.104s009]
- Fredricsson, B., & Carlström, K. (1981). Effects of Low Doses of Cyproterone Acetate on Sperm Morphology and some other Parameters of Reproduction in Normal Men. Andrologia, 13(4), 369–375. [DOI:10.1111/j.1439-0272.1981.tb00067.x]
- Fung, R., Hellstern-Layefsky, M., & Lega, I. (2017). Is a lower dose of cyproterone acetate as effective at testosterone suppression in transgender women as higher doses? International Journal of Transgenderism, 18(2), 123–128. [DOI:10.1080/15532739.2017.1290566]
- Fuss, J., Hellweg, R., Van Caenegem, E., Briken, P., Stalla, G. K., T’Sjoen, G., & Auer, M. K. (2015). Cross-sex hormone treatment in male-to-female transsexual persons reduces serum brain-derived neurotrophic factor (BDNF). European Neuropsychopharmacology, 25(1), 95–99. [DOI:10.1016/j.euroneuro.2014.11.019]
- Fuss, J., Claro, L., Ising, M., Biedermann, S. V., Wiedemann, K., Stalla, G. K., Briken, P., & Auer, M. K. (2019). Does sex hormone treatment reverse the sex-dependent stress regulation? A longitudinal study on hypothalamus-pituitary-adrenal (HPA) axis activity in transgender individuals. Psychoneuroendocrinology, 104, 228–237. [DOI:10.1016/j.psyneuen.2019.02.023]
- Gava, G., Cerpolini, S., Martelli, V., Battista, G., Seracchioli, R., & Meriggiola, M. C. (2016). Cyproterone acetate_vs_leuprolide acetate in combination with transdermal oestradiol in transwomen: a comparison of safety and effectiveness. Clinical Endocrinology, 85(2), 239–246. [DOI:10.1111/cen.13050]
- Gava, G., Mancini, I., Alvisi, S., Seracchioli, R., & Meriggiola, M. C. (2020). A comparison of 5-year administration of cyproterone acetate or leuprolide acetate in combination with estradiol in transwomen. European Journal of Endocrinology, 183(6), 561–569. [DOI:10.1530/eje-20-0370]
- Geller, J., Albert, J., Yen, S. S., Geller, S., & Loza, D. (1981). Medical Castration of Males with Megestrol Acetate and Small Doses of Diethylstilbestrol*. The Journal of Clinical Endocrinology & Metabolism, 52(3), 576–580. [DOI:10.1210/jcem-52-3-576]
- Geller, J., Albert, J., Yen, S. S., Geller, S., & Loza, D. (1981). Medical castration with megestrol acetate and minidose of diethylstilbestrol. Urology, 17(4 Suppl), 27–33. [Google 學術] [PubMed]
- Geller, J., & Albert, J. D. (1983). Comparison of various hormonal therapies for prostatic carcinoma. Seminars in Oncology, 10(4 Suppl 4), 34–41. [Google 學術] [PubMed] [PDF]
- Geller, J. (1988). Megestrol acetate and minidose estrogen in prostatic carcinoma. Urology, 32(3), 281–282. [DOI:10.1016/0090-4295(88)90402-5]
- Geller J. (1991). Megestrol acetate plus low-dose estrogen in the management of advanced prostatic carcinoma. The Urologic Clinics of North America, 18(1), 83–91. [DOI:10.1016/S0094-0143(21)01395-1] [PDF]
- Giltay, E. J., & Gooren, L. J. (2000). Effects of Sex Steroid Deprivation/Administration on Hair Growth and Skin Sebum Production in Transsexual Males and Females. The Journal of Clinical Endocrinology & Metabolism, 85(8), 2913–2921. [DOI:10.1210/jcem.85.8.6710]
- Giltay, E. J., Gooren, L. J., Emeis, J. J., Kooistra, T., & Stehouwer, C. D. (2000). Oral, but Not Transdermal, Administration of Estrogens Lowers Tissue-Type Plasminogen Activator Levels in Humans Without Affecting Endothelial Synthesis. Arteriosclerosis, Thrombosis, and Vascular Biology, 20(5), 1396–1403. [DOI:10.1161/01.atv.20.5.1396]
- Giltay, E. J., Verhoef, P., Gooren, L. J., Geleijnse, J. M., Schouten, E. G., & Stehouwer, C. D. (2003). Oral and transdermal estrogens both lower plasma total homocysteine in male-to-female transsexuals. Atherosclerosis, 168(1), 139–146. [DOI:10.1016/s0021-9150(03)00090-x]
- Giltay, E. J., Gooren, L. J., Toorians, A. W., Katan, M. B., & Zock, P. L. (2004). Docosahexaenoic acid concentrations are higher in women than in men because of estrogenic effects. The American Journal of Clinical Nutrition, 80(5), 1167–1174. [DOI:10.1093/ajcn/80.5.1167]
- Glintborg, D., T’Sjoen, G., Ravn, P., & Andersen, M. S. (2021). MANAGEMENT OF ENDOCRINE DISEASE: Optimal feminizing hormone treatment in transgender people. European Journal of Endocrinology, 185(2), R49–R63. [DOI:10.1530/eje-21-0059]
- Goldenberg, S. L., Bruchovsky, N., Rennie, P. S., & Coppin, C. M. (1988). The Combination of Cyproterone Acetate and Low Dose Diethylstilbestrol in the Treatment of Advanced Prostatic Carcinoma. Journal of Urology, 140(6), 1460–1465. [DOI:10.1016/s0022-5347(17)42073-8]
- Goldenberg, S. L., & Bruchovsky, N. (1991). Use of cyproterone acetate in prostate cancer. The Urologic Clinics of North America, 18(1), 111–122. [DOI:10.1016/S0094-0143(21)01398-7] [PDF]
- Goldenberg, S., Bruchovsky, N., Gleave, M., & Sullivan, L. (1996). Low-dose cyproterone acetate plus mini-dose diethylstilbestrol—A protocol for reversible medical castration. Urology, 47(6), 882–884. [DOI:10.1016/s0090-4295(96)00048-9]
- Gooren, L. J., Giltay, E. J., & Bunck, M. C. (2008). Long-Term Treatment of Transsexuals with Cross-Sex Hormones: Extensive Personal Experience. The Journal of Clinical Endocrinology & Metabolism, 93(1), 19–25. [DOI:10.1210/jc.2007-1809]
- Gräf, K., Brotherton, J., & Neumann, F. (1974). Clinical Uses of Antiandrogens. In Hughes, A., Hasan, S. H., Oertel, G. W., Voss, H. E., Bahner, F., Neumann, F., Steinbeck, H., Gräf, K.-J., Brotherton, J., Horn, H. J., & Wagner, R. K. (Eds.). Androgens II and Antiandrogens / Androgene II und Antiandrogene (Handbuch der experimentellen Pharmakologie/Handbook of Experimental Pharmacology, Volume 35, Part 2) (pp. 485–542). Berlin/Heidelberg: Springer. [DOI:10.1007/978-3-642-80859-3_7]
- Hammerstein, J., Meckies, J., Leo-Rossberg, I., Moltz, L., & Zielske, F. (1975). Use of cyproterone acetate (CPA) in the treatment of acne, hirsutism and virilism. Journal of Steroid Biochemistry, 6(6), 827–836. [DOI:10.1016/0022-4731(75)90311-8]
- Hammerstein, J. (1979). Cyproterone Acetate. In Jacobs, H. S. (Ed.). Advances in Gynaecological Endocrinology: Proceedings of the Sixth Study Group of the Royal College of Obstetricians and Gynaecologists, 18th and 19th October, 1978 (pp. 367–382). London: The College. [Google 學術] [Google 閲讀] [PDF]
- Hammerstein, J. (1990). Antiandrogens: Clinical Aspects. In Orfanos, C. E., & Happle, R. (Eds.). Hair and Hair Diseases (pp. 827–886). Berlin/Heidelberg: Springer. [DOI:10.1007/978-3-642-74612-3_35]
- Heath, R. A., & Wynne, K. (2019). A Guide to Transgender Health: State-of-the-art Information for Gender-Affirming People and Their Supporters (p. 122). Santa Barbara: Praeger/ABC-CLIO. [Google 閲讀]
- Hembree, W. C., Cohen-Kettenis, P., Delemarre-Van De Waal, H. A., Gooren, L. J., Meyer III, W. J., Spack, N. P., Tangpricha, V., & Montori, V. M. (2009). Endocrine treatment of transsexual persons: an Endocrine Society clinical practice guideline. The Journal of Clinical Endocrinology & Metabolism, 94(9), 3132–3154. [DOI:10.1210/jc.2009-0345]
- Hembree, W. C., Cohen-Kettenis, P. T., Gooren, L., Hannema, S. E., Meyer, W. J., Murad, M. H., Rosenthal, S. M., Safer, J. D., Tangpricha, V., & T’Sjoen, G. G. (2017). Endocrine Treatment of Gender-Dysphoric/Gender-Incongruent Persons: An Endocrine Society* Clinical Practice Guideline [2nd Version]. The Journal of Clinical Endocrinology & Metabolism, 102(11), 3869–3903. [DOI:10.1210/jc.2017-01658] [PDF]
- Jacobeit, J. W. (2019). Die hormonelle Behandlung von adulten Trans*Personen (in Deutschland). [Hormonal treatment of adult trans* persons (in Germany).] Journal für Klinische Endokrinologie und Stoffwechsel, 12(3), 102–110. [DOI:10.1007/s41969-019-00080-x]
- Jacobi, G. H., Altwein, J. E., Kurth, K. H., Basting, R., & Hohenfellner, R. (1980). Treatment of Advanced Prostatic Cancer with Parenteral Cyproterone Acetate: A Phase III Randomised Trial*. British Journal of Urology, 52(3), 208–215. [DOI:10.1111/j.1464-410x.1980.tb02961.x]
- Jacobi, G. H., Tunn, U., & Senge, T. (1982). Clinical experience with cyproterone acetate for palliation of inoperable prostate cancer. In Jacobi, G. H., & Hohenfellner, R. (Eds.). Prostate Cancer, 3, 305–319. Baltimore: Williams & Wilkins. [Google 學術] [PDF]
- Jain, J., Kwan, D., & Forcier, M. (2019). Medroxyprogesterone Acetate in Gender-Affirming Therapy for Transwomen: Results From a Retrospective Study. The Journal of Clinical Endocrinology & Metabolism, 104(11), 5148–5156. [DOI:10.1210/jc.2018-02253]
- Jequier, A. M., Bullimore, N. J., & Bishop, M. J. (1989). Cyproterone Acetate and a Small Dose of Oestrogen in the Pre-operative Management of Male Transsexuals. A Report of Three Cases. [Cyproteronacetat und kleine Östrogendosis in dem präoperativen Management männlicher Transsexueller. Bericht über drei Fälle.] Andrologia, 21(5), 456–461. [DOI:10.1111/j.1439-0272.1989.tb02447.x]
- Johnson, D. E., Babaian, R. J., Swanson, D. A., Von Eschenbach, A. C., Wishnow, K. I., & Tenney, D. (1988). Medical castration using megestrol acetate and minidose estrogen. Urology, 31(5), 371–374. [DOI:10.1016/0090-4295(88)90726-1]
- Knuth, U. A., Hano, R., & Nieschlag, E. (1984). Effect of Flutamide or Cyproterone Acetate on Pituitary and Testicular Hormones in Normal Men. The Journal of Clinical Endocrinology & Metabolism, 59(5), 963–969. [DOI:10.1210/jcem-59-5-963]
- Koch, U. J., Lorenz, F., Danehl, K., & Hammerstein, J. (1975). Über die Verwendbarkeit von Cyproteronacetat zur Fertilitätshemmung beim Mann. Morphologische Veränderungen und Einflüsse auf die Spermienmotilität. Archiv für Gynäkologie, 219(1–4), 581–582. [DOI:10.1007/bf00669258]
- Koch, U., Lorenz, F., Danehl, K., Ericsson, R., Hasan, S., Keyserlingk, D., Lübke, K., Mehring, M., Römmler, A., Schwartz, U., & Hammerstein, J. (1976). Continuous oral low-dosage cyproterone acetate for fertility regulation in the male? A trend analysis in 15 volunteers. Contraception, 14(2), 117–135. [DOI:10.1016/0010-7824(76)90081-0]
- Kranz, G. S., Seiger, R., Kaufmann, U., Hummer, A., Hahn, A., Ganger, S., Tik, M., Windischberger, C., Kasper, S., & Lanzenberger, R. (2017). Effects of sex hormone treatment on white matter microstructure in individuals with gender dysphoria. NeuroImage, 150, 60–67. [DOI:10.1016/j.neuroimage.2017.02.027]
- Kranz, G. S., Kaufmann, U., & Lanzenberger, R. (2020). Probing the Impact of Gender-Affirming Hormone Treatment on Odor Perception. Chemical Senses, 45(1), 37–44. [DOI:10.1093/chemse/bjz069]
- Kuijpers, S. M., Wiepjes, C. M., Conemans, E. B., Fisher, A. D., T’Sjoen, G., & den Heijer, M. (2021). Toward a Lowest Effective Dose of Cyproterone Acetate in Trans Women: Results From the ENIGI Study. The Journal of Clinical Endocrinology & Metabolism, 106(10), e3936–e3945. [DOI:10.1210/clinem/dgab427]
- Kumar, P., Reddy, S., Kulkarni, A., Sharma, M., & Rao, P. N. (2021). Cyproterone acetate induced acute liver failure: case report and review of the literature. Journal of Clinical and Experimental Hepatology, 11(6), 739–741. [DOI:10.1016/j.jceh.2021.01.003]
- Lederbogen, S. (2009). Hormonbehandlung. PiD - Psychotherapie im Dialog, 10(1), 41–43. [DOI:10.1055/s-0028-1090190]
- Lim, H. Y., Leemaqz, S. Y., Torkamani, N., Grossmann, M., Zajac, J. D., Nandurkar, H., Ho, P., & Cheung, A. S. (2020). Global Coagulation Assays in Transgender Women on Oral and Transdermal Estradiol Therapy. The Journal of Clinical Endocrinology & Metabolism, 105(7), e2369–e2377. [DOI:10.1210/clinem/dgaa262]
- Liu, P. Y., Takahashi, P., & Veldhuis, J. D. (2017). An Ensemble Perspective of Aging-Related Hypoandrogenemia in Men. In Winters, S. J., & Huhtaniemi, I. T. (Eds.). Male Hypogonadism: Basic, Clinical and Therapeutic Principles, 2nd Edition (pp. 325–347). Cham: Springer. [DOI:10.1007/978-3-319-53298-1_16]
- Mahfouda, S., Moore, J. K., Siafarikas, A., Hewitt, T., Ganti, U., Lin, A., & Zepf, F. D. (2019). Gender-affirming hormones and surgery in transgender children and adolescents. The Lancet Diabetes & Endocrinology, 7(6), 484–498. [DOI:10.1016/s2213-8587(18)30305-x]
- Meriggiola, M. C., Bremner, W. J., Costantino, A., Di Cintio, G., & Flamigni, C. (1998). Low dose of cyproterone acetate and testosterone enanthate for contraception in men. Human Reproduction, 13(5), 1225–1229. [DOI:10.1093/humrep/13.5.1225]
- Meriggiola, M. C., Bremner, W. J., Costantino, A., Bertaccini, A., Morselli-Labate, A. M., Huebler, D., Kaufmann, G., Oettel, M., & Flamigni, C. (2002). Twenty-One Day Administration of Dienogest Reversibly Suppresses Gonadotropins and Testosterone in Normal Men. The Journal of Clinical Endocrinology & Metabolism, 87(5), 2107–2113. [DOI:10.1210/jcem.87.5.8514]
- Meriggiola, M. C., Costantino, A., Bremner, W. J., & Morselli-Labate, A. M. (2002). Higher Testosterone Dose Impairs Sperm Suppression Induced by a Combined Androgen‐Progestin Regimen. Journal of Andrology, 23(5), 684–690. [DOI:10.1002/j.1939-4640.2002.tb02311.x]
- Meyer, G., Mayer, M., Mondorf, A., Flügel, A. K., Herrmann, E., & Bojunga, J. (2020). Safety and rapid efficacy of guideline-based gender-affirming hormone therapy: an analysis of 388 individuals diagnosed with gender dysphoria. European Journal of Endocrinology, 182(2), 149–156. [DOI:10.1530/eje-19-0463] [PDF]
- Moltz, L., Römmler, A., Schwartz, U., & Hammerstein, J. (1978). Effects of Cyproterone Acetate (CPA) on Pituitary Gonadotrophin Release and on Androgen Secretion Before and After LH-RH Double Stimulation Tests in Men. International Journal of Andrology, 1(Suppl 2b) [5th Annual Workshop on the Testis, Geilo, Norway, April 1978, Endocrine Approach to Male Contraception], 713–719. [DOI:10.1111/j.1365-2605.1978.tb00518.x]
- Moltz, L., Römmler, A., Schwartz, U., Post, K., & Hammerstein, J. (1978). Cyproterone acetate (CPA)—a potential male contraceptive: further studies on the interactions with endocrine parameters. Journal of Steroid Biochemistry, 9(9), 865–865 (abstract no. 252). [DOI:10.1016/0022-4731(78)90952-4]
- Moltz, L., Römmler, A., Post, K., Schwartz, U., & Hammerstein, J. (1980). Medium dose cyproterone acetate (CPA): Effects on hormone secretion and on spermatogenesis in men. Contraception, 21(4), 393–413. [DOI:10.1016/s0010-7824(80)80017-5]
- Moltz, L., Koch, U., Schwartz, U., Rommler, A., & Hammerstein, J. (1982). Male fertility regulation with cyproterone acetate (CPA). Contraceptive Delivery Systems, 3(3/4) [Retroproductive Health Care International Symposium, October 10-15 1982 Maui, Hawaii, USA, Expanded Abstracts], 298–298 (abstract no. 293). [Google 學術] [PDF]
- Moore, E., Wisniewski, A., & Dobs, A. (2003). Endocrine Treatment of Transsexual People: A Review of Treatment Regimens, Outcomes, and Adverse Effects. The Journal of Clinical Endocrinology & Metabolism, 88(8), 3467–3473. [DOI:10.1210/jc.2002-021967]
- Nelson, J. B. (2012). Hormone Therapy for Prostate Cancer. In Wein, A. J., Kavoussi, L. R., Novick, A. C., Partin, A. W., & Peters, C. A. (Eds.). Campbell-Walsh Urology, 10th Edition, Volume 2 (pp. 2920–2953). Philadelphia: Elsevier/Saunders. [Google 學術] [Google 閲讀]
- Nota, N. M., den Heijer, M., Gooren, L. J. (2019). Evaluation and Treatment of Gender-Dysphoric/Gender Incongruent Adults. [Updated 2019 Jul 21]. In Feingold, K. R., Anawalt, B., Blackman, M. R., et al. (Eds.). Endotext [Internet]. South Dartmouth, Massachusetts: MDText.com. [PubMed]
- Oliphant, J., Veale, J., Macdonald, J., Carroll, R., Johnson, R., Harte, M., Stephenson, C. & Bullock, J. (2018). Guidelines for Gender Affirming Healthcare for Gender Diverse and Transgender Children, Young People and Adults in Aotearoa New Zealand. Waikato: Transgender Health Research Lab/University of Waikato. [URL] [PDF]
- Ott, J., Aust, S., Promberger, R., Huber, J. C., & Kaufmann, U. (2011). Cross‐Sex Hormone Therapy Alters the Serum Lipid Profile: A Retrospective Cohort Study in 169 Transsexuals. The Journal of Sexual Medicine, 8(8), 2361–2369. [DOI:10.1111/j.1743-6109.2011.02311.x]
- Petry, R., Mauss, J., Senge, T., & Rausch-Stroomann, J. (1970). Über den Einfluß von Cyproteronacetat, Norethisteronönanthat und Gestonoroncapronat auf die Hypophysen-Gonadenachse beim Mann. [Influence of Cyproterone-acetate, Norethisterone-enanthate and Gestonorone-capronate on the Hypophyseal-Gonadal-Axis in the Male.] In Kracht, J. (Ed.). Endokrinologie der Entwicklung und Reifung, 16. Symposion, Ulm, 26.-28. Februar 1970 (Symposion der Deutschen Gesellschaft für Endokrinologie, Volume 16) (pp. 428–430). Berlin: Springer. [Google 閲讀] [DOI:10.1007/978-3-642-80591-2_118] [WorldCat] [PDF]
- Petry, R., Rausch-Stroomann, J.-G., Berthold, K. Mauss, J., Ai, M., Senge, Th., & Vermeulen, A. (1970). Untersuchungen zum Wirkungsmechanismus der Antiandrogene Cyproteron und Cyproteronacetat beim Menschen (Gonadotropin-, Plasma-testosteron- und morphologische Keimdrüsenuntersuchungen). [Investigations on the mechanism of action of the antiandrogens cyproterone and cyproterone acetate in humans (gonadotropin, plasma testosterone, and morphological gonad investigations).] In Schlegel, B. (Ed.). Verhandlungen der Deutschen Gesellschaft für Innere Medizin: Sechsundsiebzigster Kongress Gehalten zu Wiesbaden vom 6. April – 9. April 1970 (Verhandlungen der Deutschen Gesellschaft für Innere Medizin, Volume 76) (pp. 873–876). München: Bergmann. [Google 學術] [Google 閲讀] [DOI:10.1007/978-3-642-85446-0] [WorldCat] [PDF]
- Petry, R., Rausch-Stroomann, J. G., Mauss, J., Senge, Th., Ai, M., & Berthold, K. (1970). Investigations on the mode of action of the antiandrogens cyproterone and cyproterone acetate in man. / Investigations on the mechanism of action of anti androgenic cyproterone and cyproterone acetate in humans (gonadotropin, plasma testosterone, and morphological generative gland investigations). Medizinische Welt, 29, 1336–. [EurekaMag] [被 Koch et al. (1976) 所引用]
- Petry, R., Mauss, J., Rausch-Stroomann, J. G., & Vermeulen, A. (1972). Reversible inhibition of spermatogenesis in men. Hormone and Metabolic Research, 4(5), 386–388. [DOI:10.1055/s-0028-1094040]
- Roy, S., Chatterjee, S., Prasad, M., Poddar, A., Pandey, D., Pandey, H., & Jadhav, Y. (1976). Effects of cyproterone acetate on reproductive functions in normal human males. Contraception, 14(4), 403–423. [DOI:10.1016/s0010-7824(76)80055-8]
- Roy, S., & Chatterjee, S. (1979). Studies with cyproterone acetate for male contraception. In James, V. H. T., & Pasqualini, J. R. (Eds.). Hormonal Steroids: Proceedings of the Fifth International Congress on Hormonal Steroids, New Delhi, India, October/November 1978 (pp. 675–680). Oxford: Pergamon Press. [DOI:10.1016/b978-0-08-023796-1.50099-2]
- Roy, S., & Chatterjee, S. (1979). The Role of Antiandrogenic Action in Cyproterone Acetate-Induced Morphologic and Biochemical Changes in Human Semen. Fertility and Sterility, 32(1), 93–95. [DOI:10.1016/s0015-0282(16)44122-1]
- Saborowski, K.-J. (1987). Konservative Therapie mit Cyproteronacetat und Estradiolundecylat beim Fortgeschrittenen Prostatacarcinom: Eine 5-Jahres-Studie. [Conservative Therapy with Cyproterone Acetate and Estradiol Undecylate in Advanced Prostate Cancer: A 5-Year Study.] (Doctoral dissertation, Ruhr-University Bochum.) [共 58 頁] [Google 學術] [Google 閲讀] [WorldCat] [PDF] [英譯本]
- Scharff, M., Wiepjes, C. M., Klaver, M., Schreiner, T., T’Sjoen, G., & den Heijer, M. (2019). Change in grip strength in trans people and its association with lean body mass and bone density. Endocrine Connections, 8(7), 1020–1028. [DOI:10.1530/ec-19-0196]
- Schröder, F. H., & Radlmaier, A. (2002). Steroidal Antiandrogens. In Jordan, C. V., & Furr, B. J. A. (Eds.). Hormone Therapy in Breast and Prostate Cancer (pp. 325–346). Totowa, New Jersey: Humana Press. [DOI:10.1007/978-1-59259-152-7_15]
- Slagter, M. H., Gooren, L. J., de Ronde, W., Soosaipillai, A., Scorilas, A., Giltay, E. J., Paliouras, M., & Diamandis, E. P. (2006). Serum and Urine Tissue Kallikrein Concentrations in Male-to-Female Transsexuals Treated with Antiandrogens and Estrogens. Clinical Chemistry, 52(7), 1356–1365. [DOI:10.1373/clinchem.2006.068932]
- Sofer, Y., Yaish, I., Yaron, M., Bach, M. Y., Stern, N., & Greenman, Y. (2020). Differential Endocrine and Metabolic Effects of Testosterone Suppressive Agents in Transgender Women. Endocrine Practice, 26(8), 883–890. [DOI:10.4158/ep-2020-0032] [PDF]
- T’Sjoen, G. G., Beguin, Y., Feyen, E., Rubens, R., Kaufman, J., & Gooren, L. (2005). Influence of exogenous oestrogen or (anti-) androgen administration on soluble transferrin receptor in human plasma. Journal of Endocrinology, 186(1), 61–67. [DOI:10.1677/joe.1.06112]
- T’Sjoen, G., Weyers, S., Taes, Y., Lapauw, B., Toye, K., Goemaere, S., & Kaufman, J. (2009). Prevalence of Low Bone Mass in Relation to Estrogen Treatment and Body Composition in Male-to-Female Transsexual Persons. Journal of Clinical Densitometry, 12(3), 306–313. [DOI:10.1016/j.jocd.2008.11.002]
- T’Sjoen, G., Arcelus, J., De Vries, A. L., Fisher, A. D., Nieder, T. O., Özer, M., & Motmans, J. (2020). European Society for Sexual Medicine Position Statement “Assessment and Hormonal Management in Adolescent and Adult Trans People, with Attention for Sexual Function and Satisfaction”. The Journal of Sexual Medicine, 17(4), 570–584. [DOI:10.1016/j.jsxm.2020.01.012]
- Tack, L. J., Heyse, R., Craen, M., Dhondt, K., Bossche, H. V., Laridaen, J., & Cools, M. (2017). Consecutive Cyproterone Acetate and Estradiol Treatment in Late-Pubertal Transgender Female Adolescents. The Journal of Sexual Medicine, 14(5), 747–757. [DOI:10.1016/j.jsxm.2017.03.251]
- Toorians, A. W., Thomassen, M. C., Zweegman, S., Magdeleyns, E. J., Tans, G., Gooren, L. J., & Rosing, J. (2003). Venous Thrombosis and Changes of Hemostatic Variables during Cross-Sex Hormone Treatment in Transsexual People. The Journal of Clinical Endocrinology & Metabolism, 88(12), 5723–5729. [DOI:10.1210/jc.2003-030520]
- Torre, B. l., Norén, S., Hedman, M., & Diczfalusy, E. (1979). Effect of cyproterone acetate (CPA) on gonadal and adrenal function in men. Contraception, 20(4), 377–396. [DOI:10.1016/s0010-7824(79)80048-7]
- Van Caenegem, E., Wierckx, K., Taes, Y., Schreiner, T., Vandewalle, S., Toye, K., Kaufman, J., & T’Sjoen, G. (2015). Preservation of volumetric bone density and geometry in trans women during cross-sex hormonal therapy: a prospective observational study. Osteoporosis International, 26(1), 35–47. [DOI:10.1007/s00198-014-2805-3]
- van Dijk, D., Dekker, M. J., Conemans, E. B., Wiepjes, C. M., de Goeij, E. G., Overbeek, K. A., Fisher, A. D., den Heijer, M., & T’Sjoen, G. (2019). Explorative Prospective Evaluation of Short-Term Subjective Effects of Hormonal Treatment in Trans People—Results from the European Network for the Investigation of Gender Incongruence. The Journal of Sexual Medicine, 16(8), 1297–1309. [DOI:10.1016/j.jsxm.2019.05.009]
- van Velzen, D. M., Paldino, A., Klaver, M., Nota, N. M., Defreyne, J., Hovingh, G. K., Thijs, A., Simsek, S., T’Sjoen, G., & den Heijer, M. (2019). Cardiometabolic Effects of Testosterone in Transmen and Estrogen Plus Cyproterone Acetate in Transwomen. The Journal of Clinical Endocrinology & Metabolism, 104(6), 1937–1947. [DOI:10.1210/jc.2018-02138]
- Venner, P. M., Klotz, P. G., Klotz, L. H., Stewart, D. J., Davis, I. R., Orovan, W. L., & Ramsey, E. W. (1988). Megestrol acetate plus minidose diethylstilbestrol in the treatment of carcinoma of the prostate. Seminars in Oncology, 15(2 Suppl 1), 62–67. [Google 學術] [PubMed]
- Vereecke, G. (2019). Characterisation of testicular function and spermatogenesis in transgender women. (Master’s thesis, Ghent University.) [PDF]
- Vereecke, G., Defreyne, J., Van Saen, D., Collet, S., Van Dorpe, J., T’Sjoen, G., & Goossens, E. (2021). Characterisation of testicular function and spermatogenesis in transgender women. Human Reproduction, 36(1), 5–15. [DOI:10.1093/humrep/deaa254]
- Vita, R., Settineri, S., Liotta, M., Benvenga, S., & Trimarchi, F. (2018). Changes in hormonal and metabolic parameters in transgender subjects on cross-sex hormone therapy: A cohort study. Maturitas, 107, 92–96. [DOI:10.1016/j.maturitas.2017.10.012]
- Vlot, M. C., Wiepjes, C. M., Jongh, R. T., T’Sjoen, G., Heijboer, A. C., & den Heijer, M. (2019). Gender‐Affirming Hormone Treatment Decreases Bone Turnover in Transwomen and Older Transmen. Journal of Bone and Mineral Research, 34(10), 1862–1872. [DOI:10.1002/jbmr.3762]
- Wang, C., & Yeung, K. (1980). Use of low-dosage oral cyproterone acetate as a male contraceptive. Contraception, 21(3), 245–272. [DOI:10.1016/0010-7824(80)90005-0]
- Wiepjes, C. M., Vlot, M. C., Klaver, M., Nota, N. M., de Blok, C. J., de Jongh, R. T., Lips, P., Heijboer, A. C., Fisher, A. D., Schreiner, T., T’Sjoen, G., & den Heijer, M. (2017). Bone Mineral Density Increases in Trans Persons After 1 Year of Hormonal Treatment: A Multicenter Prospective Observational Study. Journal of Bone and Mineral Research, 32(6), 1252–1260. [DOI:10.1002/jbmr.3102]
- Wiepjes, C. M., Vlot, M. C., de Blok, C. J., Nota, N. M., de Jongh, R. T., & den Heijer, M. (2019). Bone geometry and trabecular bone score in transgender people before and after short- and long-term hormonal treatment. Bone, 127, 280–286. [DOI:10.1016/j.bone.2019.06.029]
- Wierckx, K., Mueller, S., Weyers, S., Van Caenegem, E., Roef, G., Heylens, G., & T’Sjoen, G. (2012). Long‐Term Evaluation of Cross‐Sex Hormone Treatment in Transsexual Persons. The Journal of Sexual Medicine, 9(10), 2641–2651. [DOI:10.1111/j.1743-6109.2012.02876.x]
- Wierckx, K., Van Caenegem, E., Schreiner, T., Haraldsen, I., Fisher, A., Toye, K., Kaufman, J. M., & T’Sjoen, G. (2014). Cross‐Sex Hormone Therapy in Trans Persons Is Safe and Effective at Short‐Time Follow‐Up: Results from the European Network for the Investigation of Gender Incongruence. The Journal of Sexual Medicine, 11(8), 1999–2011. [DOI:10.1111/jsm.12571]
- Winkler-Crepaz, K., Müller, A., Böttcher, B., & Wildt, L. (2017). Hormonbehandlung bei Transgenderpatienten. [Hormone treatment of transgender patients.] Gynäkologische Endokrinologie, 15(1), 39–42. [DOI:10.1007/s10304-016-0116-9]
- Winters, S. J., Wang, C., & Fortigel Study Group. (2013). LH and Non-SHBG Testosterone and Estradiol Levels During Testosterone Replacement of Hypogonadal Men: Further Evidence That Steroid Negative Feedback Increases as Men Grow Older. Journal of Andrology, 31(3), 281–287. [DOI:10.2164/jandrol.109.009035]
- Zitzmann, M., Rohayem, J., Raidt, J., Kliesch, S., Kumar, N., Sitruk-Ware, R., & Nieschlag, E. (2017). Impact of various progestins with or without transdermal testosterone on gonadotropin levels for non-invasive hormonal male contraception: a randomized clinical trial. Andrology, 5(3), 516–526. [DOI:10.1111/andr.12328]
- Zubiaurre-Elorza, L., Junque, C., Gómez-Gil, E., & Guillamon, A. (2014). Effects of Cross-Sex Hormone Treatment on Cortical Thickness in Transsexual Individuals. The Journal of Sexual Medicine, 11(5), 1248–1261. [DOI:10.1111/jsm.12491]
譯文修訂歷史
| 時間 | 備註 |
|---|---|
| 2022 年 3 月 2 日 | 首次翻譯。 |
| 2022 年 10 月 21 日 | 第一次修訂,增補“後記四”“後記五”內容,整理外鏈。 |
| 2023 年 3 月 24 日 | 第二次修訂,增補“參考文獻”,補充遺漏或有變動的敍述,補全並更新外鏈。 |
| 2023 年 3 月 29 日 | 更新諸後記標題。 |
| 2023 年 4 月 4 日 | 第三次修訂,增補“表一”和諸表格標題,更新個別敍述,添加相關文獻。 |
| 2023 年 6 月 29 日 | 更正“己烯雌酚”譯名。 |